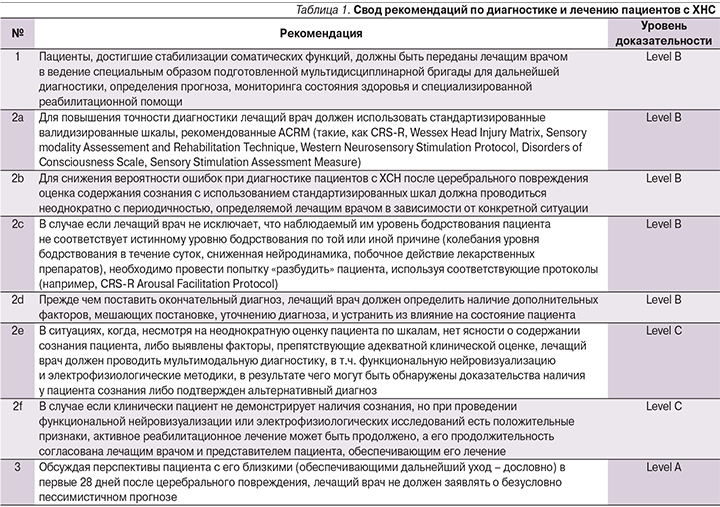
Впроведенном систематическом обзоре [1] рассмотрены проблемы ведения пациентов с хроническим нарушением сознания (ХНС; т.е. с длительностью нарушения сознания >28 дней) на каждом этапе течения заболевания. Диагностика уровня сознания таких пациентов осложняется тяжелым неврологическим дефицитом [2] и возможной недооценкой неявных признаков сознания [3]. Точная постановка диагноза необходима для разъяснения семье пациента информации о его уровне бодрствования и возможности взаимодействия, определении дальнейшего прогноза. Пробелы в знаниях зачастую приводят к формированию у неспециалистов как излишне оптимистичных, так и пессимистичных ожиданий [4].
С учетом этого шансы на восстановление таких пациентов повышаются в том случае, когда лечение проводится под руководством клиницистов, обладающих знаниями о рисках, ассоциированных с ХНC и способных проводить адекватное и своевременное лечение [5]. Это подтверждается данными, полученными при ретроспективном анализе регистра больных с черепно-мозговой травмой, согласно которым кумулятивная смертность в течение 3 лет после выписки среди пациентов, в дальнейшем находившихся в реабилитационных центрах или в домашних условиях, была значительно ниже, чем среди лиц, пребывавших в домах ухода [6]. Ведение пациента с ХНС должно осуществляться мультидисциплинарной реабилитационной бригадой, включающей невролога, психолога, нейропсихолога, психиатра, врача физической реабилитационной медицины, эрготерапевта, логопеда, медсестру, нутрициолога, терапевта и социального работника.
У пациентов с тяжелыми нарушениями сознания грубо нарушаются двигательные и когнитивные функции, что затрудняет постановку диагноза и определение значимых поведенческих признаков, свидетельствующих о наличии сознания, от случайных реакций, не имеющих диагностического значения. Интерпретация простых двигательных ответов и неустойчивых поведенческих откликов особенно сложна. Флуктуации уровня бодрствования и выполнения инструкций затрудняют проведение объективного клинического осмотра [7, 8]. Сформировавшиеся поражения центральной и периферической нервной системы, такие как афазия, нарушения чувствительности и нервно-мышечной передачи, могут скрывать более высокий уровень содержания сознания [9–11]. Использование нестандартизированных процедур осмотра приводит к постановке неверного диагноза в 40% случаев, даже если исследование проводит опытный клиницист [2, 12, 13]. Чаще всего затруднения вызывает дифференциальная диагностика синдрома «запертого человека» (locked-in syndrome) с синдромом безответного бодрствования (unresponsive wakefulness syndrome, UWS) и малым сознанием (minimally consciousness state, MCS) [14, 15]. Точное установление уровня содержания сознания определяет как прогноз, так и дальнейшую тактику.
Ввиду сложности точной диагностики уровня содержания сознания у пациентов с ХНС для выявления ключевых диагностических признаков целесообразно использование стандартизированных шкал [12, 16]. Другие методы, такие как индивидуализированная количественная оценка поведенческих реакций, были целесообразны для дифференциальной диагностики осознанных, целеустремленных реакций и рефлекторных, непроизвольных движений в ответ на осмотр [17, 18]. Из существующих стандартизированных инструментов оценки содержания сознания предпочтение следует отдавать имеющим наивысший уровень доказательности. На основании систематического обзора, выполненного ACRM, такими шкалами оказались Шкала восстановления после комы (пересмотренная; CRS-R) [16], Wessex Head Injury Matrix [19], Sensory Modality Assessment and Rehabilitation Technique [20], Western NeuroSensory Stimulation Protocol [21], Disorders of Consciousness Scale [22] and Sensory Stimulation Assessment Measure [23] for use in clinical practice [17].
Если в ходе первичной оценки пациента с ХНС с использованием стандартизированных методик не получено однозначных данных, в частности из-за нестойкости и изменчивости поведенческих ответов (характерно для пациентов с длительным ХНС), не стоит полагаться на результаты единственной экспертизы, т.к. это может способствовать постановке неверного диагноза. Многократные переоценки в динамике могут повышать надежность и точность диагностики по сравнению с единственной оценкой. К настоящему моменту нет данных, позволяющих рекомендовать минимальную продолжительность исследования или регламентирующих периодичность повторных экспертиз. Таким образом, частоту последовательных осмотров с оценкой по шкалам определяет лечащий врач с учетом отмечаемых им и членами мультидисциплинарной бригады изменений в состоянии пациента, появления новых поведенческих реакций либо исчезновения продемонстрированных ранее, и количества времени, прошедшего с последней оценки.
Причины, по которым пациенты с длительным ХНС не демонстрируют свой истинный уровень содержания сознания, включают соматические нарушения, вторичные неврологические осложнения и другие неблагоприятные факторы (например, побочные эффекты лекарственных препаратов). Уровень сознания не может быть оценен точно в периоды действия этих факторов. Пациентам, чей уровень бодрствования колеблется в течение периода наблюдения, необходимо использовать протоколы, направленные на максимальное повышение нейродинамики и способность вступать в контакт (например, CRS-R Arousal Facilitation Protocol, прежде чем оценивать уровень сознания. Идентификация и лечение факторов, неблагоприятно сказывающихся на уровне бодрствования, также могут повышать точность диагностики.
В ходе систематического обзора было выявлено, что некоторые электрофизиологические методы диагностики (связанные с событием вызванные потенциалы мозга; наличие реакций активации в ходе ЭЭГ-мониторинга) могут вносить свой вклад в дифференциальную диагностику состояния малого сознания (СМС) и синдрома безответного бодрствования (СББ). К настоящему моменту отсутствуют убедительные данные, чтобы подтвердить или опровергнуть значение функциональной нейровизуализации, рутинной ЭЭГ или вызванных потенциалов как диагностически важных дополнений к клинической оценке для выявления признаков сознания у пациентов с СББ. Функциональная нейровизуализация является методом, не доступным для большинства пациентов. Однако в двух включенных в обзор исследованиях с использованием функциональной МРТ (фМРТ)-протоколов подсчета слов и называния изображений выявляли положительные результаты у пациентов, чей уровень расценивался как СББ на основании клинической оценки с использованием CRS-R (Coma Recovery Scale-Revised) [24, 25]. В ходе исследований популяции пациентов с ХНС (т.е. пациентов с длительностью нарушения сознания >28 дней) отмечается, что у некоторых больных, не демонстрирующих признаков сознания, фиксируются положительные результаты при проведении функциональной нейровизуализации или электрофизиологических исследований.
В одном из исследований [26] пациенты с СББ, диагностированным клинически, серийные функциональные нейровизуализационные исследования (ПЭТ с 18F-дезоксиглюкозой, функциональная МРТ) выявили признаки активности мозговой деятельности, соответствовавшей как минимум СМС приблизительно у 32% пациентов. Двадцать пять из 75 исследований с использованием высокоплотной ЭЭГ у пациентов с клиническим СББ были классифицированы как наводящие на размышления о наличии СМС [27].
Несмотря на повышение чувствительности методов мультимодальной инструментальной диагностики к обнаружению признаков сознания, в основном эти исследования подтверждают отрицательные результаты у большинства пациентов, чей уровень сознания оценен как СББ на основании клинической оценки, что оставляет неясной связь между результатами инструментальных исследований и наличием сознанием. В большинстве случаев СББ широкое использование мультимодальной диагностики не оказывает влияния на поставновку диагноза. В то же время последствия церебрального повреждения (такие, как выраженный гипертонус) могут затруднять оценку поведенческих реакций и поставить под угрозу точность диагноза. В наиболее масштабном исследовании с использованием функциональной нейровизуализации у пациентов с ХНС, проведенном к настоящему времени, двусмысленные или ошибочные результаты отмечались в 33 из 126 (27%) случаев [26].
Для пациентов с персистирующим СББ положительными прогностическими признаками служат выявленные в первые 2–3 месяца заболевания, оценка по шкале Disability Rating Scale (DRS) <26 баллов, сохранность пика P300 по результатам когнитивных вызванных потенциалов, реакции активации на ЭЭГ и повышение кровотока в области ассоциативной слуховой коры в ответ на знакомый голос, называющий пациента по имени при проведении фМРТ. Наличие данных клинических и нейрофизиологических признаков ассоциировано с более высокой вероятностью повышения уровня содержания сознания в течение 12 месяцев после церебрального повреждения. При этом повреждения мозолистого тела, лучистого венца и верхних дорсолатеральных отделов ствола головного мозга, выявленные при МРТ в первые 6–8 недель после начала заболевания, указывают на менее благоприятный прогноз. Для пациентов с СББ нетравматического постгипоксического генеза выделяется отдельный положительный признак для повышения содержания сознания в течение 24 месяцев после церебрального повреждения: сочетание оценки по CRS-R >6 баллов и сохранности проведения по соматосенсорным путям при билатеральной стимуляции срединного нерва.
Согласно определению рабочей группы AAN от 1994 г., срок, после которого вегетативное состояние считалось перманентным, составлял 3 месяца для нетравматического повреждения головного мозга и 12 месяцев для травматического повреждения. При этом отмечалось, что повышение содержания сознания возможно и по истечении этих сроков, но такие случаи редки и, как правило, ассоциированы с тяжелой инвалидизацией [28]. Согласно последним исследованиям, у некоторых пациентов с длительным ВС (вегетативное состояние)/СББ нетравматического генеза восстановление продолжается и после 3 месяцев. Мета-анализ, выполненный в этом систематическом обзоре, выявил, что у 17% пациентов с ВС/СББ отмечается повышение содержания сознания после 6 месяцев заболевания. По прошествии же 6 месяцев вероятность восстановления более высокого уровня сознания снижается до 7,5% [29].
В связи с вышесказанным дальнейшее использование термина «перманентное ВС/СББ» не рекомендовано, т.к. его использование подразумевает необратимость, что противоречит результатам исследований и сказывается на дальнейшей судьбе пациента и его семьи. Авторы клинических рекомендаций предлагают заменить термин «перманентное ВС/СББ» на «хроническое ВС/СББ», указывающий на стабильность состояния (в соответствии с другими заболеваниями, у которых есть хроническая фаза). Данный термин должен сопровождаться описанием текущей продолжительности ВС/СББ, поскольку результаты исследований указывают на снижение вероятности восстановления сознания с течением времени. Поскольку большинство пациентов с поздним восстановлением сознания (12 месяцев для травматического повреждения головного мозга и 3 месяца для нетравматического) остаются полностью или частично зависимыми от постоянного постороннего ухода, при озвучивании прогноза необходимо подчеркнуть потребность в длительном лечении и довести до сведения лиц, осуществляющих уход, какие конкретные действия и мероприятия должны проводиться.
По результатам систематического обзора было выявлено, что пациенты с ХНС, достигшие уровня СМС в течение первых 5 месяцев после церебрального повреждения, имеют более благоприятный долгосрочный прогноз для функционального восстановления, нежели пациенты с ВС/СББ. Другая закономерность прослеживается в более благоприятном долгосрочном прогнозе у пациентов с СМС травматического генеза по сравнению с нетравматическим [31].
Среди пациентов с ХНС высок уровень осложнений, что негативно сказывается на заболеваемости и смертности [5, 32, 33]. В отношении данной категории пациентов необходимо повышенное внимание ко всем видам возможных осложнений для облегчения их ранней диагностики и лечения, что позволяет добиваться наилучших исходов. К числу наиболее распространенных осложнения у пациентов с ХНС относятся ажитация/агрессия, артериальная гипертензия, нарушения сна и инфекции мочевых путей. Среди более серьезные осложнений часто отмечаются гидроцефалия, пневмония и вегетативные кризы [30]. Данные осложнения нередко отбрасывают пациента назад и приводят в повторной госпитализации в отделение интенсивной терапии, сводя на нет достижения реабилитационной бригады [30]. Во избежание этого должна применяться стратегия раннего обнаружения и быстрой коррекции осложнений, включающая ежедневные осмотры лечащим врачом, круглосуточное наблюдение дежурного врача, наличие своевременного доступа к диагностическим ресурсам и консультаций профильных специалистов [30].
Назначение Амантадина (100–200 мг два раза в день) на 4 недели пациентам в возрасте от 16 до 65 лет с ХНС травматического генеза в период между 4-й и 16-й неделями травмы может ускорять функциональное восстановление на ранних стадиях. Более быстрое восстановление уменьшает бремя нетрудоспособности, снижает затраты на лечение и облегчает уход за пациентом.
Большинство методов лечения, предлагаемых пациентам с ХНС (например, гипербарическая оксигенация, лечение стволовыми клетками и т.д.), не обладает достаточной доказательной базой, чтобы подтвердить или опровергнуть целесообразность их использования; при этом многие из этих методов влекут за собой сопутствующие риски. Отчаянно желая помочь своему близкому человеку, родственники пациента могут прибегнуть к таким методам, в связи с чем необходимо информировать их о всех возможных рисках, неоднозначности преимуществ и подчеркнуть, что наблюдаемые улучшения в состоянии пациента могут быть не связаны с проводимыми вмешательствами и объясняться процессами саногенеза.
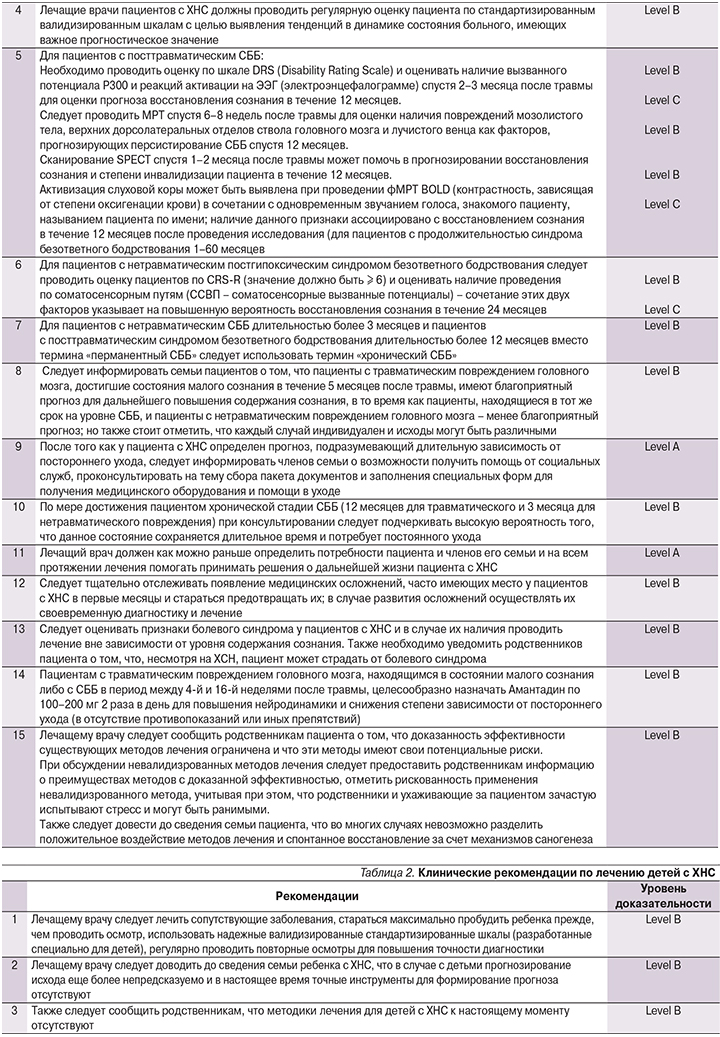
К настоящему моменту отсутствуют какие-либо данные относительно постановки диагноза у детей с ХНС.
В отсутствие специализированных педиатрических данных наиболее разумно применить к детям те же диагностические рекомендации, что и к взрослым. Это сводится к диагностике и лечению состояний, которые могут затруднять постановку диагноза, и регулярной оценке содержания сознания с использованием валидизированных стандартизированных шкал. Представляется возможным, что у детей с ХНС, как и у взрослых, травматический генез повреждения ассоциирован с более благоприятными исходами. Отмечается, что посттравматическая гипертермия может быть связана с неблагоприятным исходом. Терапевтические методы лечения детей с ХНС не исследовались.
В данных рекомендациях отражены методологические подходы к диагностике и лечению пациентов с ХНС. Современная концепция предполагает приоритет клинической диагностики над инструментальной, но в то же время подразумевает приобщение данных нейрофизиологических и нейровизуализационных исследований к результатам неоднократных осмотров и оценок пациента с использованием стандартизированных валидизированных шкал. Также представляется крайне целесообразным сбор катамнеза, отслеживание долгосрочных исходов среди пациентов с ХНС, которые могут начать демонстрировать признаки повышения содержания сознания спустя несколько лет после начала заболевания. В заключение следует отметить, что пациенты с ХНС являются чрезвычайно сложной популяцией для диагностики и лечения, требующей участия мультидисциплинарной диагностической и реабилитационной помощи, поэтому новые рекомендации представляют для клиницистов большой интерес. Они позволяют систематизировать оценку состояния пациента и выбрать наиболее подходящую тактику ведения в каждом конкретном случае (табл. 1, 2).