Введение
Сахарный диабет (СД) занимает первое место в структуре всех эндокринных заболеваний. Его распространенность в мире приближается к 425 млн больных, и, по прогнозам Международной диабетической ассоциации, к 2040 г. это число увеличится до 642 млн человек – преимущественно за счет больных СД 2 типа (СД2) [1]. Второе место в структуре эндокринной патологии принадлежит различным заболеваниям щитовидной железы, среди которых лидирующее место принадлежит такой патологии, как гипотиреоз. Манифестный гипотиреоз встречается у 0,2–2% населения, субклинический – у 4–10%. По данным M. Vanderpump et al., распространенность гипотиреоза составляет от 3 до 16% у мужчин, от 4 до 21% у женщин и с возрастом увеличивается [2].
В настоящее время отмечается рост числа пациентов с сочетанием СД2 и гипотиреоза [3, 4]. И СД2, и гипотиреоз сопровождаются развитием ожирения и дислипидемии, которые приводят к тяжелому атеросклеротическому поражению сосудов, дисметаболическим поражениям нервной системы и миокарда [5, 6]. В свою очередь снижение функции щитовидной железы оказывает дополнительное отрицательное влияние на углеводный, липидный обмены и функцию эндотелия у больных СД, способствует более раннему развитию его микро- и макрососудистых осложнений.
Цель исследования: проанализировать связь между уровнем адипонектина, показателями углеводного и липидного обменов у женщин с СД2, гипотиреозом и их сочетанием.
Методы
Обследованы 119 женщин в возрасте от 45 до 74 лет, распределенных в три группы. В первую группу были включены 42 женщины с первичным манифестным гипотиреозом, медиана возраста которых составила 58,00 (52,00–62,25) лет. Вторую группу составили 38 женщин с СД2 и медианой возраста 60,00 (55,00–64,00) лет. В третью группу вошли 39 женщин с сочетанием гипотиреоза и СД2, медиана возраста которых была 64,00 (60,25–68,00) года. Контролем служили результаты обследования 35 практически здоровых женщин – 20 женщин с медианой возраста 21 (20–22) год (младшая контрольная группа) и 15 женщин, медиана возраста которых составила 51 (47,00–57) год (старшая контрольная группа).
Диагноз «сахарный диабет 2 типа» был установлен в соответствии с критериями Всемирной организации здравоохранения (ВОЗ, 2013) [5]. Диагноз первичного гипотиреоза был установлен в соответствии с классификацией гипотиреоза на основании данных клинико-лабораторного обследования [7].
Среди обследованных пациенток с СД2 и его сочетанием с гипотиреозом наиболее распространенными были жалобы на сухость во рту, жажду, учащенное мочеиспускание, жгучие боли и судороги в нижних конечностях преимущественно в ночное время суток. Данные о наличии осложнений СД и сопутствующих заболеваний у пациенток в этих группах представлены в табл. 1.

У женщин с сочетанием гипотиреоза и СД2 достоверно чаще встречались диабетическая ретинопатия (χ2=7,101; p=0,008), диабетическая полиневропатия (χ2=7,598; p=0,006) и ИБС, стенокардия напряжения (χ2=4,677; p=0,031) относительно группы больных СД2. Диагноз ИБС, стенокардия напряжения и АГ у всех обследованных женщин был установлен кардиологом, согласно рекомендациям ВНОК (Всероссийское научное общество кардиологов, 2008, 2010).
Все обследованные с сочетанием СД2 и гипотиреоза получали заместительную терапию препаратами левотироксина. Медиана дозы левотироксина у этих пациенток составила 100,0 (50,0–106,25) мкг, уровня тиреотропного гормона (ТТГ) – 2,06 (0,78–3,68) мМЕ/л, свободного тироксина (Т4св.) – 12,75 (11,29–14,98) пмоль/л. В качестве сахароснижающей терапии 20 (51,3%) женщин этой группы получали таблетированные препараты (бигуаниды, производные сульфонилмочевины, ингибиторы дипептидилпептидазы-4), 10 (25,6%) пациенток находились на инсулинотерапии, 9 (23,1%) – получали пероральные сахароснижающие препараты в комбинации с инсулином. У 13 (33,3%) женщин гипотиреоз был послеоперационным; для 26 (6,7%) причиной гипотиреоза был хронический аутоиммунный тиреоидит.
В группе больных гипотиреозом все обследованные также получали лечение препаратами левотироксина. Медиана дозы левотироксина составила 62,5 (31,25–93,75) мкг, уровня ТТГ – 1,73 (0,81–3,89) мМЕ/л, Т4св. – 12,97 (10,83–15,28) пмоль/л. Для 32 (76,2%) женщин причиной гипотиреоза стал хронический аутоиммунный тиреодит, для 10 (23,8%) снижение функции щитовидной железы было послеоперационным. Данные о наличии сопутствующих заболеваний у пациенток с гипотиреозом также представлены в табл. 1. Было установлено, что частота ИБС, стенокардии напряжения и АГ была достоверно выше в группе лиц, с сочетанием СД2 и гипотиреоза относительно группы женщин только с гипотиреозом (χ2=11,084; p=0,000 и χ2=6,928; p=0,009 соответственно).
Всем женщинам было проведено антропометрическое обследование – измеряли рост, массу тела, окружность талии (ОТ), окружность бедер (ОБ), с последующим расчетом отношения ОТ/ОБ и индекса массы тела (ИМТ) по формуле [ВОЗ, 1997]: ИМТ=масса тела (кг)/рост (м2). Согласно рекомендациям ВОЗ (1997), значение ИМТ 25–29,9 кг/м2 классифицировали как избыточную массу тела: 30–34,9 кг/м2 – I степень ожирения, 35–39,9 кг/м2 – II степень ожирения, 40 кг/м2 и более – III степень ожирения. Абдоминальное ожирение диагностировали при значении ОТ/ОБ≥0,85, глютеофеморальное – при ОТ/ОБ<0,85.
Всем обследуемым произведен забор крови из вены и определение концентрации глюкозы в плазме крови, уровня иммунореактивного инсулина (ИРИ), общего холестерина (ОХС), холестерина липопротеидов низкой плотности (ХС ЛПНП), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП). На основании полученных результатов были рассчитаны коэффициент атерогенности (КА) (по формуле: КА=(ОХ ЛПВП/ЛПВП) и индекс инсулинорезистентности HOMA-IR – Homeostasis Model Assessment of Insulin Resistance (по формуле: HOMA-IR=ИРИ×гликемия натощак/22,5). О наличии инсулинорезистентности свидетельствовало превышение значения индекса HOMA-IR более 2,77. Всем пациенткам исследовали концентрацию адипонектина в сыворотке крови методом иммуноферментного анализа.
Статистическую обработку полученных результатов проводили с помощью программы Microsoft Excel 2010 и пакета программ SPSS 11.5 (SPSSInc., США). Для анализа качественных признаков строились таблицы сопряженности с расчетом χ2-критерия. При описании полученных результатов использовали медиану 25-й и 75-й процентилей (Ме [25;75]). Достоверность различий между группами оценивали с помощью критерия Манна–Уитни. Для анализа связи двух признаков использовали анализ ранговой корреляции Спирмена. При проверке всех гипотез использовался уровень значимости р<0,05.
Результаты исследования
По результатам антропометрического обследования у женщин с СД2 и его сочетанием с первичным гипотиреозом установлено ожирение I степени. ИМТ у этих пациенток был достоверно выше по сравнению и с группами контроля, и с группой больных гипотиреозом (p<0,05). Кроме того, увеличение ОТ более 80 см и ОТ/ОБ более 0,85 у этих женщин позволило говорить о развитии у них абдоминального ожирения. У больных гипотиреозом медиана ИМТ соответствовала избыточной массе тела и достоверно превышала аналогичный показатель только младшей контрольной группы (табл. 2).
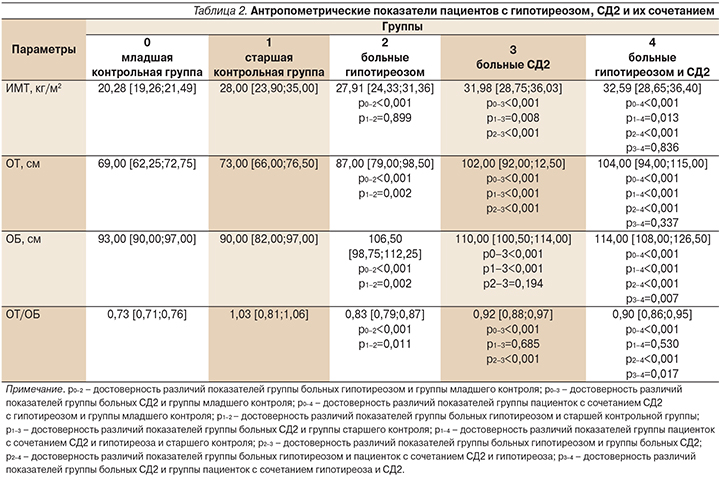
Концентрация глюкозы плазмы в группе больных гипотиреозом соответствовала диапазону нормальных значений, хотя при этом была достоверно выше уровня гликемии в младшей контрольной группе. У женщин с СД2 и его сочетанием с гипотиреозом уровень глюкозы плазмы натощак превышал аналогичный показатель контрольных групп и группы больных гипотиреозом (p<0,001). При этом наличие гипотиреоза ухудшало компенсацию СД2, о чем свидетельствует достоверное увеличение гликемии натощак у пациенток с сочетанием заболеваний относительно группы женщин СД2 без гипотиреоза (p<0,001; табл. 3).
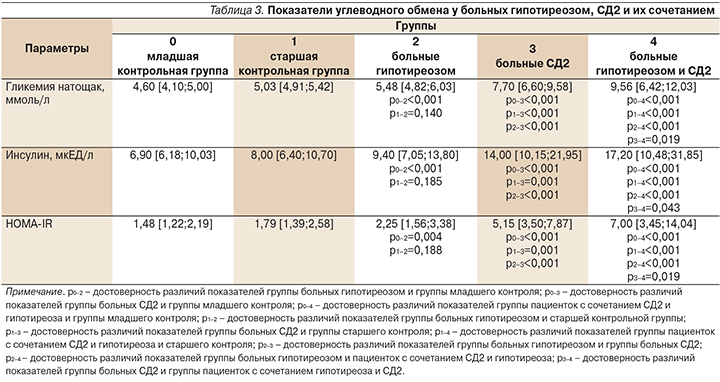
При анализе уровня ИРИ и HOMA-IR у обследованных женщин установлено наличие выраженной инсулинорезистентности и гиперинсулинемии у пациенток с СД2 и его сочетанием с гипотиреозом. В группе больных гипотиреозом выявлена аналогичная направленность изменений этих показателей углеводного обмена относительно только младшей контрольной группы (p<0,05).
Во всех группах обследованных установлено повышение уровня ОХС, ТГ и значения КА относительно младшей контрольной группы (табл. 4).
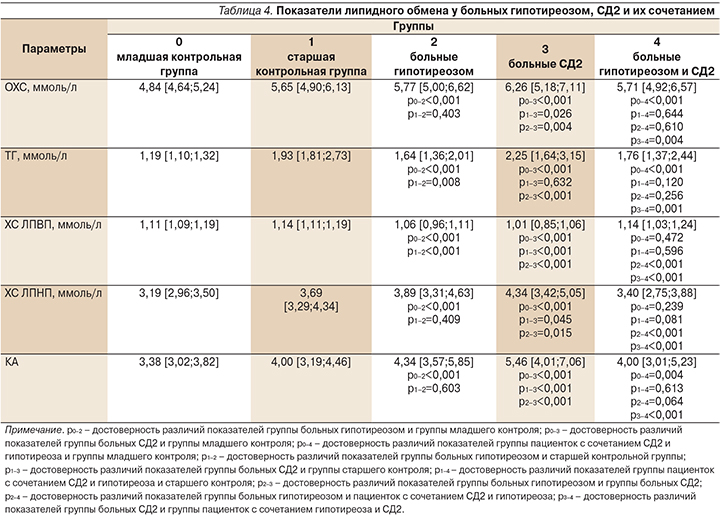
У пациенток с СД2 отмечено повышение уровней ОХС, ХС ЛПНП и снижение ХС ЛПВП по сравнению со старшим контролем.
В группах женщин с СД2 и его сочетанием с гипотиреозом индекс HOMA-IR положительно коррелировал с ИМТ (r=0,380; p<0,001 и r=0,294, p=0,025 соответственно), отношением ОТ/ОБ (r=0,167; p=0,049 и r=0,340, p=0,010 соответственно) и уровнем глюкозы плазмы натощак (r=0,393; p=0,001 и r=0,701, p<0,001 соответственно).
У женщин с гипотиреозом также были выявлены положительные корреляции индекса HOMA-IR с ИМТ (r=0,493; p<0,001), отношением ОТ/ОБ (r=0,218; p=0,038) и глюкозой плазмы (r=0,280; p=0,006). Также у пациенток этой группы уровень ТГ положительно коррелировал с ОТ (r=0,223; p=0,032) и с ОБ (r=0,247; p=0,018). У больных СД2 установлена прямая корреляция отношения ОТ/ОБ с уровнем ОХС (r=0,181; p=0,028) и ТГ (r=0,198; p=0,016), а также обратная – отношения ОТ/ОБ с ХС ЛПВП (r=-0,255; p=0,002). Это может свидетельствовать о роли висцерального ожирения в развитии атерогенных нарушений при СД2.
Установлено снижение концентрации адипонектина во всех трех группах обследованных (табл. 5).
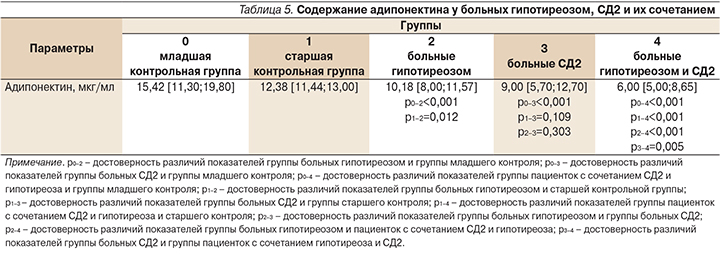
Так, у пациенток с гипотиреозом и его сочетанием с СД2 снижение уровня адипонектина было достоверным относительно обеих контрольных групп. У больных СД2 значимое снижение уровня этого адипокина было отмечено только по сравнению с группой младшего контроля. Минимальная концентрация адипонектина установлена в группе женщин с сочетанием СД2 и гипотиреоза – 6,00 (5,00–8,65) мкг/мл.
В группе больных гипотиреозом уровень адипонектина прямо коррелировал с уровнем ХС ЛПВП (r=0,319; p=0,006) и отрицательно – с уровнями ОХС (r=-0,504, p<0,001), ТГ (r=-0,271, p=0,024), ХС ЛПНП (r=-0,523, p<0,001), КА (r=-0,448, p<0,001).
В группе пациенток с СД2 выявлена обратная связь между адипонектином и инсулином (r=-0,410, p=0,034).
У пациенток с сочетанием гипотиреоза и СД2 уровень адипонектина отрицательно коррелировал с ИМТ (r=-0,374, p=0,002), ОТ (r=-0,404, p=0,001), ОБ (r=-0,397, p=0,001).
Обсуждение
СД2 является важной медико-социальной проблемой во всем мире в связи с ростом заболеваемости, высокой частотой и тяжестью осложнений, трудностью достижения компенсации.
Патофизиологической основой развития СД2 является инсулинорезистентность [8]. Под инсулинорезистентностью понимают снижение физиологической реакции инсулинчувствительных тканей на действие инсулина при его достаточной концентрации.
Инсулинорезистентность не только выявляется у лиц, страдающих СД2, но и характерна для ряда других патологических состояний. Снижение функции щитовидной железы также сопровождается уменьшением чувствительности тканей к инсулину, что подтверждается полученными нами результатами обследования в группе пациенток с гипотиреозом и данными других авторов [9]. Сопутствующий гипотиреоз ухудшает компенсацию СД2, о чем свидетельствует достоверное увеличение гликемии натощак у пациенток с сочетанием заболеваний относительно группы женщин с СД2.
Как для СД2, так и для гипотиреоза характерно изменение показателей липидного спектра крови, что приводит к более быстрому развитию и прогрессированию атеросклероза. Патогенетические механизмы атерогенной дислипидемии при СД2 и при гипотиреозе имеют отличия. Так, при СД2 к дислипидемии приводит в первую очередь инсулинорезистентность, в условиях которой увеличивается поступление в печень свободных жирных кислот и глюкозы, что способствует усиленному образованию ЛПОНП [8]. Дефицит гормонов щитовидной железы вызывает снижение содержания рецепторов ЛПНП в гепатоцитах и приводит к накоплению холестерина в организме [10]. Кроме того, и при гипотиреозе, и при СД2 развивается дисфункция эндотелия сосудистой стенки, что также играет важную роль в атерогенезе. Отмеченные нами изменения показателей жирового обмена у всех обследованных свидетельствуют о наличии у них атерогенной дислипидемии, что согласуется с данными других авторов [9–13]. В то же время в работах Г.Г. Петрик, а также И.В. Терещенко и соавт. отмечено, что сочетание гипотиреоза и СД2 приводит к более выраженным атерогенным изменениям [13, 14]. Нами не было выявлено ухудшения показателей липидного обмена в группе пациентов с сочетанием заболеваний по сравнению с обследованными только с гипотиреозом или только с СД2.
Одним из ведущих симптомов, сопровождающих как гипотиреоз, так и СД2, является увеличение массы тела и ожирение. Жировая ткань биологически активна: она секретирует фактор некроза опухолей-α, ангиотензин I, ангиотензин II, интерлейкин-6, ингибитор активатора плазминогена-1, лептин, адипонектин, резистин и другие адипокины [15].
Наиболее изученным адипокином является адипонектин – полипептид с молекулярной массой 30 кDa. Адипонектин обладает противовоспалительными и антиатерогенными эффектами. Он также уменьшает инсулинорезистентность, стимулируя секрецию инсулина, подавляет глюконеогенез в печени, способствует окислению жирных кислот и усвоению глюкозы в скелетных мышцах [16]. Поэтому снижение секреции адипонектина может рассматриваться как фактор риска развития СД2.
В нашем исследовании установлено снижение адипонектина у обследованных с гипотиреозом, СД2 и их сочетанием. Минимальный его уровень выявлен в группе пациенток с сочетанием гипотиреоза и СД2. Эти результаты согласуются с данными ряда других авторов [9, 17, 18]. В то же время в работе А.А. Суслиной показано, что при сочетании СД2, ожирения и гипотиреоза уровень адипонектина повышается относительно этого показателя у больных СД2 без гипотиреоза [19]. Н.Э. Альтшулер и соавт. выявили гиперадипонектинемию у пациентов с субклиническим гипотиреозом, которая сохранялась и после достижения эутиреоза в результате заместительной терапии левотироксином [20]. Данные противоречия свидетельствуют о необходимости дальнейшего изучения эффектов адипокинов как в норме, так при различных заболеваниях.
Выводы
У пациенток с СД2 и его сочетанием с гипотиреозом на фоне ожирения I степени выявлены инсулинорезистентность и компенсаторная гиперинсулинемия. У больных гипотиреозом на фоне избыточной массы тела отмечено снижение чувствительности к инсулину. Максимальная выраженность инсулинорезистентности отмечена при сочетании СД2 и гипотиреоза.
В группах женщин с гипотиреозом, СД2 и их сочетанием установлено повышение уровня ОХС, ТГ, КА, что свидетельствует о развитии у данных больных атерогенной дислипидемии.
У женщин с СД2, гипотиреозом и при их сочетании выявлена гипоадипонектинемия. Минимальное значение уровня адипонектина установлено при сочетании СД2 и гипотиреоза.


