Введение
Герминогенные опухоли (ГО) представляют собой доброкачественные или злокачественные образования, субстратом которых является зародышевая клетка. Традиционно выделяют гонадные и экстрагонадные локализации ГО, частота которых составляет 41 и 59% соответственно [1]. Существует два пика заболеваемости: первый – у детей до 2 лет (как правило, преобладает крестцово-копчиковая локализация), второй – у подростков (у девочек 8–12 и у мальчиков 11–14 лет) [1, 8]. У подростков 15–19 лет превалируют гонадные локализации (тестикулярные и яичниковые) [1].
Плюрипотентные зародышевые клетки мигрируют из желточного мешка к урогенитальному гребню к 4-й неделе беременности [7]. В силу каких-либо причин не все клетки имеют возможность завершить миграцию, оседая по ходу миграции ближе к срединной линии тела и давая начало эмбриональным опухолям экстрагонадной локализации (головной мозг, шейная, медиастинальная, забрюшинная, крестцово-копчиковая локализации) [3].
К основным опухолевым маркерам герминогенных новообразований относятся α-фетопротеин (АФП) и β-субъединица хорионического гонадотропина человека (ХГЧ). Кроме того, немаловажное значение имеет и лактатдегидрогеназа (ЛДГ) [2, 9]. Опухоли желточного мешка, как правило, в избытке продуцируют АФП, хориокарциномы – ХГЧ. Зрелые тератомы и герминомы отличаются от вышеупомянутых опухолей отсутствием гиперсекреции маркерных линий [3]. Несеминомы же в 70–80% случаев продуцируют маркеры, что позволяет проводить мониторирование активности опухоли во время лечения [1].
Цель исследования: оценить показатели выживаемости пациентов до 18 лет с ГО.
Методы
С 1996 по 2017 г. в отделении химиотерапии и комбинированного лечения злокачественных опухолей у детей НМИЦ онкологии им. Н.Н. Петрова (Санкт-Петербург) лечились 72 пациента в возрасте до 18 лет с экстракраниальными ГО различной локализации. Морфологический вариант образования был представлен дисгерминомой/семиномой, опухолью эндодермального синуса, эмбриональной карциномой и смешанной ГО.
В диагностический алгоритм обследования обязательно входило определение опухолевых маркеров АФП, ХГЧ. Уровень этих маркеров исследовали до начала лечения и перед каждым курсом полихимиотерапии (ПХТ). Диагноз ГО подтвержден морфологической верификацией после биопсии (инцизионной или эксцизионной) опухолевой ткани. Инструментальные методы исследования включали ультразвуковое исследование (УЗИ), компьютерную томографию с или без магнитно-резонансной томографии органов грудной клетки, брюшной полости, а также остеосцинтиграфию.
Более половины больных (n=47, 65,3%) получили терапию согласно принципам протокола TGM, основанным французской группой по детской онкологии (SFOP/SFCE – Société Française d’Oncologie Pédiatrique/Société Française de lute contre les Cancers et leucémies de l’Enfant et de l’adolescent) [2]. Объем лечебной программы зависел от изначального распространения опухолевого процесса, рестадирования после оперативного вмешательства (согласно TNM-классификации), уровня опухолевого маркера АФП и гистологического заключения.
Пациенты были стратифицированы на 3 группы: группу низкого риска (АФП<15 тыс. нг/мл, локализованной и радикально удаленной опухоли), стандартную группу (АФП<15 тыс. нг/мл, отсутствие метастазов) и группу высокого риска (АФП≥15 тыс. нг/мл, с/без метастазов). В 1-й группе ПХТ в неоадъювантном режиме не проводилась, во 2-й группе дети получали цитостатическое лечение по схеме VBP (Vinblastine, Bleomycin, Platinum – винбластин, блеомицин, цисплатин), в 3-й – по схеме VIP (Vepeside, Ifosphamide, P]latinum – вепезид, ифосфамид, цисплатин). Сами схемы лечения представлены в табл. 1. Число циклов ПХТ зависело от скорости снижения уровня АФП: пациенты получали 2 дополнительных курса после нормализации АФП. Таким образом, число циклов варьировалось от 3 до 6.
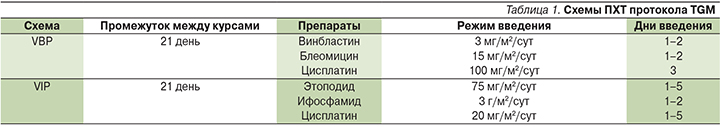
Лечебную программу по протоколу MAKEI-96 получили 8 (11,1%) пациентов. В данной программе учитывались локализация первичной опухоли, стадия патологического процесса и полнота резекции [3, 4]. Число циклов варьировалось от 2 до 4. В протоколе предложены схемы PE (Platinum, Etoposide – цисплатин, этопозид) и РЕI (Platinum, Etoposide, Ifosphamide – цисплатин, этопозид, ифосфамид) (табл. 2).
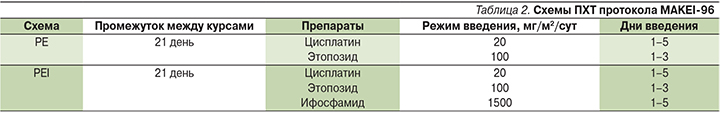
Остальным больным лечение проведено по следующим платиносодержащим схемам: BEP (Bleomycin, Еtoposide, Platinum – блеомицин, этопозид, цисплатин) (n=8; 11,1%), IGR (n=4; 5,6%) и JEB (JM8a – Carboplatin, Еtoposide; Bleomycin – карбоплатин, этопозид, блеомицин) (n=1; 1,4%). Четыре (5,6%) ребенка лечились без использования препаратов платины – схемы CADO (Cyclophosphamide, Doxorubicin, Oncovin – циклофосфамид, доксорубицин, онковин) и VAC (Vincristine, A]ctinomycin D, Cyclophosphamide – винкристин, актиномицин-Д, циклофосфамид).
В статье использовали вычисление показателей выживаемости по методу Каплана–Мейера [5], при этом рассчитаны показатели общей (ОВ), безрецидивной (БРВ), бессобытийной (БСВ) выживаемости и выживаемости без прогрессирования (ВБП). С помощью log-rank-теста проведена оценка значимости различий частот изучаемого признака в нескольких независимых группах за весь период наблюдения.
Результаты исследования
Основные сведения о пациентах представлены в табл. 3.
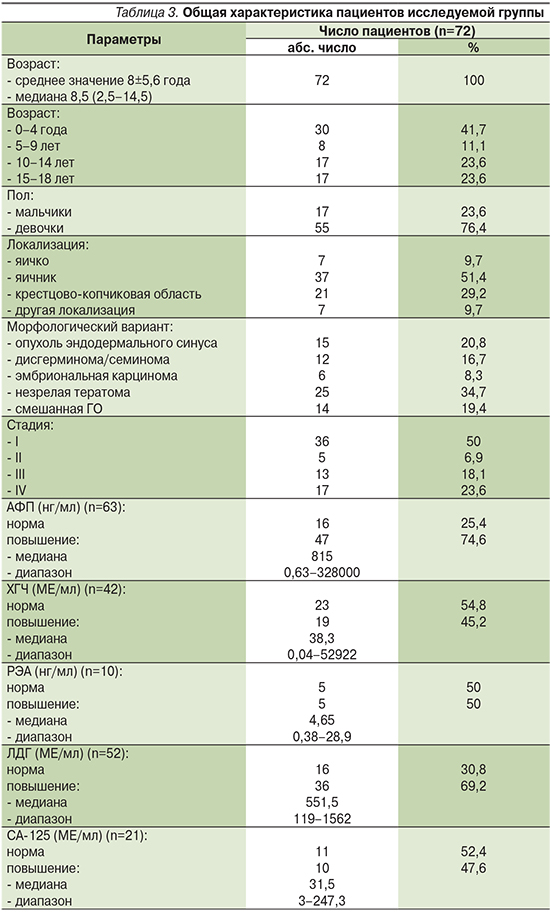
Средний возраст больных составил 8±5,6 года, медиана – 8,5 (2,5–14,5). Женский пол преобладал: девочек было 55 (73,4%), мальчиков – 17 (23,6%). Соотношение по полу 3:1. В возрасте до 4 лет были 30 (41,7%) детей, от 5 до 9 – 8 (11,1%), от 10 до 14 – 17 (23,6%) и от 15 до 18 – 17 (23,6%) больных. Превалировали яичниковая (n=37, 51,4%) и крестцово-копчиковая (n=21, 29,2%) локализации. Тестикулярное поражение выявлено в 7 (9,7%) случаях. Приблизительно у 1/3 (n=25; 34,7%) пациентов морфологически диагностирована незрелая тератома, у 15 (20,8%) детей – опухоль эндодермального синуса, у 12 (16,7%) – дисгерминома/семинома, у 6 (8,3%) – эмбриональная карцинома; в 14 (19,4%) случаях встретилась смешанная форма ГО. Локализованное заболевание (I–II стадий) выявлено у 41 (56,9%) ребенка, распространенное (III–IV стадий) – у 31 (43,1%) больного. Повышение уровней АФП, ХГЧ и ЛДГ отмечено в 47 (74,6%), 19 (45,2%) и 36 (69,2%) наблюдениях соответственно.
Полная ремиссия была достигнута у 59 (81,9%) пациентов. Умерли 14 (19,4%) больных. Средний срок наблюдения за больными составил 8 лет (медиана – 5 лет, диапазон от 1 месяца до 21 года). Пятилетняя ОВ составила 78,8±5% (рис. 1).
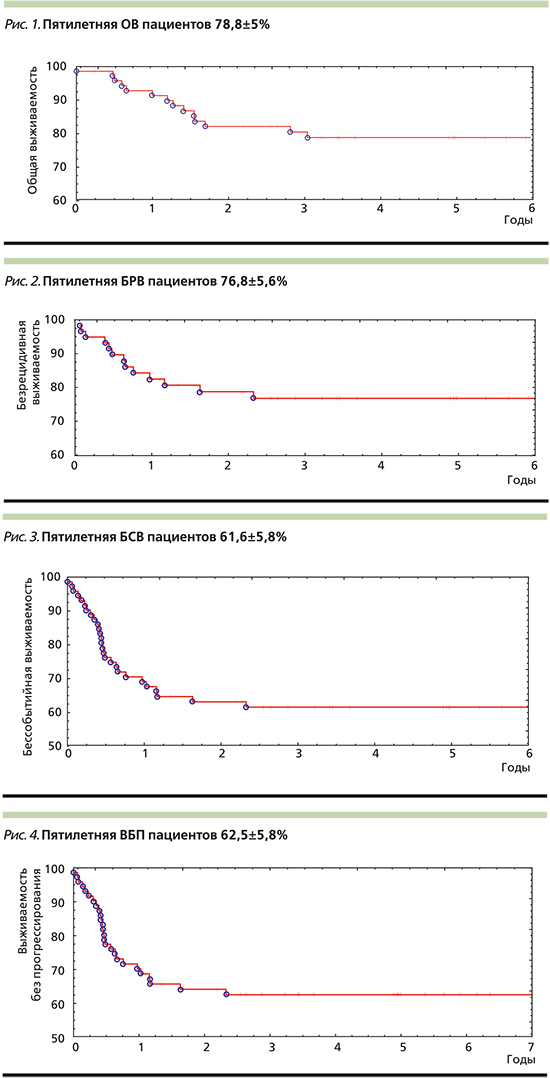
У 13 больных в среднем через 6 месяцев (диапазон от 2 месяцев до 2 лет) возникли рецидивы. При расчете показатели БРВ 13 больных не учтены, т.к. у них на фоне лечения зарегистрировано прогрессирование заболевания. БРВ составила 76,8±5,6% (рис. 2). БСВ (с учетом 13 пациентов с прогрессированием и 13 – с рецидивами) составила 61,6±5,8% (рис. 3), ВБП – 62,5±5,8% (рис. 4).
В группу низкого риска включены 8 (11,1%), в стандартную группу риска – 36 (50%) больных, в группу высокого риска – 28 (38,9%) детей. ОВ в первой группе составила 100%, во второй – 92,8±3,7%, в третьей – 55,1±10,1% (р=0,00097). Значимая разница была и в показателях БРВ и БСВ в группах стандартного и высокого рисков: БРВ в p=0,0097), БСВ – 83,4±5,7 и 27,8±8,6% соответственно (р=0,0000)(табл. 4).

Обсуждение
ГО относятся к наиболее химиочувствительным заболеваниям и представляют собой модель курабельного злокачественного процесса [9]. Около 80% пациентов с диссеминированными формами могут быть излечены с применением платиносодержащих схем ПХТ [1, 7]. Терапия «спасения» с комбинацией стандартных доз цисплатина и препаратов, не использованных в индукционном лечении, дает возможность выйти в ремиссию еще 15–20% больных [6–9].
В связи с редкостью патологии большинство исследований, посвященных ГО у детей, проведено разрозненно, использовались собственные системы стратификации [1, 3, 10–13]. Между национальными группами, изучавшими ГО у детей, длительное время не было консенсуса по поводу факторов риска и стратификации пациентов. В конце 1990-х гг. выяснилось, что сотрудничество различных исследовательских групп более перспективно в плане набора пациентов (увеличение когорты исследуемых) и финансовых затрат [14]. После слияний четырех групп в COG (Children’s Oncology Group – детская онкологическая группа) повторно были подняты вопросы о пересмотре групп риска и развития следующей версии протокольной программы по лечению ГО. В табл. 5 представлены сведения об исследованиях в этом направлении французской, немецкой и бразильской групп. Основными аспектами этих изучений была попытка модификации программ лечения на основе эффективности первичной терапии, т.н. response-adapted-модификация.
В немецкой программе использовалась неоадъювантная ПХТ [4, 15]. В этом исследовании также в схему лечения был добавлен ифосфамид и исключен блеомицин. Выводом использования этой программы стала необходимость обязательного оперативного вмешательства и для повышения резектабельности опухоли – неоадъювантной ПХТ.
Во французской программе также были получены удовлетворительные результаты (5-летняя ОВ составила 85%, БСВ – 74%), но недостатком этой работы стала небольшая выборка пациентов и отсутствие группы сравнения [2].
Бразильская группа исследователей предложила использовать схемы без блеомицина, но с высокими дозами платины и ифосфамида – HPE (High doses Platinum, Еtoposide – высокие дозы цисплатина и этопозида): цисплатин 30 мг/м2 1–5-й день, этопозид 120 мг/м2). Пятилетняя ОВ при этом варьировалась от 58,8 до 73,5% в зависимости от достижения ремиссии после 2 циклов (см. табл. 5) [16].
В нашем исследовании 5-летняя ОВ пациентов с ГО в возрасте до 18 лет составила 78,8±5%, БРВ ‒ 76,8±5,6%, БСВ ‒ 61,6±5,8% и ВБП ‒ 62,5±5,8%. Данные цифры сопоставимы с общемировыми.
Заключение
С использованием современных программ терапии ГО более половины больных имеют шанс на излечение даже с диссеминированными формами злокачественного процесса. Благодаря комбинации различных химиопрепаратов с включением стандартных доз цисплатина 70–80% пациентов могут достичь полной ремиссии. Полученные в данном исследовании результаты сопоставимы с таковыми мировой литературы.



