Введение
Саркома Капоши (СК) – самое частое злокачественное новообразование у гомо- и бисексуальных мужчин с синдромом приобретенного иммунодефицита человека (СПИД) [1], поражавшим до применения высокоактивной антиретровирусной терапии (ВААРТ) около 35% больных СПИДом [2]. В эру ВААРТ частота СПИД-ассоциированной СК резко снизилась, например, в Италии с 30 случаев на 1000 больных СПИДом в 1995 г. до 0,03 – на 1000 больных в 2001 г. [3].
Этиологическим агентом CПИД-ассоциированной СК, как и других типов этого заболевания, служит вирус герпеса человека 8-го типа (HHV-8). Исследования in vitro показали, что этот вирус может инфицировать различные типы клеток, в т.ч. эндотелиальные и В-лимфоциты [2]. Доказано, что он передается через слюну, а также аногенитальным путем, чему не противоречит совпадение среднего возраста появления СК у больных СПИДом (20–40 лет) с возрастом наивысшей гомосексуальной активности [4]. При СПИД-ассоциированной СК могут поражаться любые внутренние органы, в т.ч. лимфатические узлы, органы пищеварительного тракта, дыхательная система, сердце, перикард, костный мозг и др. Однако проявления на коже считаются наиболее частыми и распространенными. Широкое применение в последние годы ВААРТ, приводящее к существенному снижению вирусной нагрузки и повышению концентрации CD4+клеток у большинства пациентов, способствовало существенному уменьшению частоты не только СПИД-ассоциированной СК, но и других злокачественных новообразований, а также цитомегаловирусных ретинитов, пневмоцистной пневмонии, микобактериальной инфекции. Отмечено также, что ВААРТ способствует регрессу кожных проявлений СК и предотвращению развития СК [4]. Таким образом, ВААРТ следует считать 1-й линией при СПИД-ассоциированной СК, даже несмотря на то что в некоторых случаях для ее лечения могут потребоваться и другие методы. Таким образом, основанная на ВААРТ терапевтическая стратегия весьма эффективна, способствует снижению вирусной нагрузки вируса иммунодефицита человека (ВИЧ), увеличению уровня CD4+Т-лимфоцитов и снижению частоты возникновения ВИЧ-ассоциированных опухолей, включая СК. Об этом, в частности, свидетельствуют данные А. Kompletre et al., которые в ретроспективном исследовании, основанном на изучении историй болезни 470 получавших ВААРТ ВИЧ-инфицированных пациентов, показали снижение вероятности развития рака с 3 до 0% [5].
В своей практике впервые с успехом применили в лечении получавшего ВААРТ больного СПИД-ассоциированной СК метод лазероиндуцированной термотерапии (ЛИТТ).
 Клинический случай
Клинический случай
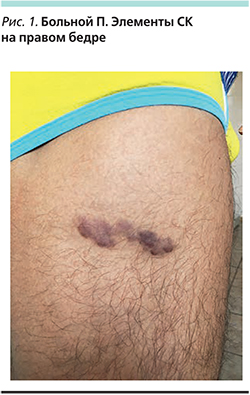
Больной П. 28 лет обратился в клинику дерматовенерологии и дерматоонкологии МОНИКИ с жалобами на высыпания на коже туловища и конечностей. Болен около 1,5 лет, когда на коже верхней трети правого бедра заметил появление 3 узелков темно-вишневого цвета, которые быстро слились; одновременно с этим стали появляться темно-коричневые пятна на плечах, груди, спине. Через 6 месяцев после появления высыпаний пациент обратился к дерматологу по месту жительства, которым была выявлена ВИЧ-инфекция и начато лечение в МОНИКИ.
При осмотре на коже верхней трети туловища и плеч визуализировались пятна, папулы и бляшки вишнево-красного цвета размером от 1,4×1,2 до 2,9×2,1 см, на коже верхних конечностей пятна от светло-коричневого до вишневого цвета с гладкой поверхностью и четкими границами размером от 1,0×0,8 до 3,4×2,7 см, на коже нижних конечностей в области правого бедра бляшки с четкими границами темно-вишневого цвета размером от 2,1×1,7 до 3,5×1,8 см с гладкой поверхностью, в области голеней, коленного сустава единичные пятна диаметром от 0,5 до 2 см. При гистологическом исследовании биоптата очага поражения установлен диагноз СК. В ткани очага поражения методом полимеразной цепной реакции выявлен HHV-8.
Пациенту была назначена ВААРТ (индинавир+зидовудин+ламивудин). Через 3 месяца от ее начала прекратилось появление новых элементов, начался регресс папулезных и пятнистых высыпаний и больному была проведена ЛИТТ на 5 папулезных элементов диаметром от 0,3 до 1,5 см.
 В качестве источника лазерного излучения применен полупроводниковый лазерный аппарат ЛАМИ с длиной волны 1064 нм, мощностью излучения на конце световода – 2,5 Вт; регистрационный номер – 29/10020203/5212-03 (20.05.2003), код ОКП 944420, класс IIA. Для подведения света использовались гибкие кварцевые моноволоконные световоды диаметром 0,6 мм; при необходимости использовался линзовый рассеиватель. Для измерения мощности лазерного излучения на выходе световода применялся дозировщик мощности ДИ-6А. Оценка температурного поля и достигаемой при воздействии лазерного излучения температуры проводилась до начала исследования с помощью ИК-камеры CEDIP. Для моделирования теплофизических свойств кожных покровов использован фантом-полиакриламидный гель. Перед процедурой ЛИТТ предварительно производилась внутрикожная инфильтративная анестезия области новообразования 0,3–0,5 мл 2%-ного р-ра лидокаина. Спустя 5 минут торцевой конец световода подводился к поверхности опухоли на 0,2–0,5 см без непосредственного соприкосновения с поверхностью кожи. Воздействие осуществлялось длительно (от 10 до 30 минут в зависимости от размера очага). Процедура ЛИТТ проводилась однократно. По окончании ее в течение 10–14 дней на очаг 3–4 раза в сутки наносился гель Эгаллохит.
В качестве источника лазерного излучения применен полупроводниковый лазерный аппарат ЛАМИ с длиной волны 1064 нм, мощностью излучения на конце световода – 2,5 Вт; регистрационный номер – 29/10020203/5212-03 (20.05.2003), код ОКП 944420, класс IIA. Для подведения света использовались гибкие кварцевые моноволоконные световоды диаметром 0,6 мм; при необходимости использовался линзовый рассеиватель. Для измерения мощности лазерного излучения на выходе световода применялся дозировщик мощности ДИ-6А. Оценка температурного поля и достигаемой при воздействии лазерного излучения температуры проводилась до начала исследования с помощью ИК-камеры CEDIP. Для моделирования теплофизических свойств кожных покровов использован фантом-полиакриламидный гель. Перед процедурой ЛИТТ предварительно производилась внутрикожная инфильтративная анестезия области новообразования 0,3–0,5 мл 2%-ного р-ра лидокаина. Спустя 5 минут торцевой конец световода подводился к поверхности опухоли на 0,2–0,5 см без непосредственного соприкосновения с поверхностью кожи. Воздействие осуществлялось длительно (от 10 до 30 минут в зависимости от размера очага). Процедура ЛИТТ проводилась однократно. По окончании ее в течение 10–14 дней на очаг 3–4 раза в сутки наносился гель Эгаллохит.
Оценка результатов ЛИТТ производилась во время сеанса, по окончании лазерного воздействия, через 2–3 часа и затем ежедневно в течение 1–2 недель после процедуры, в последующем на 30-е сутки, а также через 2–3 месяца. Сразу после проведения ЛИТТ отмечено побледнение пятен, а также уплощение и сглаживание рельефа бляшек и узлов СК. Что касается субъективных признаков фототермической реакции, то они характеризовались ощущением умеренного покалывания и не требовали дополнительного обезболивания. Лечение переносилось удовлетворительно, без изменения общего состояния, гемодинамических сдвигов (контроль артериального давления, электрокардиография).
Боль и экссудация серозной жидкости с поверхности очагов поражения после ЛИТТ продолжались 2, отек и гиперемия – 3 дня. Корки на поверхности очагов поражения на фоне применения геля Эгаллохит сформировались в течение 1–3 дней и отторглись на 7–30-й день после ЛИТТ. Полная эпителизация эрозий после отпадения корок завершилась на 7–15-й день и на месте бывших очагов поражения оставались участки рубцовой атрофии и гиперпигментации, которая в сроки от 2 до 3 месяцев исчезала. Следует отметить, что другие (не леченные методом ЛИТТ) папулезные и бляшечные элементы на тот момент еще полностью не регрессировали. При проведении ультразвукового исследования 75 мгц после лечения: дерма имеет однородную структуру, четко отграничена от подкожной клетчатки, акустическая плотность дермы несколько снижена; эпидермис одинаковый на всем протяжении сканограммы.
При ограниченных формах различных типов СК, включая узлы и бляшки как наиболее иммуносупрессирующие организм элементы, применяют деструктивные методы: хирургическое иссечение [6], криодеструкцию [7], фотодинамическую терапию [8]. Метод ЛИТТ в последние годы используется при базалиомах труднодоступной для лучевой терапии и криодеструкции локализациях (ушная раковина, угол глаза и др.) [9], а также при идиопатическом и иммуносупрессивном типах СК. Причем при изучении отдаленных результатов ЛИТТ у больных СК обращало на себя внимание закономерное отсутствие возникновения новых элементов на местах, в которых она ранее была излечена этим методом. Даже в случае обострения СК эти места оставались интактными и были представлены участками рубцовой атрофии с вполне приемлемым косметическим результатом в связи с применением геля Эгаллохит [10]. Метод ЛИТТ основан на избирательном перегреве опухолевых тканей по сравнению со здоровыми. Повышение температуры способствует увеличению скорости кровотока и теплоотдачи в здоровой ткани, тогда как в опухоли из-за несовершенного строения сосудистого русла снижается перфузия, наблюдаются сосудистый отек и формирование многочисленных микротромбов. Нарушение кровотока в опухоли приводит к хронической гипоксии, истощению запасов аденозинтрифосфорной кислоты, замедлению или нарушению репликации дезоксирибонуклеиновой кислоты в клетках. Этими механизмами, в частности, объясняются повышение термочувствительности клеток солидных опухолей и развитие в них уже при 42,5°С необратимых повреждений за счет некроза и апоптоза [11, 12]. Следует также отметить способность стимуляции ЛИТТ специфического иммунного ответа на опухолевые антигены за счет температурно-индуцированной продукции белков теплового шока (heat shock proteins, HSP) [13].
Воздействие лазерным лучом осуществляется локально в пределах видимой границы опухоли до наступления спазма ее сосудов и выражается в побледнении облучаемого участка по сравнению с окружающими гиперемированными здоровыми тканями. Избирательность термоповреждения злокачественных клеток при сохранности здоровых тканей достигается не только за счет локального воздействия лазерного луча, но и в результате повышенной термочувствительности опухоли. В здоровой же ткани скорость кровотока и теплоотдача линейно возрастают с увеличением температуры. Доказано, что именно этот феномен определяет селективность перегрева опухолевых тканей по сравнению со здоровыми. По данным A. Szasz et al., нарушение кровотока в солидных опухолях и хроническая гипоксия значительно повышают термочувствительность опухолевых клеток и уже при температуре 42,5°С происходит необратимое повреждение клеток опухоли, вследствие чего запускаются прямой (некроз) и непрямой (апоптоз) пути опухолевой деструкции [12].
Заключение
Данный пример, дополненный полученными нами ранее данными об эффективности и вполне удовлетворительной переносимости ЛИТТ при идиопатическом и иммуносупрессивном типах СК, позволяет с оптимизмом смотреть на возможность использования метода и при СПИД-ассоциированном типе этой болезни.
Следует также отметить, что применение геля Эгаллохит после проведения ЛИТТ этой категории больных позволяет приостановить рост соединительной ткани в патологических очагах, способствует рассасыванию рубцовой ткани, особенно на стадии формирования рубца, выравниванию его поверхности по отношению к окружающей ткани, уменьшению гиперемии, пигментации, увеличению подвижности и податливости окружающих тканей. В результате после эпителизации на месте бывших узелковых и бляшечных элементов этой опухоли формируются бледно-розовые округлые участки рубцовой атрофии, которые в сроки от 3 (в т.ч. при СПИД-ассоциированной СК) до 6 месяцев утрачивают розоватую окраску, приобретая цвет окружающей кожи.


