Обоснование
До конца 1970-х гг. в медицинской науке существовали абсолютно полярные мнения о роли соматотропного гормона (СТГ) в патогенезе сердечно-сосудистой патологии по сравнению с теми, которыми апеллируют современные исследователи. R. Hall в 1972 г. не заметил снижения продолжительности жизни таких пациентов по сравнению с общей популяцией [1], а J.L. De-Gennes et al. в 1979 г. вообще отмечали протективный эффект дефицита СТГ в отношении сердечно-сосудистых заболеваний [2]. Начиная с 1990-х гг. представления кардинально поменялись. Благодаря данным международного регистра KIMS (Pfizer International Metabolic Database), ведение которого началось с 1994 г., в отношении пациентов с дефицитом СТГ стало известно, что сердечно-сосудистый риск у них значительно выше, чем у пациентов без такого дефицита [3].
Гиперлипидемия, повышение индекса массы тела, неблагоприятное соотношение окружности талии и бедер, компонентного состава тела, высокая частота встречаемости сопутствующей артериальной гипертензии – все это основные факторы риска развития и прогрессирования сердечно-сосудистой патологии у пациентов с гипопитуитаризмом – ГП [4–7].
Однако в мировой литературе содержится информация исключительно о поражении сердечно-сосудистой системы пациентов с ГП, обусловленном прогрессированием атеросклеротических процессов [8–11]. Данные о сочетании ГП и некоронарогенных заболеваний миокарда отсутствуют, в связи с чем считаем собственный клинический опыт ведения пациента Д. 49 лет с ГП и вероятным некоронарогенным поражением миокарда (миокардит) интересным для практикующих специалистов.
Клинический случай
С 1984 г. пациент (на тот момент его возраст составлял 16 лет) страдал приступами сильнейшей головной боли длительностью до недели, которая не купировалась анальгетиками, стал отмечать снижение зрения, появление косоглазия. При обследовании в Городской клинической больнице № 1 им. Ю.Я. Гор-деева Саратова была выявлена краниофарингиома с эндо- и супраселлярным ростом. В 1986 г. в Центре нейрохирургии им. акад. Н.Н. Бурденко проведено удаление краниофарингиомы с опорожнением ликворных кист турецкого седла. В первые месяцы после операции ощущал сильную слабость, появилась сильная жажда и полиурия. При обследовании выявлено снижение уровня Т3 и Т4 гормонов щитовидной железы, тестостерона, кортизола, антидиуретического гормона, снижение удельного веса мочи. Был установлен диагноз «гипопитуитаризм. Несахарный диабет». Однако в 1987 г. в ходе планового обследования был обнаружен продольный рост опухоли и проведена повторная операция. С того же времени находился на гормональной заместительной терапии (тиреоидин, трийодтиронин, гонадотропин, минирин, метилпреднизолон). На фоне приема гормональных препаратов отметил положительный эффект в виде восстановления зрения, исчезновения косоглазия. При этом увеличилась масса тела с 80 кг до 200 кг. С 1992 г. самостоятельно отменил прием тироксина. Уровень тиреоидных гормонов не исследовал. С 1993 г. прекратил прием метилпреднизолона. Вес уменьшился на 50 кг.
С того же года отменил прием миринина. Жалоб на полиурию не предъявлял. Артериальное давление сос-тавляло 90 и 60 мм рт.ст. В 2004 г. был госпитализирован в сосудистое отделение Областной клинической больницы (ОКБ) Саратова по поводу трофической язвы правой голени.
С 2006 г. ежегодно в плановом порядке госпитализировался в эндокринологическое отделение ОКБ для коррекции уровня гормонов, однако после 2012 г. от госпитализаций стал отказываться. В 2015 г. находился на лечении в отделении гнойной хирургии ОКБ по поводу микробной экземы левой голени. В январе 2017 г. перенес тяжелую острую респираторную вирусную инфекцию. Со слов больного, имели место высокая лихорадка, слабость, насморк с обильными выделениями, боль в горле, впоследствии кашель. Однако за медицинской помощью не обращался. После перенесенной инфекции долго беспокоила слабость. В марте 2017 г. появились жалобы на перебои в работе сердца. С июня 2017 г. отметил увеличение объема живота, нарастание одышки при физической нагрузке. С сентября 2017 г. одышка усилилась, появились постоянные боли в области сердца ноющего характера. По ночам беспокоили сухой кашель, сердцебиение. Нарастала слабость, утомляемость. Отметил увеличение отеков на конечностях. Прием диуретиков (фуросемид) существенным эффектом не сопровождался. В декабре 2017 г. обратился в приемное отделение ОКБ и был госпитализирован в отделение реанимации и интенсивной терапии № 2, через 2 дня после стабилизации состояния был переведен для дальнейшего лечения в эндокринологическое отделение.
Из anamnesis vitae: наследственность по эндокринной патологии не отягощена. Аллергическая реакция на пентоксифиллин. Курит с 16 лет по 5 сигарет в сутки. Злоупотребление алкоголем отрицает. С 1998 г. зафиксирован синдром Жильбера.
Жалобы на момент госпитализации в отделение эндокринологии: общая слабость, тяжесть за грудиной, перебои в работе сердца, одышка при незначительной нагрузке, увеличение объема живота, отеки нижних конечностей.
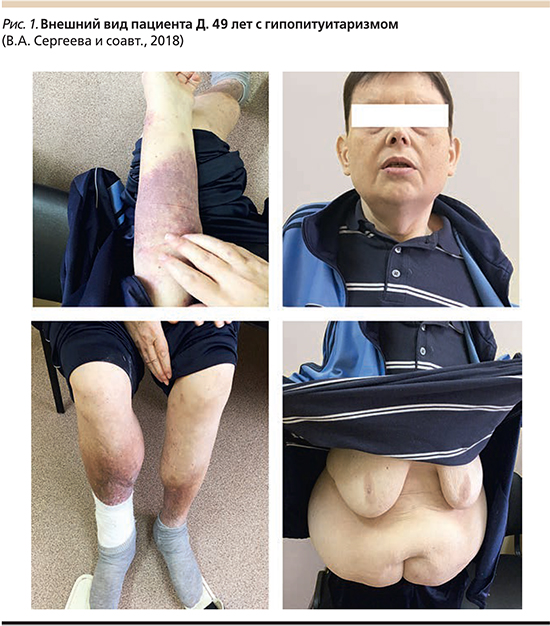
Данные объективного осмотра (рис. 1): состояние средней тяжести, избыточное развитие подкожно-жировой клетчатки (ПЖК) (преимущественно на животе и бедрах), кожные покровы сухие, бледные. Тургор кожи снижен. Экхимозы на местах инъекций. Увеличение грудных желез за счет ПЖК. Гиперпигментация голеней, снижение роста волос, гиперкератоз. На латеральной лодыжке правой голени глубокая трофическая язва 10×8 см, дно – мышечная ткань, покрыто грануляциями. Пульсация на а. dorsalis pedis, tibialis posterior снижена. Варикозное расширение вен нижних конечностей. Увеличение живота в объеме за счет ПЖК и асцита. Отеки нижних конечностей до уровня колен. Верхушечный толчок не определяется. Аускультативно: тоны сердца приглушены, аритмичные. Частота сердечных сокращений (ЧСС) – 124, пульс – 118 уд/мин. Артериальное давление – 100 и 70 мм рт.ст. Дыхание жесткое, хрипы не выслушиваются. Частота дыхтельных движений – 19 в минуту. Щитовидная железа пальпаторно не увеличена, мягко-эластической консистенции. Оволосение на лице, в подмышечных впадинах, на лобке отсутствует. Половые органы: пигментация мошонки – нет, складчатость есть. Яички по уровню развития соответствуют 15 годам эластической консистенции. Результаты лабораторно-инструментального обследования и консультации специалистов приведены в табл. 1.
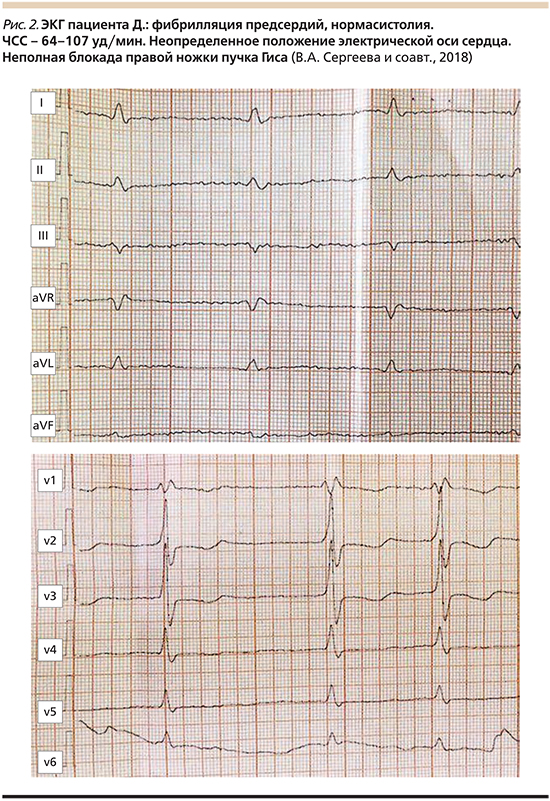
Данные электро- (ЭКГ) и эхокардиографии (ЭхоКГ) представлены на рис. 2 и в табл. 2 соответственно.
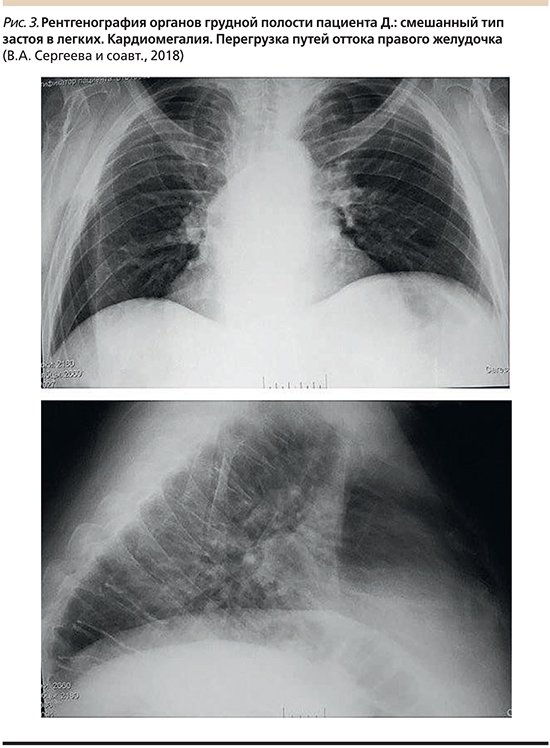
Рентгенография органов грудной клетки на рис. 3.
В стационаре пациенту была возобновлена заместительная гормональная терапия: эутирокс 100 мкг/сут, преднизолон 5 мг/сут; назначена антиаритмическая терапия согласно стратегии контроля ЧСС: метопролол 12,5 мг 2 раза в сутки, дигоксин 0,125 мг/сут; симптоматическая терапия хронической сердечной недостаточности: диротон 2,5 мг/сут, верошпирон 100 мг/сут, фуросемид в/в 40 мг/сут, далее торасемид 10 мг/сут постоянно; коррекция анемии: железа (III) гидроксида полимальтозат 2,0 внутримышечно. На фоне проводимого лечения отмечена положительная динамика в виде уменьшения одышки, отечного синдрома (пациент потерял около 15 кг на фоне диуретической терапии), стабилизации артериального давления и урежения ЧСС до 90 ударов в покое. Выписан на амбулаторный этап для продолжения медикаментозной терапии.
Обсуждение
Согласно данным осмотра и результатам инструментальных методов обследования, у пациента выявлены проявления декомпенсации кровообращения по обоим кругам, соответствующие Н2Б-стадии по классификации Стражеско–Василенко и IV функциональному классу (ФК) по классификации Нью-Йоркской кардиологической ассоциации (NYHA, 1994). С учетом отсутствия данных за острый коронарный синдром, принимая к сведению информацию из анамнеза заболевания о связи прогрессирования недостаточности кровообращения с острой респираторной вирусной инфекцией, нельзя исключить перенесенный инфекционный миокардит. В отсутствие возможностей нашей клиники к проведению эндомиокардиальной биопсии – «золотого» стандарта диагностики для верификации данной патологии, и магнитно-резонансной томографии сердца диагноз установлен ретроспективно на основании диагностических критериев неревматического миокардита (NYHA, 1973). В литературе отсутствуют сведения о взаимоотношении миокардитов и ГП, в связи с чем предсказать прогноз и сроки в отношении восстановления или определенного улучшения состояния миокарда трудно. Сложно говорить также об окончательном переходе миокардита в дилатационную кардиомиопатию. К настоящему времени с учетом позднего обращения у пациента выявлены нормальные значения маркеров повреждения миокарда и с учетом данных ЭхоКГ этот диагноз также нельзя исключить. Предполагая, что сроки восстановления сократительной способности миокарда после воспалительного поражения у пациентов с ГП могут быть увеличены и для оценки дальнейших изменений сердечной мышцы, необходимо выполнение ЭхоКГ в динамике с условием постоянной симптоматической терапии хронической сердечной недостаточности и соблюдения всех немедикаментозных рекомендаций. Тем не менее прогноз в отношении восстановления насосной функции миокарда представляется неблагоприятным, что обусловлено отсрочкой в терапии, присоединением фибрилляции предсердий, способствующей прогрессирующему аритмогенному ремоделированию, а также гипотонии, ограничивающей прием ряда кардиотропных препаратов в терапевтических дозах. Трудно оценить «вклад» самого ГП в развитие миокардиальной дисфункции. Данные ЭхоКГ подтверждают тяжелое атеросклеротическое поражение клапанного аппарата с выраженной регургитацией на атриовентрикулярных клапанах, что может быть следствием прогрессирующего атеросклероза в рамках ГП.

Заключение
Тяжелое поражение миокарда у пациента с ГП вызывает много вопросов. Связь перенесенной инфекции и прогрессирующей дисфункции миокарда позволила предположить диагноз «миокардит», срок давности которого неизвестен, т.к. обращение пациента в лечебное учреждение произошло более чем через 6 месяцев от первых симптомов. Трудно судить также и о сформировавшейся дилатационной кардиомиопатии как окончательном исходе воспалительного поражения миокарда. С прогностической точки зрения восстановление насосной функции и обратное ремоделирование сердечной мышцы маловероятны на фоне постоянной формы фибрилляции предсердий, выраженного атеросклеротического поражения клапанного аппарата сердца, отсрочки в кардиотропной терапии с учетом позднего обращения больного и персистирующей гипотонии. Приведенное наблюдение служит редким примером тяжелой кардиоэндокринной коморбидности. Накопление информации о подобных клинических ситуациях позволит специалистам в дальнейшем избегать ошибок в тактике ведения и грамотно подходить к выбору стратегии лечения таких пациентов.


