Введение
Лимфома Ходжкина (ЛХ) – одна из эффективно излечиваемых злокачественных опухолей у детей [1, 2]. По данным ACS (American Cancer Society – Американская ассоциация рака), 5-летняя общая выживаемость среди взрослых и детей, страдающих ЛХ, зависит от группы риска и в среднем составляет от 86 до 98%, при этом выживаемость пациентов благоприятного прогноза приближается к 100% [2, 3]. Основным подходом к лечению ЛХ служит комбинация полихимиотерапии (ПХТ) с консолидирующей лучевой терапией (ЛТ). Сочетание этих методов лечения не только улучшает противоопухолевый эффект, но и оказывает выраженное повреждающее действие на железы внутренней секреции, что может приводить к возникновению заболеваний щитовидной железы (гипотиреоз, гиперпаратиреоз, доброкачественные и злокачественные новообразования), нарушению функции гонад (бесплодие, азооспермия, различные нарушения менструального цикла) [4–7]. Несмотря на снижение токсичности современных режимов ПХТ, их комбинация с ЛТ на область малого таза все же приводит к развитию длительной азооспермии у 90–100% мужчин и преждевременной недостаточности яичников у 5–25% женщин в возрасте до 30 лет [5, 7].
Целью исследования была оценка гонадотоксичности современных программ терапии ЛХ у детей и подростков; выделение факторов лечения, связанных с повреждающим воздействием на половые железы.
Методы
Ко всем пациентам, принимавшим участие в исследовании, были применены риск-адаптированные программы терапии: DAL-HD (немецкая рабочая группа по изучению ЛХ у детей) и оригинальный протокол СПбЛХ, разработанный Санкт-Петербургской группой ученых (проф. Б.А. Колыгин, д.м.н. С.А. Кулева). В обеих программах применена стратификация пациентов на группы риска в зависимости от наличия прогностически неблагоприятных факторов. В программе DAL-HD выделено три терапевтические группы (ТГ) пациентов: 1-я включала пациентов с I–IIA-стадиями; 2-я – с IIAE-, IIB-, IIIA-; 3-я ТГ – с IIBE-, IIIEA/B-, IIIB-, IVA/B-стадиями. Число циклов ПХТ и режим ЛТ зависели от группы риска, в которую был включен ребенок: в 1-й ТГ проводили 2 цикла ПХТ по схеме ОРРA, во 2-й – 2ОРРА+2СОРР, в 3-й – 2OPPA+4СОРР (табл. 1).

В программе СПбЛХ объем лечения также зависел от стратификационной группы, к которой принадлежал больной, при этом был использован прогностический индекс (ПИ), являющийся арифметической суммой факторов, выделенных при статистико-математической обработке ретроспективного материала, неблагоприятно влияющих на прогноз заболевания. К такого рода факторам отнесены возраст больного (11 лет и старше), наличие общих симптомов, биологическая активность процесса, размеры наибольшего конгломерата лимфатических узлов 5 см и более и/или медиастинально-торакальный индекс более 0,33, стадия IVb или наличие любого экстранодального поражения. Больным 1-й группы риска с ПИ=0–2 проведено 2 цикла ПХТ по схеме VBVP, 2-й с ПИ=3–4 – 4 цикла ПХТ в альтернирующем режиме (VBVP/ABVD/VBVP/ABVD), пациенты 3-й группы риска с ПИ=5–6 получили 6 циклов ПХТ в том же альтернирующем режиме. С 2010 г. у детей, стратифицированных в группу неблагоприятного прогноза, программа терапии состояла из 6 курсов BEACOPP-базовый (программа «ранней интенсификации») (табл. 2).
После завершения индукционной ПХТ с целью консолидации ремиссии всем больным проведена ЛТ. Согласно программе DAL-HD, облучению подверглись все первично пораженные зоны, а иногда и смежные, суммарная очаговая доза (СОД) при этом зависела от полноты ремиссии и колебалась от 30 до 45 Гр. В программе СПбЛХ проведено облучение только манифестировавших очагов поражения; при выборе СОД-облучения, полученной после лекарственной терапии, использован принцип response-adapted: при достижении полной ремиссии или при уменьшении размеров конгломератов в результате ПХТ на 75% и более СОД составляла 25 Гр; при регрессе опухолевых масс менее чем на 75% – 30–36 Гр.
Основное различие данных лечебных программ состояло в том, что в программе СПбЛХ благодаря стратификации всех пациентов на группы риска и использования схем ПХТ в альтернирующем режиме удалось максимально снизить кумулятивные дозы алкилирующих агентов и антрациклиновых антибиотиков – препаратов, обладающих высоким потенциалом гонадо- и кардиотоксичности (табл. 3).
Так, кумулятивная доза прокарбазина для пациентов 1–3-й групп риска программы DAL-HD составила 3000 мг/м2, 5800, 8700 мг/м2 соответственно. В лечении пациентов 1-й группы риска программы СПбЛХ алкилирующие агенты не были использованы, в лечении больных 2-й и 3-й групп применялся менее гонадотоксичный агент дакарбазин (1500 и 2250 мг/м2 соответственно).
Для оценки овариального резерва и тестикулярной функции у молодых мужчин и женщин (средний возраст – 24±0,9 года), получавших лечение по программам DAL-HD и СПбЛХ в детском и подростковом возрасте, собирали данные анамнеза, определяли концентрацию антимюллерового гормона и ингибина В (референсные значения АМГ – 4–6,8 нг/мл, ингибина В – 23–260 нг/мл). Женщины проходили обследование на 3–4-й день менструального цикла.
Результаты исследования
Обработке подверглись сведения о 52 пациентах с ЛХ, лечившихся в отделении химиотерапии и комбинированного лечения злокачественных опухолей у детей НИИ онкологии им. Н.Н. Петрова с 1993 по 2015 г. Мальчиков было 23 (44,2%), девочек ‒ 29 (55,8%), соотношение по полу 1:1. Средний возраст на момент лечения составил 13,1 года (3–17 лет).
Согласно программе DAL-HD, были пролечены 14 (26,9%) человек, согласно СПбЛХ – 38 (73,1%). Группы больных существенно не различались по полу, возрасту, стадии заболевания (табл. 4). В программе СПбЛХ отмечено преобладание пациентов 2-й группы риска – 23 (60,5%) человека, во 2-ю группу риска программы DAL-HD был включен только 1 (7,2%) пациент (р=0,0005; табл. 4).

Средний возраст пациентов, лечившихся по программе DAL-HD, составил 29 (24–35) лет, средний период наблюдения ‒ более 17 (11–22) лет. Угнетение фертильной функции отмечено у 6 (42,9%) обследованных, у 8 (57,1%) уровень половых гормонов был в пределах нормы. Гипофункция гонад была характерной больше для мужчин – 5 (35,7%) человек, снижение овариального резерва зарегистрировано у 1 (7,1%) пациентки. Большинство обследованных состояли в браке, в 6 семьях были дети, в 2 – по 2 ребенка.
 Средний возраст пациентов, пролеченных по программе СПбЛХ, на момент обследования составил 19 (от 7 до 30) лет, средний период наблюдения превысил 5 лет (от 6 месяцев до 13,5 года). Из 38 обследованных снижение фертильной функции было выявлено у 5 (13,2%) пациентов: у 3 (7,9%) молодых мужчин и 2 (5,3%) женщин (при нормальном менструальном цикле). Эти пациенты принадлежали к группе «ранней интенсификации» и получали терапию по схеме BEACOPP-базовый. У остальных 33 (86,8%) пациентов, пролеченных по программе СПбЛХ, нарушений фертильной функции выявлено не было. В 9 (23,7%) семьях были дети (табл. 4).
Средний возраст пациентов, пролеченных по программе СПбЛХ, на момент обследования составил 19 (от 7 до 30) лет, средний период наблюдения превысил 5 лет (от 6 месяцев до 13,5 года). Из 38 обследованных снижение фертильной функции было выявлено у 5 (13,2%) пациентов: у 3 (7,9%) молодых мужчин и 2 (5,3%) женщин (при нормальном менструальном цикле). Эти пациенты принадлежали к группе «ранней интенсификации» и получали терапию по схеме BEACOPP-базовый. У остальных 33 (86,8%) пациентов, пролеченных по программе СПбЛХ, нарушений фертильной функции выявлено не было. В 9 (23,7%) семьях были дети (табл. 4).
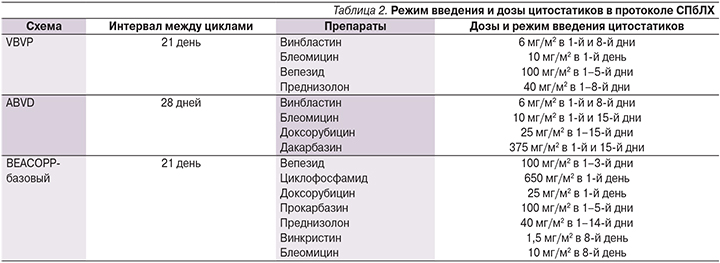
Проведение ЛТ ниже уровня диафрагмы статистически значимо повышало частоту возникновения гипофункции половых желез, данное нарушение было выявлено у 37,5% [16,6–58,3%] пациентов, в группе пациентов без ЛТ снижение фертильной функции выявлено в 7,1% [0,3–17,3%] случаев (p=0,00685; рис. 1).
В табл. 5 представлены результаты однофакторного дисперсионного анализа, согласно которому F>Fтабл. (7,95>2,02; р=0,006845), что доказывает правильность утверждения о значимой доле влияния ЛТ, направленной на лимфатические коллекторы ниже диафрагмы, на риск возникновения фертильных дисфункций.
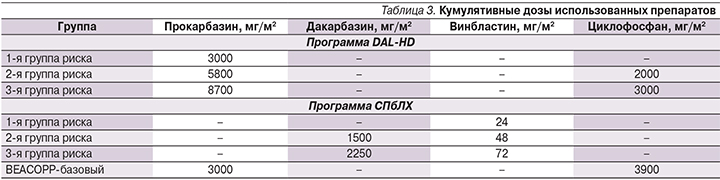
Лечение пациентов, согласно риск-адаптированной программе DAL-HD, а также пациентов программы «ранней интенсификации», пролеченных с использованием схем BEACOPP-базовый, в 42,8 [13,2–72,5%] и 71,4% [46–86%] соответственно ассоциировано с повышенным риском развития гонадной дисфункции; у пациентов, пролеченных согласно программе СПбЛХ, фертильных нарушений выявлено не было (p=0,00000; рис. 2).
Результаты расчета показывают, что F>Fтабл. (19,2>4,3; р=0,000001), следовательно, различия и влияние на фертильность программ лечения основного заболевания существуют (табл. 6).
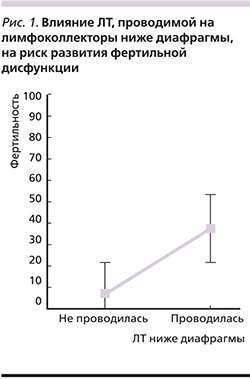
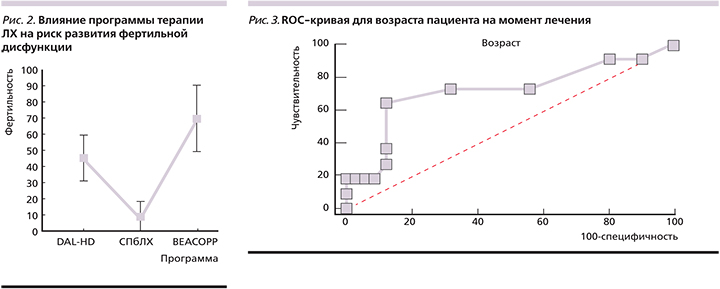
Возраст на момент лечения также оказывал влияние на риск развития половой дисфункции. Точкой отсечения, разделяющей больных в соответствии с возрастом, сопряженным с повышением частоты развития патологии половых желез, оказался 12 лет. Площадь ROC-кривой составила AUC (Area Under Curve)=0,716±0,104 (доверительный интервал – 0,574–0,833; р=0,0378). Индекс Юдена для этого показателя составилл 0,5144 (рис. 3).
На рис. 4 показано, что в 60% случаев гипофункция гонад развилась у пациентов, лечение которых осуществлено в возрасте от 3 до 12 лет (25,6–91), по сравнению с больными, чей возраст на момент лечения составил более 13 лет (рис. 4, табл. 7).
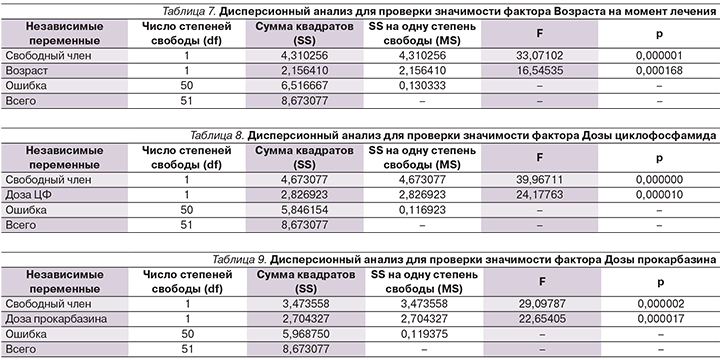
Результаты расчета показывают, что F>Fтабл. (16,5>12,7; p=0,00017), следовательно, различия и влияние возраста на момент лечения – существенный предиктор нарушений фертильной функции в будущем (табл. 7).
Нарушение фертильности было дозозависимым от циклофосфамида: доза, превышавшая 3900 мг/м2, значимо влияла на фертильность (p=0,000; рис. 5).
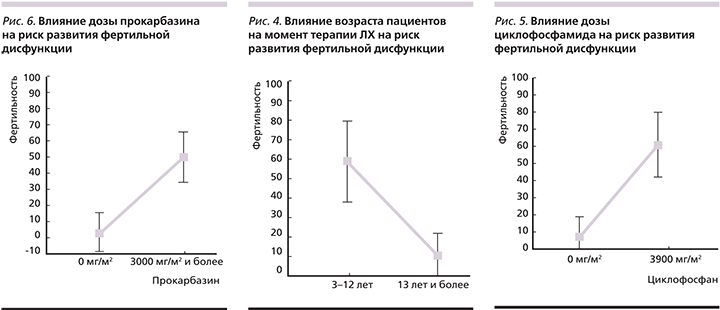
Результаты дисперсионного анализа показали, что разница в кумулятивных дозах циклофосфамида с риском гипофункции половых желез значима (F>Fтабл., 24,1>12,7; табл. 8).
В нашем исследовании подтвержден гонадотоксичный эффект прокарбазина с кумулятивными дозами 3000 мг/м2 и более (p=0,00013; рис. 6).
Нулевая гипотеза отклоняется и принимается альтернативная, согласно которой кумулятивная доза прокарбазина влияет на фертильность пациентов в будущем (F>Fтабл., 22,65>12,7; табл. 9).
Обсуждение
ЛХ у детей является высококурабельным заболеванием. До 98% пациентов могут быть излеченными. К основным методам лечения относятся химиотерапия и ЛТ [1, 2]. Однако помимо лечебного эффекта на организм пациента оказывается и повреждающий эффект на системы органов, в т.ч. на гонады [4–6]. В нашем исследовании мы сравнили риск-адаптированные программы лечения ЛХ DAL-HD (немецкая рабочая группа по изучению ЛХ у детей) и СПбЛХ (оригинальный протокол – разработанный в НМИЦ онкологии им. Н.Н. Петрова). Для оценки фертильной функции (овариального резерва у женщин и гонадной недостаточности у мужчин) мы использовали уровни антимюллерова гормона и ингибина. Программы DAL-HD и схема BEACOPP-базовый (применяемая с 2010 г. для пациентов группы высокого риска) сопровождались более выраженными осложнениями со стороны фертильной функции по сравнению с программой СПбЛХ. Угнетение фертильной функции имели 42,9% пациентов программы DAL-HD и 13,2% получавших схему ВЕАСОРР-базовый, тогда как среди пациентов программы СПбЛХ гипофункции половых желез зафиксировано не было. К основным терапевтическим факторам, оказывающим гонадотоксичный эффект, относились применение алкилирующих агентов, облучение лимфатических коллекторов ниже диафрагмы и возраст пациента на момент начала лечения. По нашим данным, повреждающим действием обладала кумулятивная доза алкилирующих агентов: циклофосфамида – 3900 мг/м2 , прокарбазина – 3000 мг/м2. Кроме того, важным фактором служил возраст пациента на момент начала лечения: чем старше ребенок, тем больше было повреждающее действие химиотерапии и ЛТ на гонады [7]. В нашем исследовании фактором риска угнетения гонадной функции стал возраст младше 12 лет. Облучение лимфатических коллекторов ниже диафрагмы также приводило к снижению фертильности. Данные, полученные в результате нашего исследования, сопоставимы с общемировыми. По данным литературы, у девочек ЛТ ниже диафрагмы приводит к повреждению не только яичников и снижению овариального резерва, но и матки, а также придатков, приводящему к проблемам с имплантацией, что также снижает число беременностей в будущем [12]. В нашем исследовании мы не оценивали данный фактор у пациентов этой категории. У мальчиков ЛТ ниже диафрагмы опасна попаданием в зону облучения яичек и нарушением сперматогенеза в будущем [13]. Для сохранения фертильности разработан ряд методов, среди которых можно указать на транспозицию яичников, криоконсервацию ткани яичника и яйцеклетки [1, 8–11], использование пероральных контрацептивов, которые задерживают примордиальные фолликулы в фазе покоя. Однако их применение весьма ограничено в педиатрической практике. Поэтому основным методом профилактики гонадной дисфункции после терапии ЛХ в детстве служит поиск эффективных режимов ПХТ, обладающих минимальным профилем токсичности. А для выявления возможного нарушения фертильности и своевременного лечения целесообразно обследование таких пациентов на этапе планирования беременности.
Заключение
Бóльшая часть детей с ЛХ могут быть излечены при применении современной риск-адаптированной терапии. Однако химиотерапия и ЛТ имеют отдаленные последствия на организм пациента. С учетом высокого риска развития вторичного бесплодия пациенты, прошедшие лечение от ЛХ в детском и подростковом возрасте, требуют междисциплинарного сотрудничества онкологов, эндокринологов, гинекологов и других специалистов.



