Введение
Бронхиальная астма (БА) – это гетерогенное, хроническое заболевание, распространенное среди людей любого возраста, пола и расовой принадлежности. БА может едва беспокоить пациента легкими и редкими проявлениями или протекать в виде тяжелого заболевания, нарушающего повседневную активность, работоспособность, качество жизни или даже приводящего к смерти. От 1 до 21% людей в различных странах живут с диагнозом БА [1]. Около 300 млн человек по всему миру страдают БА, к 2025 г. их число может увеличиться до 400 млн [2]. Несмотря на оптимистичные сообщения о снижении в некоторых странах количества госпитализаций и смертей по причине БА, глобальное бремя, связанное с ее обострениями и ежедневными клиническими проявлениями, возросло за последние 20 лет на 30% [3, 4].
Стандарты лечения БА, составляющие основу современных зарубежных и отечественных руководств, в состоянии обеспечить больным медицинскую помощь высокого качества. Главной цели терапии – поддержания полного контроля – возможно достичь в отношении большей части пациентов. Реальная же практика показывает, что адекватный контроль БА отсутствует более чем у 50% пациентов [5, 6].
В числе причин недостаточного контроля БА – несоблюдение пациентом врачебных предписаний, определяемое совокупностью факторов, связанных с препаратом (прежде всего ингаляционным глюкокортикостероидом – ИГКС), устройством для доставки препарата в дыхательные пути, социальными и психологическими мотивами [7]. На приверженность пациента предписанному лечению могут влиять ранний дебют БА, статус курильщика, семейный характер заболевания [8].
Причины недостаточного контроля БА
Выделяется определенная доля больных БА, для которых возможность достижения полного контроля заболевания остается трудновыполнимой задачей, несмотря на применение максимального объема рекомендованной базисной терапии. В структуре всех больных БА доля таких пациентов не превышает 5–10%, но именно у них регистрируется самая высокая частота обострений, незапланированных визитов к врачу, обращений за неотложной медицинской помощью и госпитализаций. Рефрактерная к терапии БА поглощает около 50% всех ресурсов системы здравоохранения, затрачиваемых на заболевание в целом [9–12].
Недооценка степени интенсивности эндобронхиального воспаления остается серьезной проблемой даже для пациентов с легкой БА. В частности, у молодых людей с интермиттирующей БА, не получавших регулярной базисной терапии, установлено наличие воспалительных изменений в стенке бронхов и им предложено раннее назначение ИГКС для увеличения контроля и уменьшения частоты обострений заболевания [13]. Воспалительный процесс иммунного характера в крупных (внутренний диаметр бронхов >2 мм) и малых (внутренний диаметр бронхов <2 мм) дыхательных путях развивается в результате сложного взаимодействия генетических факторов и факторов внешней среды.
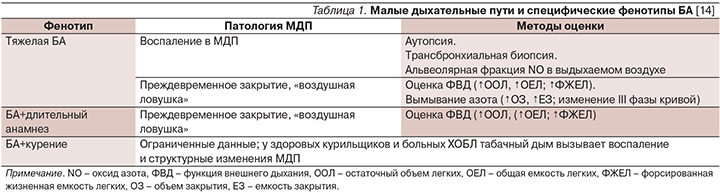
Недавние обзоры свидетельствуют, что изменения, происходящие в малых дыхательных путях (МДП), могут быть «ответственными» за трудности достижения контроля у пациентов с тяжелой БА, у лиц старших возрастных групп, особенно с длительным анамнезом БА, а также у курящих больных БА (табл. 1).
Основные принципы ингаляционной терапии БА
Ингаляционная терапия, оставаясь ведущим методом лечения БА и других бронхообструктивных заболеваний, непрерывно эволюционирует. Попытки создания новых форм ингаляционных препаратов и устройств доставки призваны устранить различные факторы, препятствующие достижению полного контроля над заболеванием. К таким факторам можно отнести субоптимальные свойства аэрозоля, сложные алгоритмы осуществления дыхательного маневра и др. Одной из важнейших характеристик ингаляционного лекарственного вещества, которая определяет его высокую противовоспалительную и/или бронходилатирующую эффективность, служит уровень депонирования в дыхательных путях.
Величина частиц аэрозоля представляется одним из важнейших параметров, обеспечивающих высокий уровень проникновения в дистальные бронхи и депонирования в легких. Чем меньше аэродинамический диаметр частиц, тем больше фракция активного препарата (респирабельная фракция, содержащая частицы <5 мкм), которая не задерживается в ротовой полости и верхних дыхательных путях, а депонируется в дистальных отделах, тем самым увеличивая терапевтический эффект и снижая риск местных нежелательных реакций (рис. 1).

Уровень депонирования препарата в легких зависит от свойств непосредственно препарата и его устройства доставки, а также от анатомических особенностей строения верхних дыхательных путей, величины дыхательного объема и скорости вдоха. Для облегчения доставки в дистальные отделы при использовании дозированных аэрозольных ингаляторов (ДАИ) необходим медленный вдох. Это означает, что полный вдох после максимального выдоха должен совершаться взрослым человеком за 4–5 секунд (скорость потока при этом не будет превышать 30 л/мин) [16]. Напротив, для оптимальной ингаляции при использовании порошковых ингаляторов (ПИ) необходим максимально мощный и быстрый вдох, чтобы преодолеть внутреннее (создаваемое устройством) сопротивление потоку и генерировать турбулентную энергию для деагрегации частиц. Это позволяет увеличивать респирабельную фракцию (табл. 2).

ДАИ остаются наиболее широко используемым типом ингаляторов. Запрет, связанный с желанием улучшить состояние окружающей среды, на использование фреона в качестве пропеллента значительно уменьшил применение хлорфторкарбоновых (ХФК) аэрозолей в пользу гидрофторалакановых (ГФА) [18]. Однако ХФК ДАИ все еще остаются доступными для использования, поэтому необходимо помнить о ряде особенностей, которые могут ограничивать их применение в отношении некоторых пациентов. В первую очередь речь идет о чрезмерно высокой скорости облачка аэрозоля, образуемого при активации ингалятора. Несоблюдение техники ингаляции, прежде всего хорошей координации с вдохом, значительно увеличивает орофарингеальную депозицию. Кроме того, присутствие фреона существенно охлаждает облачко аэрозоля и создает дискомфорт во время ингаляции, что может приводить к рефлекторному прерыванию вдоха при контакте холодного аэрозоля с мягким небом и задней стенкой глотки. Лекарственный препарат в ХФК ДАИ находится в виде суспензии, поэтому перед использованием необходимо встряхнуть устройство. Несоблюдение этого простого условия уменьшает легочную депозицию на 50% [19].
Широкое применение ГФА ДАИ оправдано не только отсутствием токсичности, но и более высокими показателями эффективности и безопасности. Бесфреоновые ДАИ в большинстве случаев содержат лекарственное вещество в виде раствора и генерируют аэрозольное облачко, имеющее низкую скорость и более высокую температуру, что уменьшает орофарингеальную депозицию, делает ингаляцию удобнее и способствует большей приверженности пациента лечению. Использование новых ингаляционных технологий позволяет также придать аэрозольному облаку дополнительные свойства, значительно облегчающие использование ГФА ДАИ и повышающие эффективность лечения БА. Наибольшую известность в последние годы приобрела технология Модулит®, позволяющая генерировать аэрозоль с максимальной фракцией экстрамелких частиц.
Замещение пропеллента, переход от суспензий к растворам не должны были изменять характеристики аэрозоля, такие как размер частиц, величина отмеренной дозы и др. Однако гибкость новой системы позволила не только сохранить свойства аэрозоля, но и разработать новые формы ГФА растворов с модифицируемыми характеристиками аэрозольного облака [20]. Добавление некоторых компонентов в состав смеси (этанола как корастворителя, глицерола или полиэтиленгликоля как модификаторов размера частиц) и изменение конструкции ингалятора (диаметр отверстия актуатора) значительно уменьшили размеры частиц (до 1,1–4,7 мкм), увеличив респирабельную фракцию. Единственной доступной в клинической практике фиксированной остается комбинация экстрамелкодисперсного (ЭМД) беклометазона дипропионата и формотерола (БДП/Ф; рис. 2).
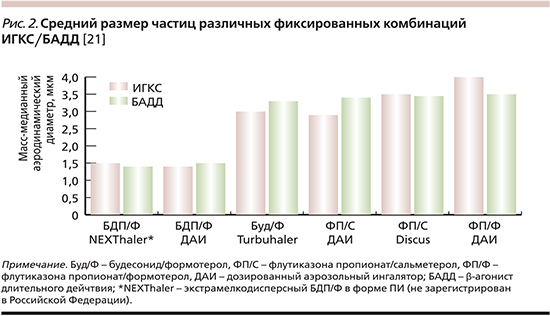
Появление ЭМД-форм аэрозолей призвано способствовать повышению эффективности ингаляционной терапии на всех ключевых этапах. С одной стороны, такие устройства могут облегчать задачу по обеспечению адекватного ингаляционного маневра. С другой – состав и форма смеси позволяют препарату проникать и депонироваться на всем протяжении бронхиального дерева независимо от наличия бронхиальной обструкции, в т.ч., что важно, и в МДП. При этом депозиция в МДП может в несколько раз превосходить таковую для не-ЭМД-форм [22, 23].
Фиксированные комбинации ИГКС/БАДД в профилактике и лечении БА
Учитывая сохраняющиеся трудности в достижении оптимального контроля над заболеванием, уместно напомнить, что, согласно существующим рекомендациям, в лечении пациентов с БА применяется ступенчатый подход. Глобальная стратегия лечения и профилактики бронхиальной астмы (GINA), в т.ч. и последнего пересмотра в 2018 г., предусматривает первостепенное значение фиксированных комбинаций ИГКС/БАДД начиная с третьей ступени подбора лечения, направленного на достижение контроля над БА [25]. Применение комбинации основных препаратов (противовоспалительного и бронхорасширяющего) позволяет не только лучше контролировать ежедневные симптомы БА меньшими дозами ИГКС, но и уменьшить риск развития обострений БА.
Каковы бы ни были теоретические предпосылки превосходства ЭМД форм ингаляционных препаратов в лечении пациентов с БА, наш выбор должен основываться на доказательствах эффективности таких препаратов. Доказательства способности ЭМД БДП/Ф подавлять воспалительный процесс в дистальных отделах бронхиального дерева получены в ходе исследований, оценивавших своеобразные маркеры патологии МДП. Так, более выраженное увеличение емкости закрытия, характеризующей феномен воздушной ловушки при проведении теста вымывания азота при одиночном вдохе, зафиксировано в группе пациентов, получавших ЭМД БДП/Ф, по сравнению с ФП/С [24]. ЭМД ГФА БДП оказался также эффективнее в устранении неоднородности вентиляции и региональной гиперинфляции, подтвержденных с помощью компьютерной томографии высокого разрешения, по сравнению с ХФК-формой [26].
Однако имеющиеся данные не могут в полной мере осветить корреляцию между улучшением функции МДП, положительной динамикой симптомов БА и качеством жизни пациентов. Каков же опыт применения фиксированных комбинаций, содержащих ЭМД формы аэрозоля, на сегодняшний день? Есть ли доказательства клинической эффективности и/или превосходства таких препаратов с учетом особых свойств аэрозоля?

В течение последнего десятилетия накоплена значительная база данных о влиянии БДП/Ф на ежедневные симптомы БА, показатели ФВД, частоту обострений, уровень контроля в целом (табл. 3). Некоторые результаты свидетельствуют о превосходстве ЭМД-формы, другие демонстрируют сопоставимую эффективность различных комбинаций и режимов дозирования. В настоящее время изучение эффективности БДП/Ф продолжается в первую очередь в тех группах больных БА, где влияние патологии МДП может негативно сказываться на возможности достижения контроля. Например, M.-J. Hsieh et al. показали превосходство БДП/Ф над ФП/С в увеличении форсированной жизненной емкости легких (ФЖЕЛ) уже через 5 минут после ингаляции препарата по сравнению с исходным значением на протяжении всего периода лечения (р<0,05; рис. 3). Именно динамика ФЖЕЛ может отражать уменьшение обструкции МДП и снижение выраженности «воздушной ловушки». Улучшение других показателей ФВД и клинических симптомов наблюдалось в обеих лечебных группах без достоверных различий, однако авторы справедливо обращают наше внимание на тот факт, что результат достигался меньшими дозами ИГКС в пересчете на БДП в группе БДП/Ф, чем в группе ФП/С (400 и 1000 мкг соответственно) [33].

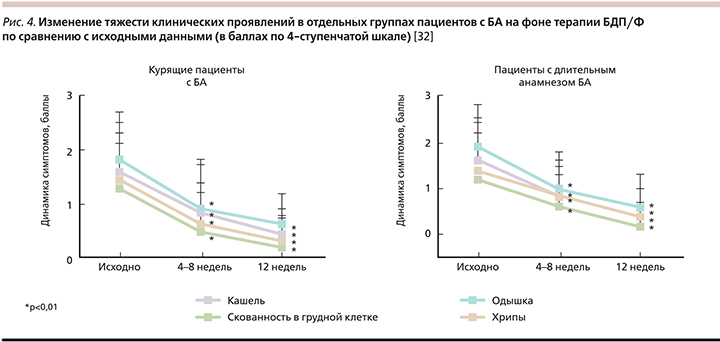
K. Marth еt al. в проспективном исследовании изучали влияние ЭМД БДП/Ф на пациентов с длительным анамнезом БА, курящих и при наличии феномена «воздушная ловушка». В исследование включались больные, которым по различным причинам проводили модификацию базисной терапии с заменой любой комбинации ИГКС/БАДД (включая ФП/С в форме ДАИ или ПИ, БДП/Ф ПИ и др.) на БДП/Ф в форме ДАИ. После изменения базисной терапии в течение 12 недель отмечали динамику клинических симптомов, параметров ФВД, уровня контроля. Оказалось, что положительные изменения были максимально выражены в группах, где влияние воспаления в МДП на течение БА особенно велико: у курящих (индекс >10 пачка/лет), пациентов, длительно страдающие БА (≥10 лет), у больных, у которых выявляется феномен «воздушная ловушка» (ФЖЕЛ <80% от должных значений). Повышение уровня контроля заключалось в уменьшении одышки, кашля, хрипов, чувства скованности в грудной клетке (рис. 4) [32]. Безусловно, наблюдательные исследования имеют ряд ограничений, самое важное из которых отсутствие рандомизации и группы контроля. Это может снижать убедительность полученных результатов.
С другой стороны, критерии отбора в рандомизированные клинические исследования для обеспечения однородности группы, как правило, запрещают включение отдельных популяций больных БА, в т.ч. курильщиков, лиц старших возрастных групп, с тяжелыми сопутствующими заболеваниями.
В этом смысле наблюдательные исследования позволяют получать дополнительную важную информацию, поскольку «сценарий» таких исследований максимально приближен к реальной клинической практике.
Концепция единого ингалятора
C 2006 г. в международных, а затем и в отечественных рекомендациях по лечению БА нашла отражение концепция единого ингалятора. Концепция MART (Maintenance And Reliever Therapy) подразумевает применение одного ингалятора, содержащего комбинацию ИГКС и БАДД (формотерол) и для поддерживающей терапии, и для купирования симптомов БА. До сих пор сравниваются преимущества и недостатки терапии ИГКС/БАДД в фиксированных поддерживающих дозах (с возможностью изменения дозы по рекомендации врача) в сочетании с β2-агонистом короткого действия для купирования симптомов и режима MART. К настоящему времени доказательная база ЭМД БДП/Ф пополнилась исследованиями, подтверждающими эффективность при применении в режиме MART. A. Papi et al. в двойном слепом рандомизированном 48-недельном исследовании показали достоверные преимущества применения БДП/Ф по потребности (по сравнению с сальбутамолом) в дополнение к базисной терапии в отношении снижения частоты тяжелых обострений БА. Время до первого обострения при режиме MART было на 75 дней больше, чем при режиме сравнения, и риск обострения снизился на 36% (р=0,0005). Также значимо меньшим оказалось количество дней нетяжелых обострений у пациентов в группе MART по сравнению с группой, принимавшей сальбутамол по потребности (56,04 против 65,11 дня; р=0,021). Симптомы БА, уровень контроля, показатели ФВД улучшились к завершению исследования и были сопоставимыми в группе MART и в группе, получавшей эквивалентные стабильные дозы ИГКС/БАДД. [31]. Дальнейший анализ данных этого исследования (Post hoc-анализ) проводился с целью оценки корреляции уровня клинических проявлений БА (кашля и хрипов) и частоты тяжелых обострений. Другими словами, авторы задались вопросом: является ли выраженность симптомов предиктором тяжелых обострений БА? На этот вопрос получен отрицательный ответ: выраженность симптомов не коррелирует с частотой обострений. Но этот дополнительный анализ показал, что MART-терапия более эффективна в отношении снижения риска тяжелых обострений в группе пациентов, демонстрировавших меньшее количество дневных и ночных симптомов [34].
Трудности в достижении контроля БА могут быть связаны с разнообразными очень важными факторами. Основным компонентом успешного ведения пациентов остается соблюдение рекомендаций по адекватному объему противовоспалительной и бронхолитической терапии в той или иной клинической ситуации. Однако за клиническими неудачами могут скрываться весьма «прозаические» причины, такие как низкая приверженность лечению. В проспективной фазе наблюдательного исследования PRISMA были продемонстрированы возможности достижения полного контроля БА путем тщательного мониторинга состояния и комплаентности пациентов без изменения объема терапии [35]. К окончанию периода наблюдения число пациентов с полностью контролируемой и хорошо контролируемой БА достигло 22,2 и 58,7% соответственно. Увеличение уровня контроля БА сопровождалось повышением качества жизни пациентов и снижением обращений за медицинской помощью, в т.ч. плановых и экстренных визитов к врачу, госпитализаций. При этом пациенты, получавшие ЭМД БДП/Ф, чаще достигали полного контроля БА и лучшего качества жизни по сравнению с другими фиксированными комбинациями ИГКС/БАДД (рис. 5).

Заключение
В заключение следует отметить, что вопросы медикаментозной терапии БА остаются ключевым предметом обсуждения в различных экспертных сообществах. Это связано с отсутствием до настоящего времени универсальных способов поддержания полного контроля заболевания. Значительное количество фенотипов БА, внешних и внутренних факторов, влияющих на ее течение, постоянно пополняющийся перечень лекарственных препаратов и устройств, позволяющих доставлять эти препараты в дыхательные пути, – вот лишь самый общий круг вопросов, создающих трудности для практикующего врача в выборе оптимальной терапии. В нашей статье освещено лишь несколько аспектов ведения пациентов с БА, помогающих в непростом процессе достижения оптимального контроля заболевания. Процесс изучения вклада патологии МДП в сложный воспалительный процесс, происходящий в бронхах пациента с БА, продолжается. К настоящему времени выделены несколько особых фенотипов, при которых роль МДП нельзя игнорировать, – это БА тяжелого течения, длительно существующая БА и БА у курящих пациентов. Вслед за констатацией этого факта исследователи предлагают следующий шаг – доказательства клинической эффективности ингаляционных препаратов, содержащих особые формы аэрозоля, позволяющие в большем объеме достигать МДП. В первую очередь это касается ключевых «игроков» на «поле» длительной поддерживающей терапии – ИГКС и фиксированных комбинаций ИГКС/БАДД. ЭМД-формы таких препаратов, включая БДП/Ф, должны находиться в арсенале врача как имеющие основательную доказательную базу эффективности для пациентов с БА различного течения в отношении клинических проявлений и частоты обострений.


