Аспирин (ацетилсалициловая кислота – АСК) и нестероидные противовоспалительные средства (НПВС) широко применяются в практике врачей различных специальностей. Вместе с тем у этих лекарственных средств описан большой круг побочных эффектов, среди которых гиперчувствительность занимает важное место, что связано с ее высокой распространенностью и нередко тяжелым течением, вплоть до летального исхода. При гиперчувствительности к АСК и НПВС возможны самые разнообразные проявления, обусловленные гетерогенными патогенетическими механизмами: бронхоспазм, ринит, конъюнктивит, крапивница, ангиоотек, анафилаксия, пятнисто-папулезные кожные высыпания, фиксированная эритема, аллергический контактный дерматит, пневмонит, эозинофильная пневмония, системные синдромы (Стивенса–Джонсона, Лайелла и др.) [1].
Одной из сложных проблем, с которой сталкиваются врачи, является ведение больных бронхиальной астмой (БА) и риносинуситом (РС), страдающих непереносимостью АСК и НПВС. На протяжении столетия со времени первого описания M. Widal et al. «идиосинкратической анафилаксии» у больных БА после приема аспирина использовались различные синонимы этого состояния: аспириновая триада, аспирин-индуцированная астма, синдром Widal, синдром Samter и др. К началу текущего столетия появился новый термин, AERD (aspirin-exacerbated respiratory disease), – аспирин-индуцированное, или аспирин-зависимое, респираторное заболевание (АИРЗ), отражающий понимание того, что БА и РС при данной патологии тесно связаны патогенетически. Кроме того, стали известны случаи непереносимости АСК больными РС без БА [2]. Аналогично AERD появившееся относительно недавно понятие NERD (nonsteroidal anti-inflammatory drugs-exacerbated respiratory disease) – респираторное заболевание, индуцированное НПВС, которое подчеркивает, что триггером при данной патологии являются не только АСК, но и другие НПВС. В соответствии с современными представлениями о патогенезе болезни предлагается заменить старый термин «непереносимость АСК и НПВС» на гиперчувствительность (ГЧ) [1]. Среди всех упомянутых терминов в настоящее время в медицинской литературе наиболее широко используется AERD (АИРЗ), который включает эозинофильную БА и/или эозинофильный хронический РС (чаще полипозный) в сочетании с ГЧ к АСК и НПВС [3].
Распространенность АИРЗ варьируется от 0,3–0,6% в общей популяции и до 4,3–15% среди астматиков, а при использовании провокационного аспиринового теста частота диагностированной ГЧ к АСК у больных БА возрастает до 21–28%. Наиболее высокие показатели, достигающие 30–40%, регистрируются у пациентов с тяжелой астмой, сочетающейся с полипозным РС [1, 4, 5].
Механизмы развития аспирин-индуцированного респираторного заболевания
Пусковые механизмы патогенеза АИРЗ до сегодняшнего дня остаются во многом непонятными. Предполагается роль нарушения синтеза и функции липидных медиаторов, дисбаланса системы врожденного и адаптивного иммунитета, дисфункции эпителиального барьера, вирусной и бактериальной инфекции и др.
Роль липидных медиаторов. Сущест-вует значительная доказательная база, согласно которой патологическая IgE (иммуноглобулин Е)-независимая реакция гиперчувствительности к АСК и НПВС при АИРЗ связана с нарушением метаболизма арахидоновой кислоты. Этот, вероятно, генетический дефект приводит к дисбалансу липидных медиаторов: гиперпродукции провоспалительных и бронхоконстрикторных цистеиниловых лейкотриенов (LTC4, LTD4, LTE4) и простагландина D2 (PgD2), к снижению синтеза противовоспалительного бронхопротективного PgE2 [1, 2, 4, 6, 7] (рис. 1).
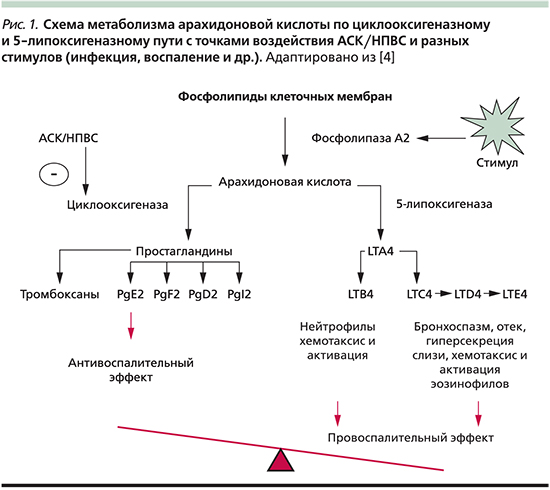
Следствием этой дисрегуляции служит повышение уровня LTЕ4, что было показано при изучении респираторного секрета и мочи пациентов с АИРЗ по сравнению с больными БА, толерантными к АСК. Более того, при провокационном аспириновом тесте у пациентов с ГЧ к нему уровень LTЕ4 в моче повышается в несколько раз. Повышенный уровень цистеиниловых LT вызывает бронхоспазм, отек слизистой оболочки дыхательных путей, гиперсекрецию слизи, а также хемотаксис и активацию эозинофилов. «Перепроизводство» LT в наибольшей степени усугубляется действием лекарств, ингибирующих циклооксигеназу 1-го типа (ЦОГ-1) [1, 4, 5, 7].
На протяжении нескольких лет лейкотриеновая гипотеза была доминирующей в патогенезе АИРЗ. В то же время многие механизмы заболевания оставались непонятными, в т.ч. почему блокаторы рецепторов цистеиниловых LT слабо или вообще не предотвращают реакцию при провокации АСК?
В ряде исследований получены доказательства того, что в развитии воспаления и бронхоконстрикции при АИРЗ доминирующую роль играет PgD2 [5, 6, 8], а также его взаимодействие с PgE2; эти факты в большей степени пролили свет на механизмы ГЧ к АСК/НПВС. Известно, что противовоспалительное, жаропонижающее и анальгетическое действия АСК/НПВС связаны с торможением синтеза простагландинов различных классов (рис. 1). Лекарственные триггеры АИРЗ в основном представлены АСК и неселективными ингибиторами ЦОГ-1 и ЦОГ-2 [1] (см. таблицу). В то же время преимущественно селективные ингибиторы ЦОГ-2 и коксибы значительно реже вызывают симптомы ГЧ у пациентов с АИРЗ. Предполагается, что это связано с тем, что АСК и неселективные ингибиторы ЦОГ угнетают синтез PgE2, а селективные существенно не влияют на его уровень.
Показано, что уменьшение синтеза PgE2 способствует увеличению образования провоспалительного и бронхоконстрикторного PgD2, уровень метаболитов которого в моче в 2 раза выше у пациентов с АИРЗ по сравнению с контролем и значительно возрастает в процессе индуцированных АСК реакций. Основным источником высвобождения PgD2 при АИРЗ являются тучные клетки. В ряде исследований получены данные об уменьшении образования PgE2 в назальном эпителии, тканях полипов и клетках периферической крови при АИРЗ.
Кроме того, у этих больных обнаружено снижение экспрессии рецепторов PgE2 в клетках воспаления, инфильтрирующих слизистую оболочку носа [8–10]. Предполагается также, что дисфункция PgE2 влияет на лейкотриеновый путь и другие механизмы патогенеза АИРЗ. Одним из доказательств протективного действия PgE2 является тот факт, что при провокационном аспириновом тесте ингаляция PgE2 уменьшает бронхоконстрикцию и содержание LTE4 в моче. По-видимому, эти результаты свидетельствуют о том, что извращение синтеза PgE2 и/или функции рецепторов может играть важную роль при АИРЗ [1, 9, 11, 12].
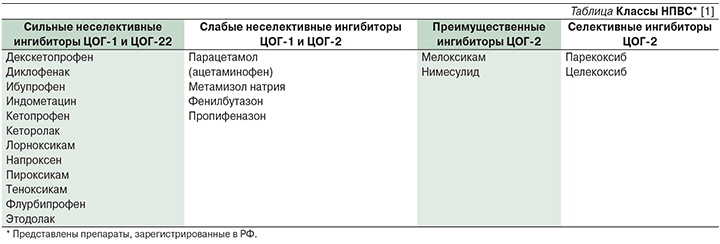
Цитокины и клетки воспаления. Другим возможным механизмом избыточного образования PgD2 и цистеиниловых LT при АИРЗ служит дисрегуляция системы неспецифического (врожденного) иммунитета, проявляющаяся повышением активности интерлейкина-33 (ИЛ-33), тимического стромального лимфопоэтина (TSLP – thymic stromal lymphopoietin) и 2-го типа лимфоидных клеток врожденного иммунитета (ILC2 – innate lymphoid cells group 2).
Предполагается, что универсальной реакцией при вирусных и бактериальных инфекциях (и других «сигналах опасности», когда необходима быстрая реакция в течение первых минут–часов) является высвобождение из клеток респираторного эпителия «алармических» (т.е. «тревожных») цитокинов TSLP, ИЛ-25, -33. Под их влиянием ILC2 способны продуцировать ИЛ-5, -9 и -13. При АИРЗ в ткани полипов носа наблюдается выраженная экспрессия TSLP, ИЛ-33, ILC2, PgD2 и цистеиниловых LT, возрастающая в процессе провокационного аспиринового теста. По-видимому, TSLP управляет процессом генерации в тучных клетках липидных медиаторов, а они в свою очередь после провокации АСК могут способствовать миграции ILC2 из крови в слизистую оболочку дыхательных путей, их последующей активации и продукции провоспалительных цитокинов (рис. 2) [3, 5, 6, 13–16].
Под влиянием PgD2 и цистеиниловых LT значительно повышается способность ILC2 к продукции не только ИЛ-5, -9 и -13, но и ИЛ-4, характерного для аллерген-индуцированных реакций, опосредованных Th2-клетками адаптивного (специфического) иммунитета. Таким образом, при АИРЗ, даже если у пациента нет фоновой атопии, наблюдается цитокиновый профиль, сходный с аллергическими IgE-зависимыми заболеваниями [13, 14]. С учетом этой описанной относительно недавно способности ILC2 продуцировать такие же цитокины, как и Th2 -клетки адаптивного иммунитета, а также частого взаимодействия ILC2 и Th2 друг с другом в последние годы предлагается выделять не «Th2», а «Т2»-эндотип воспалительных заболеваний, объединяющий вовлечение как врожденного, так и адаптивного иммунитета в патологический процесс. К Т2-эндотипу, по современным представлениям, относятся различные заболевания с эозинофильным фенотипом воспаления (атопическая БА, АИРЗ, полипозный РС у пациентов с толерантностью к АСК/НПВС, эозинофильный эзофагит, атопический дерматит и др.) [5, 13, 15].
Нередко наблюдается сочетание аспириновой и атопической БА, а также тесное взаимодействие неиммунологических и IgE-опосредованных реакций у одного пациента (рис. 2). Главные цитокины Т2-эндотипа – ИЛ-4, -5, -9, -13 – интерлейкины, играющие важнейшую роль в процессах воспаления и ремоделирования дыхательных путей. Одна из основных функций ИЛ-4 – стимуляция В-клеточной пролиферации и трансформации в плазматические клетки, а также регуляция переключения синтеза антител с одного класса на другой и увеличение продукции IgE.
В последние годы показано, что ИЛ-4 участвует во взаимодействии ILC2 и Th2, т.е. врожденного и адаптивного иммунитета. ИЛ-5 – главный фактор дифференциации, роста, активации и продолжительности жизни эозинофилов, замедляющий их апоптоз. ИЛ-9 стимулирует пролиферацию и дифференциацию тучных клеток, способствует их активации и экспрессии высокоаффинных IgE-рецепторов на мембране. ИЛ-13 играет важную роль в контактах ILC2 с антиген-представляющими (дендритными) клетками, Th2- и В-клетками. Под влиянием ИЛ-13 происходит активация дендритных клеток, которые в свою очередь способствуют трансформации «наивных» CD4+ Т-лимфоцитов (Th0) в Th2. ИЛ-13 индуцирует превращение В-лимфоцитов в плазматические клетки, синтезирующие специфические IgE. ИЛ-13 обладает и другими функциями, в т.ч. участвует в активации провоспалительных медиаторов клеток респираторного эпителия и усилении продукции слизи, он также способствует повышению бронхиальной гиперреактивности и развитию суб-эпителиального фиброза [4, 13, 15].
Характерной особенностью АИРЗ является выраженная эозинофильная инфильтрация верхних и нижних дыхательных путей [3–5,13, 14, 16]. Новые данные о роли ILC2, свидетельствующие о взаимосвязи врожденного и приобретенного иммунитета, выделение Т2-эндотипа воспаления позволили по-новому взглянуть на механизмы эозинофилии при АИРЗ. При этой патологии ключевую роль, как и при других эозинофильных заболеваниях, играет ИЛ-5, основным источником которого служат ILC2 и Th2 (рис. 2). Подтверждением существенной роли ИЛ-5 в патогенезе эозинофилии при АИРЗ является эффект от препаратов таргетной анти-ИЛ-5-терапии [4].
Роль инфекции. В последнее время интенсивно изучается роль суперантигенов Staphylococcus aureus в патогенезе АИРЗ, при котором обнаружена высокая степень колонизации Staphylococcus aureus слизистой оболочки дыхательных путей. Имеются данные, согласно которым подавление активности рецепторов PgE2 может быть вызвано энтеротоксином В Staphylococcus aureus. Кроме того, показано, что уровень сывороточных IgE к стафилококковым энтеротоксинам А и В (SEA/SEB) значительно выше у пациентов с аспириновой астмой по сравнению с больными атопической БА. У пациентов с высоким содержанием IgE к SEA также более выражена бронхиальная гиперреактивность. Не только в сыворотке, но и в ткани назальных полипов обнаруживаются IgE к суперантигенам Staphylococcus aureus, уровень которых хорошо коррелирует с активностью эозинофилов [2, 17, 18].
Кроме бактериальной инфекции современные исследования подтверждают механизмы вирус-индуцированных обострений АИРЗ в контексте патогенеза Т2-эндотипа БА (см. рис. 2).
Вирус-индуцированное повреждение назального и бронхиального эпителия вызывает высвобождение «алармических» цитокинов ИЛ-33, -25 и TSLP, которые активируют ILC2 и тучные клетки, а также способствуют вовлечению Th2 в иммунный ответ на вирусную инфекцию. Согласно другим данным, важным «пусковым» механизмом вирус-индуцированных обострений АИРЗ является дисфункция эпителиального барьера, связанная с аномалией толл-подобных рецепторов, в частности 3-го типа (TLR3) [19].
Таким образом, АИРЗ – это многофакторная патология, в развитии которой играют роль липидные медиаторы, дисбаланс врожденного и адаптивного иммунного ответа, дисфункция эпителиального барьера, а также различные внешнесредовые факторы. АСК и НПВС – это только одни из многих триггеров болезни, но ГЧ к ним служит облигатным клиническим маркером АИРЗ.
Клиника и диагностика
АИРЗ чаще всего проявляется в форме классической триады: БА, полипозный РС, гиперчувствительность к АСК/НПВС. Однако интолерантность к АСК/НПВС может наблюдаться у больных аспириновой БА с сопутствующим хроническим неполипозным РС, при изолированном (без астмы) полипозном РС и реже – у больных хроническим РС без полипоза. Аспириновая БА, как правило, имеет персистирующее течение (от среднетяжелого до тяжелого), характерны частые обострения, в т.ч. вирус-индуцированные, в некоторых особо тяжелых случаях может формироваться необратимая бронхиальная обструкция и стероидозависимость [1, 20–22].
РС при АИРЗ также отличается постоянным упорным течением и инфекционными обострениями. Назальные полипы при эндоскопии выявляют у 60% больных РС, а при использовании компьютерной томографии (КТ) – в 90% случаев [2, 20, 22]. При длительном КТ-мониторинге придаточных пазух носа полипы обнаруживаются в первую очередь в синусах, и лишь потом в носовых ходах. По мере прогрессирования болезни отмечается вовлечение всех придаточных пазух (пансинусит). Большинство пациентов с полипозным РС жалуются на постоянную заложенность носа, гипосмию или аносмию, выраженную ринорею со слизистым или слизисто-гнойным отделяемым, а также на боль в области лица, головы. Полипы обычно рецидивируют после оперативного лечения, если пациент не получает терапии глюкокортикостероидами (ГКС).
Типичный возраст дебюта АИРЗ колеблется в интервале от 20 до 40 лет, но нередко аспириновая БА бывает вариантом поздно возникшей астмы [1, 4, 20, 21], в отдельных случаях первые признаки заболевания отмечаются в детстве [23]. АИРЗ чаще встречается у женщин в соотношении с мужчинами 2:1, при этом, как правило, у женщин болезнь протекает тяжелее, чем у мужчин [20, 24].
Типичные проявления ГЧ у больных АИРЗ обычно наблюдаются при уже сформировавшейся БА, но иногда именно первый приступ удушья у больных РС происходит на фоне приема АСК или НПВС. Как при персистирующей БА, так и при ее дебюте лекарственно-индуцированный бронхоспазм может протекать очень тяжело, с развитием жизнеугрожающего состояния. Выраженность реакции часто бывает дозозависимой. Наблюдаются также и другие респираторные симптомы: кашель, ринорея, охриплость голоса, стридор. Иногда дыхательные расстройства сопровождаются гиперемией и отеком лица, конъюнктивитом, крапивницей, абдоминальными болями, рвотой, редко регистрируется падение артериального давления. Клиническая картина реакции ГЧ к АСК/НПВС может развиваться быстро (через 15–20 минут) или более медленно (от 30 минут до 1–3 часов) [1, 20, 21, 24]. В некоторых случаях первые признаки лекарственной ГЧ ярко не проявляются. Тем не менее заподозрить формирование АИРЗ можно, если течение астмы становится неконтролируемым на фоне назначенных по какому-либо поводу АСК или НПВС. Редко АИРЗ ограничивается только хроническим РС без формирования БА. Однако следует отметить, что при углубленном обследовании некоторых таких пациентов выясняется, что хотя у них нет симптомов типичной БА с четко очерченными приступами экспираторного удушья, тем не менее есть признаки воспаления бронхов (продуктивный кашель, эозинофилия мокроты и/или жидкости бронхоальвеолярного лаважа), а при проведении спирометрии регистрируются обструктивные нарушения функции внешнего дыхания.
У части больных АИРЗ отмечается ГЧ к пищевым продуктам, содержащим природные салицилаты [22, 25]. Перечень таких продуктов достаточно широк [26], но наиболее часто это малина, земляника, черная смородина – ягоды, используемые в народной медицине в качестве жаропонижающих и противовоспалительных средств.
Диагностика АИРЗ проводится в первую очередь на основании анамнеза и клинических особенностей, однако в ряде случаев ГЧ к АСК подтверждается с помощью провокационного теста (ПТ). Лабораторная диагностика ГЧ к АСК/НПВС, несмотря на свою потенциальную привлекательность вследствие безопасности для больного, пока не получила широкого распространения, что связано с недостаточной доказательной базой в отношении чувствительности, специфичности и воспроизводимости методов.
Предположение о наличии АИРЗ должно возникать во всех случаях эозинофильной БА, сочетающейся с гиперпластическим или полипозным РС. Если у пациента при приеме АСК и/или НПВС по данным анамнеза имелись характерные побочные эффекты, то проведения ПТ для подтверждения диагноза не требуется [1]. Обследование таких больных должно включать общепринятые для БА функциональные тесты и дополнительные методы, позволяющие оценивать выраженность полипоза носа и придаточных пазух (интраназальная эндоскопия и КТ), а также эозинофильного воспаления (цитология носового секрета и мокроты, оксид азота в выдыхаемом воздухе). Эта исходная информация необходима для последующего мониторинга эффективности лечения.
Так как механизмы ГЧ к АСК и НПВС при АИРЗ неиммунологические, кожные тесты с данными лекарственными препаратами для диагностики не применяются. В комплекс обследования должно входить стандартное аллергологическое тестирование, включающее кожные пробы и по показаниям – определение специфических IgE к основным атопическим аллергенам, т.к. атопия у больных АИРЗ отмечается в 30–70% случаев [1, 20, 22, 26].
Провокационный тест. Необходи-мость в ПТ возникает при наличии клинических признаков АИРЗ, но в отсутствие четких указаний в анамнезе на ГЧ к АСК и/или НПВС. Специалисты, занимающиеся проблемой АИРЗ, отмечают его гиподиагностику, если ориентироваться только на данные анамнеза пациента. Однако недиагностированная ГЧ к НПВС представляет реальную угрозу для жизни больного, в связи с чем рекомендуется более широкое применение ПТ в специализированных клиниках. Несмотря на то что у пациентов с АИРЗ регистрируется ГЧ не только к АСК, но и другим НПВС, стандартизованным ПТ является только аспириновый, который существует в нескольких модификациях [1, 26].
Лечение АИРЗ
К основным направлениям лечения АИРЗ относятся:
- противовоспалительная фармакотерапия;
- исключение/ограничение триггеров, поддерживающих тканевое воспаление;
- снижение чувствительности к АСК и НПВС (десенситизация);
- новое направление – целевая биологическая терапия.
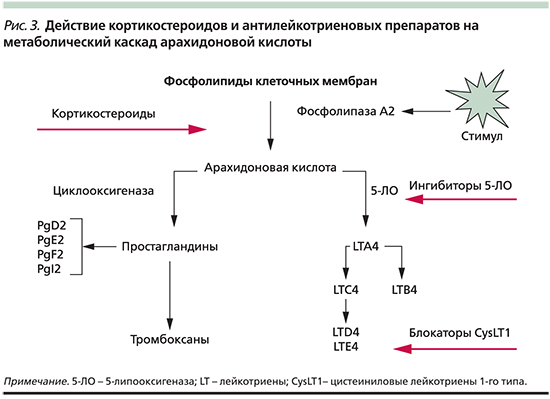
Противовоспалительная фармакотерапия. Лечение клинических проявлений АИРЗ представляет непростую задачу в связи с персистирующим тяжелым, нередко резистентным к терапии течением БА и полипозного РС. К главным лекарственным средствам фармакотерапии этих заболеваний относятся ГКС – универсальные противовоспалительные препараты, действующие на разные патогенетические звенья заболевания [2, 21, 24]. Наиболее выраженное действие на эозинофильное воспаление при АИРЗ оказывают системные ГКС (СГКС). Так, при полипозном РС двухнедельное лечение СГКС в суточной дозе 0,5–1 мг/кг в эквиваленте преднизолона называют фармакологической полипэктомией благодаря клиническому эффекту, сопоставимому с хирургическим удалением полипов. Известно, что ГКС редуцируют синтез фосфолипазы A2, тем самым предотвращая образование всех продуктов арахидонового каскада: лейкотриенов, простагландинов, тромбоксанов (рис. 3), что представляется их важным терапевтическим свойством во многих случаях АИРЗ.
Однако, несмотря на эффективность, длительный прием СГКС лимитируется хорошо известными системными побочными эффектами. В связи с этим предпочтительна терапия топическая с использованием ингаляционных и назальных ГКС (ИГКС и НГКС). В то же время нередко ИГКС и НГКС даже в максимальных терапевтических дозах не позволяют полноценно контролировать симптомы БА и РС, в связи с чем ведутся поиски лекарственных средств для комбинированной терапии при лечении АИРЗ.
К лекарственным средствам, оказывающим синергичное действие с ГКС на воспаление при АИРЗ, относятся антилейкотриеновые препараты (АЛП), подразделяемые на две группы в зависимости от их действия на метаболизм арахидоновой кислоты (рис. 3).
- Первая группа – ингибиторы фермента 5-липоксигеназы, напрямую блокирующие его каталитическую активность и таким образом редуцирующие образование лейкотриенов; представителем этого класса лекарств является зилеутон (В РФ не зарегистрирован).
- Вторая группа – антагонисты рецепторов цистеиниловых лейкотриенов 1-го типа (CysLT1), селективно блокирующие рецепторы LTC4, LTD4 и LTE4.
Блокатор рецепторов CysLT1 монтелукаст применяется для лечения как БА, так и полипозного РС. Однако в отличие от атопической БА и аллергического ринита, при легком течении которых монтелукаст нередко эффективен в виде монотерапии, при АИРЗ он используется в комбинации с ГКС [2, 21, 24]. Это связано с достаточно «узким» фармакологическим действием, которое не позволяет достигать полноценного контроля сложных механизмов воспаления. В то же время показано, что у больных аспириновой БА сочетание монтелукаста с высокими дозами ИГКС или СГКС по сравнению с монотерапией ГКС сопровождалось достоверным повышением объема форсированного выдоха в 1-ю секунду (ОФВ1), уменьшением бронхиальной гиперреактивности, снижением потребности в короткодействующих бронхолитиках и уменьшением числа обострений, снижением и даже полной отменой СГКС, улучшением качества жизни. Кроме того, одновременное применение монтелукаста с НГКС приводит к улучшению течения РС у больных АИРЗ и уменьшает частоту рецидивов полипоза после операций [2, 24, 27–29].
Лечение БА и оценка эффективности терапии проводятся в соответствии с общими принципами, изложенными в современных международных документах и национальных клинических рекомендациях [21, 30]. Так как аспириновая БА обычно характеризуется среднетяжелым/тяжелым персистирующим течением, лечение соответствует 3–4-й ступеням по GINA (Global Initiative for Asthma). СГКС (5-я ступень) применяются при неконтролируемой БА, несмотря на максимальный объем лечения на 4-й ступени; начинают обычно с 0,5 мг/кг/сут внутрь (преднизолон или эквивалент), добавляя его к другим базисным препаратам. Продолжительность такого режима терапии СГКС варьируется и определяется скоростью достижения контроля, а затем начинается постепенное снижение до наименьшей поддерживающей дозы ГКС или полной его отмены.
Основой фармакотерапии РС служат НГКС, эффективные для значительной части больных АИРЗ. При полипозном РС эффективность СГКС и НГКС подтверждена в исследованиях с самым высоким уровнем доказательности [2, 31]. В клинической практике первые признаки субъективного улучшения на фоне НГКС (уменьшение блокады носа, гипосмии, ринореи) оценивают через 2–4 недели. При положительной динамике лечение НГКС проводят неопределенно долго, чаще всего пожизненно. В отсутствие эффекта от начального курса НГКС добавляют СГКС (в эквиваленте преднизолона 0,5 мг/кг) в течение 10–14 дней с последующим снижением объема и отменой системной терапии и продолжением топического лечения. Долговременный эффект фармакотерапии полипозного РС оценивается по динамике субъективных ощущений пациента и объективным признакам (уменьшение/исчезновение полипов при назальной эндоскопии и КТ носа и придаточных пазух, снижение эозинофилии носового секрета).
Отсутствие эффекта от консервативной терапии пациентов с множественными полипами и выраженной назальной обструкцией служит показанием к оперативному лечению с использованием современной функциональной эндоскопической хирургии. Операция должна выполняться на фоне базисной терапии с достижением полного или частичного контроля БА, при ОФВ1≥70%. Для уменьшения риска обострения БА рекомендуется короткий курс СГКС в эквиваленте преднизолона 30–40 мг/сут в течение 3 дней до и 3 дней после операции [22]. За 30–40 минут до начала операции проводится также ингаляция β2-агониста. В большинстве случаев премедикация ГКС и β2-агонистами снижает вероятность обострения БА. После операции, как правило, продолжается базисная фармакотерапия НГКС [2].
Биологическая (целевая) терапия.
В последние годы при тяжелой, терапевтически резистентной аспириновой БА изучается возможность дополнительной анти-IgE-терапии. Показана эффективность омализумаба при аспириновой БА с повышенным уровнем общего IgE, рефрактерной к максимальным дозам ИГКС, в сочетании с длительно действующими β2-агонистами и АЛП и требующей постоянной терапии СГКС. Длительное лечение омализумабом даже без фоновой атопии приводило к улучшению контроля болезни и качества жизни, что сопровождалось значительной редукцией дозы СГКС, выраженным снижением уровня эозинофилии, улучшением течения полипозного РС и даже формированием толерантности к аспирину [32–35].
С учетом важной роли эозинофилов в патогенезе АИРЗ актуальным направлением биологической терапии является воздействие на Т2-эндотип воспаления. В клинических исследованиях с применением моноклональных антител к ИЛ-5 (меполизумаб, реслизумаб) или его рецепторам (бенрализумаб), а также к ИЛ-4 и -13 (дупилумаб) при эозинофильной БА и РС показано, что эти препараты приводят к быстрому и выраженному снижению числа эозинофилов в крови и тканях дыхательных путей, уменьшению размера назальных полипов и симптомов РС. У пациентов с эозинофильной БА продемонстрировано также значительное улучшение симптомов и качества жизни, в т.ч. в подгруппах пациентов, страдавших сопутствующим полипозным РС, в связи с чем результаты этих исследований экстраполируют и на больных АИРЗ [4, 24, 36–39].
Ограничение (исключение) действия триггерных факторов. У больных АИРЗ терапевтически резистентное течение может поддерживаться различными триггерами. Наиболее важные из них – ингибиторы ЦОГ-1: АСК, НПВС и природные салицилаты. Лекарственные средства ингибиторы ЦОГ подразделяются на 4 группы [1]:
- селективные ингибиторы ЦОГ-1 (АСК в дозах 80–100 мг);
- неселективные ингибиторы ЦОГ-1 и ЦОГ-2 (большинство НПВС – производных пропионовой, уксусной, фенамовой кислот, некоторые оксикамы, АСК в высоких дозах);
- преимущественно селективные ингибиторы ЦОГ-2 (нимесулид, мелоксикам);
- специфические (высокоселективные) ингибиторы ЦОГ-2 (коксибы).
Больным АИРЗ рекомендуется исключать все препараты, содержащие АСК. Альтернативным жаропонижающим средством служит парацетамол, который в дозах не более 1000 мг обычно переносится больными АИРЗ, хотя у 5% особо чувствительных пациентов также может вызывать реакции ГЧ [1, 22]. Опасность для больных АИРЗ представляют «классические» НПВС – сильные неселективные ингибиторы ЦОГ-1 и ЦОГ-2, широко применяемые врачами различных специальностей (см. таблицу). НПВС выпускаются в лекарственных формах для парентерального введения, приема внутрь, ректально и в виде топических средств (включая пластыри, мази, кремы, гели, пастилки для рассасывания, глазные капли и др.) для лечения воспаления, локализующегося в различных органах.
Метамизол (Анальгин и др.), как и все многокомпонентные лекарства, в состав которых он входит, не рекомендуется в качестве анальгетика в связи со способностью метамизола угнетать синтез простагландинов и индуцировать реакции у 9% аспирин-чувствительных больных [20]. При легком и умеренном болевом синдроме (зубная и головная боль, алгодисменорея и др.) с осторожностью возможно использование парацетамола в дозе 500 мг или ингибиторов ЦОГ-2 (см. таблицу). При необходимости интенсивной болеутоляющей терапии применяются агонисты опиоидных рецепторов – наркотические анальгетики морфин и тримеперидин или ненаркотические синтетические препараты буторфанол и трамадол, а также флупиртин.
Преимущественные ингибиторы ЦОГ-2 в низких дозах обычно хорошо переносятся больными аспириновой БА, в то же время высокие дозы могут быть небезопасными [1]. Поэтому лечение мелоксикамом или нимесулидом начинать лучше в условиях стационара и рекомендовать пациентам в дальнейшем не превышать терапевтические дозы. Специальные исследования, проведенные при АИРЗ, свидетельствуют, что селективные ингибиторы ЦОГ-2 – коксибы – дают «перекрест» с АСК и неселективными НПВС в 1–2% случаев [1, 40]. При высокой чувствительности к АСК больным АИРЗ стартовую терапию коксибами рекомендуется также проводить в стационаре, т.к. и они могут вызывать тяжелые реакции.
Сложной проблемой является первичная и вторичная профилактика тромбозов артериальных сосудов при кардиоваскулярных болезнях, т.к. АСК (Аспирин, Кардиомагнил, Тромбо АСС и др.) применяются наиболее часто с учетом благоприятного соотношения эффективность/стоимость.
В последние годы показано, что замена АСК на тиклопидин или клопидогрел приводит к аналогичному или более выраженному профилактическому эффекту, однако значительно удорожает лечение. В ряде исследований продемонстрирован наилучший эффект от комбинации АСК с клопидогрелом или тиклопидином, поэтому для некоторых пациентов с AИРЗ актуально продолжение приема АСК, для чего им проводится десенситизация [1, 41, 42].
Диетические рекомендации. Естест-венные салицилаты содержатся во многих растительных продуктах [25, 26], но в разных концентрациях. Как правило, наблюдается дозозависимый провоцирующий эффект, поэтому пациентам рекомендуется ограничение их употребления [25, 31, 43].
В то же время нет убедительных доказательств, будто исключение салицилатов из пищи предотвращает прогрессирование аспириновой БА и рецидивы полипоза носа [1, 21, 22, 25]. Необходимо также отметить, что полное исключение салицилатов из пищи практически невозможно, т.к. они обнаружены более чем в трехстах видах часто употребляемых продуктов, кроме того, в последние годы показано, что природные салицилаты играют важную роль в профилактике кардиоваскулярных заболеваний, колоректального рака и другой патологии [25].
Десенситизация АСК (снижение чувствительности шоковых органов). Термин «десенситизация» (ДС) применяется для обозначения лечебного воздействия, приводящего к снижению ответа или ареактивности эффекторных клеток воспаления в ответ на быстрое наращивание дозы лекарственных субстанций. В отличие от аллергенспецифической иммунотерапии атопических заболеваний основным свойством ДС считается не формирование иммунологической толерантности, а снижение реактивности таких клеток, как тучные, базофилы и эозинофилы. При ДС ареактивность наблюдается только в период введения поддерживающей дозы препарата и непродолжительное время (исчисляемое несколькими днями) после прекращения его приема.
ДС при АИРЗ направлена на снижение чувствительности к АСК и НПВС при необходимости их назначения по поводу какого-либо заболевания.
В то же время в некоторых исследованиях показано, что проведение ДС и затем постоянный прием поддерживающей дозы АСК в целом улучшают контроль симптомов аспириновой БА и РС. Более того, у некоторых больных полипозным РС, рефрактерным к фармакотерапии, ДС приводит к замедлению или даже прекращению роста полипов, уменьшению частоты рецидивов полипоза после оперативного лечения. Аспириновая ДС улучшает контроль симптомов БА и РС и, что очень важно, способствует уменьшению потребности в СГКС [2, 4, 24, 31, 42, 44, 45]. ДС проводится аллергологом-иммунологом только в стационаре, где есть возможность оказания неотложной помощи в отделении интенсивной терапии. Следует отметить, что ДС представляет непростую задачу в отношении как безопасности начального этапа, так и приверженности больных последующему постоянному и пожизненному приему поддерживающей дозы АСК.
Заключение
Завершая данный обзор, следует еще раз подчеркнуть актуальность проблемы своевременной диагностики АИРЗ, так как АСК и НПВС, назначаемые в связи с различной патологией, часто не только способствуют персистированию и прогрессированию воспаления дыхательных путей, но и представляют реальную угрозу для жизни пациента. Несмотря на триггерные эффекты АСК и НПВС у пациентов с ГЧ к этим препаратам, только их элиминацией лечение АИРЗ не ограничивается, поскольку механизмы воспаления при данной патологии гетерогенны и обусловлены влиянием многих факторов. Развившееся АИРЗ продолжается всю жизнь, что требует постоянной противовоспалительной терапии, включающей комбинированные препараты ИГКС и длительно действующие β2-агонисты, НГКС, антагонисты лейкотриеновых рецепторов. Сохранила свое значение до настоящего времени и десенситизация аспирином при наличии строгих показаний к назначению АСК и неселективных НПВС. Перспективным направлением в рамках современного противовоспалительного лечения тяжелых форм АИРЗ является биологическая «целевая» терапия моноклональными антителами, в частности к IL-5 и его рецепторам.



