Введение
Хроническая обструктивная болезнь легких (ХОБЛ) – по-прежнему одна из ведущих причин смертности в мире [1]. Хотя за последние годы наблюдается небольшое снижение смертности от данного заболевания [2], в 2012 г. 6% от всех смертей в мире (более 3 млн) связано с ХОБЛ [1]. По данным 2010 г., заболевание находится на 2-м месте после ишемической болезни сердца по числу лет инвалидности среди населения США [3]. Результаты наблюдательного исследования показали, что за 20 лет смертность от ХОБЛ среди женщин в США увеличилась более чем в 2 раза [4], а расходы на лечение обострений ХОБЛ составляют от 50 до 75% затрат, связанных с заболеванием [5].
ХОБЛ, согласно определению ATS (American Thoracic Society) и ERS (European Respiratory Society), – это предотвратимое заболевание, которое характеризуется частично обратимым ограничением воздушного потока [6]. Обычно заболевание имеет прогрессирующее течение и обусловлено хроническим воспалением в малых дыхательных путях, деструкцией паренхимы легких с формированием эмфиземы, которая имеет разную выраженность и значительно варьируется у пациентов с ХОБЛ [1]. Курение – наиболее известный и изученный фактор развития болезни [7], но все больше научных фактов свидетельствуют о других значимых причинах, например о воздействии биоорганического топлива выхлопных газов или дефицит a1-антитрипсина. Для большинства пациентов ХОБЛ представляет собой легочный компонент хронической полиорганной патологии, которая чаще всего встречается в пожилом возрасте и связана с множеством факторов риска, таких как курение, загрязнение окружающей среды, возраст, снижение физической активности и диета [8].
Диагноз ХОБЛ впервые можно заподозрить, если пациент предъявляет жалобы на кашель с отделением мокроты, одышку или рецидивирующие инфекции нижних дыхательных путей [9] при наличии таких факторов риска, как воздействие табачного дыма, влияние поллютантов окружающей среды, профессиональных факторов. Тщательное изучение анамнеза позволяет убедиться, что симптомы вызваны именно ХОБЛ, а не другими заболеваниями, например хронической сердечной недостаточностью (ХСН). Объективный осмотр дает возможность выявить респираторные и системные проявления болезни. На ранней стадии заболевания явных отклонений от нормы может не быть. При прогрессировании ХОБЛ выявляются ослабленное дыхание, удлинение выдоха, признаки гиперинфляции и потеря массы тела. Для выявления патологических изменений необходимо определять частоту дыхания (ЧД), сатурацию кислорода крови в покое и после нагрузки, рост, массу тела больного, индекс массы тела (ИМТ), обращать внимание на наличие цианоза, одышки по шкале mMRC (Modified Medical Research Council). Функциональное состояние пациента оценивается с использованием 6-минутного шагового теста (6-МШТ). Нагрузочные тесты помогают прогнозировать риск смертности для больных ХОБЛ [10]. При первичной постановке диагноза проводится рентгенография грудной клетки для исключения других заболеваний легких, которые могут вызывать похожие респираторные симптомы. Компьютерная томография (КТ) грудной клетки помогает определить уровень эмфиземы у пациента, толщину стенок бронхов и воздушные ловушки. Хотя в разных исследованиях эти данные интерпретируются по-разному [11, 12]. Дополнительным преимуществом КТ сканирования является возможность дифференцировать структурные изменения легких, вызывающие ограничение воздушного потока (например, эмфизема, бронхиолит, бронхоэктазы). КТ позволяет определить другие изменения, которые характеризуют фенотипы заболевания, и в конечном итоге выявить сопутствующую легочную (например, рак легкого, интерстициальное заболевание легких, легочную гипертензию) и внелегочную патологию (например, ХСН, кальцинацию коронарных артерий, заболевания средостения и плевры) [13]. При первичной постановке диагноза ХОБЛ необходимо провести спирометрию и подтвердить наличие частично обратимого ограничения воздушного потока, что отражается в снижении ОФВ1 (объем форсированного выдоха за 1-ю секунду)/ФЖЕЛ (форсированная жизненная емкость легких)<0,7 [6].
Если рассматривать классическое описание фенотипов ХОБЛ («розовые пыхтельщики» и «синие отечники»), то статистический анализ [14, 15] показывает, что именно масса тела и состав тела являются основными чертами фенотипов (характеризуют различия фенотипов) и предикторами исходов заболевания независимо от степени снижения легочной функции. Совместная оценка состава тела и питания служит важным шагом к пониманию патофизиологии системного характера заболевания и влияния питания на течение заболевания. Если первоначально считалось, что потеря массы тела – это адаптивный механизм к снижению метаболизма у пациентов с терминальной стадией ХОБЛ, то в настоящее время непреднамеренная потеря массы тела расценивается как детерминанта снижения выживаемости [16]. Появляется все больше новых данных, согласно которым важное влияние на снижение мышечной выносливости имеет уменьшение мышечной массы и уровня метаболизма в мышечных клетках.
C.J. Murray et al. в 2013 г. опубликовали результаты оценки влияния различных факторов риска на течение основных ивалидизиующих заболеваний за 2010 г. по сравнению с 1990 г.
Значение многих факторов риска изменилось за 20 лет. В 1990 г. лидирующим фактором риска инвалидности была низкая масса тела в детстве, в 2010 г. этот фактор отодвинулся на 8-е место. Влияние домашних аэрополютантов на продолжительность инвалидности сместилось со 2-го на 3-е место, дефицит витамина А – с 17-го на 29-е. При этом более чем на 30% возросло значение других причин инвалидности. Сюда относятся ожирение (высокий ИМТ), высокий уровень глюкозы натощак, диета с высоким содержанием натрия, диета с низким содержанием цельнозерновых культур, воздействие свинца. Перечень лидирующих факторов риска инвалидности включает многие диетические компоненты, каждый из которых изучается отдельно. Если учитывать в совокупности влияние всех компонентов диеты и снижение физической активности как факторы риска продолжительности инвалидности, то это составляет 10,2% от всех факторов риска. Что касается курения, то этот фактор занимает твердые позиции и составляет 6,3%, поскольку число курящих уменьшается в развитых странах и растет в развивающихся [3]. Вышесказанное диктует необходимость определенной диетической поддержки пациентов с ХОБЛ в дополнение к физическим упражнениям, причем не только при тяжелых проявлениях заболевания, но и на ранних стадиях развития болезни. Последние исследования свидетельствуют, что остеопороз, висцеральное ожирение и низкое качество питания у больных ХОБЛ повышает риск прогрессирования заболевания, поэтому создание и использование диетических рекомендаций должны иметь место в реабилитационных программах для пациентов с ХОБЛ.
В клинической практике широко используется измерение массы тела и ИМТ, но ИМТ не учитывает жировую и тощую массу тела, плотность костной ткани, хотя это имеет большое значение для оценки прогноза заболевания и риска развития осложнений.
В исследованиях показано, что у пациентов с саркопенией, кахексией (индекс безжировой массы тела – БМТ<17кг/м2 у мужчин и <15 кг/м2 у женщин) и прекахексией, когда происходит непроизвольное снижение массы тела >5% за 6 месяцев, повышается риск смертности и нарушается физическая работоспособность, при этом у больных ХОБЛ с ожирением возникает риск кардиоваскулярных осложнений [17, 18].
Роль нутритивного статуса в системном воспалении
Известно, что дисбаланс между оксидантами и антиоксидантами играет существенную роль в патогенезе ХОБЛ, а сигаретный дым содержит оксиданты, которые, способствуя образованию свободных радикалов кислорода, повреждают клеточные липиды, протеины и нуклеиновые кислоты [19]. Свободные радикалы участвуют в патогенезе ХОБЛ благодаря способности индуцировать оксидативную инактивацию антипротеиназ, повреждать ткань, разрушать нейтрофилы и запускать синтез медиаторов воспаления. Установлено, что 15–20% курящих болеют ХОБЛ и только различия в числе употребляемых сигарет не могут объяснить наблюдаемые международные различия в смертности от ХОБЛ [20]. В то время как индивидуальная восприимчивость у курильщиков почти наверняка имеет генетический компонент. Недавние исследования установили защитные эффекты некоторых пищевых антиоксидантных витаминов и сопутствующих факторов.
В 2015 г. китайские ученые провели мета-анализ эпидемиологических исследований, посвященных распространенности ХОБЛ, размещенный в электронных базах MEDLINE и EBSCO с января 1990 по июнь 2015 г.
В мета-анализе акцент был сделан на таких ключевых словах, как диета, диетический паттерн, диетические привычки, пищевой паттерн, ХОБЛ. Авторы проанализировали 427 исследований, из них 13 соответствовали критериям включения в мета-анализ, в которых содержались данные о взаимосвязи диетических паттернов питания и риска развития ХОБЛ. Показана связь между диетическими особенностями и риском развития ХОБЛ. Результаты анализа данных исследований свидетельствуют, что «здоровая» диета способна снижать риск развития ХОБЛ. «Здоровая» диета заключается в употреблении массы овощей, фруктов, диетических волокон, рыбы, а употребление копченого и красного мяса, десертов, очищенного зерна служит потенциальным риском развития ХОБЛ [21].
Связь между паттерном здоровой диеты и ХОБЛ представлена на рис. 1 и отражает результаты мета-анализа с использованием модели случайной статистической выборки. Получены достоверные данные о снижении риска ХОБЛ при высокой приверженности здоровой пище по сравнению с категорией лиц, употребляющих здоровую пищу в минимальном объеме.
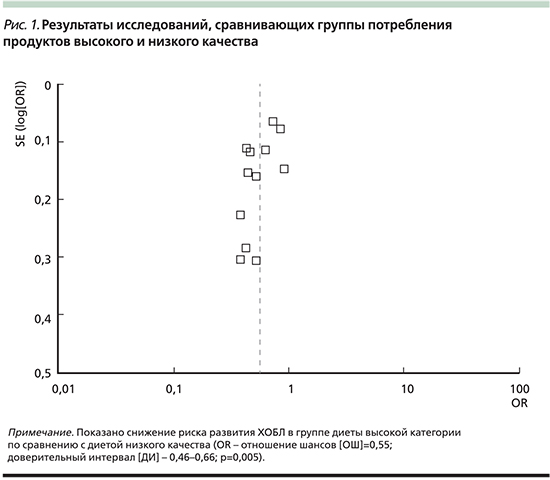
Так называемая нездоровая (западная) диета характеризуется высоким потреблением всех видов красного и/или обработанного мяса, очищенного зерна, сладостей, десертов и картофеля фри. На рис. 2 показана связь между паттерном «нездоровой» (западной) диеты и риском ХОБЛ. Риск развития ХОБЛ выше у лиц с максимальным употреблением «нездоровой» пищи по сравнению с группой минимального использования «западной» диеты.
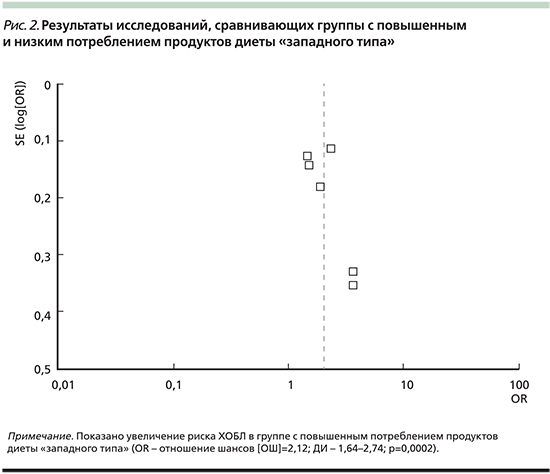
Полученные данные свидетельствуют, что диетический паттерн служит важным фактором профилактики развития ХОБЛ. Потенциальный защитный эффект овощей и фруктов, возможно, связан с высокой концентрацией антиоксидантов (например, витаминов С, Е и других каротиноидов), а также витамина А [22]. В других исследованиях авторы предполагают, что витамин Е не только защищает полиненасыщенные жирные кислоты в клеточных мембранах от оксидативного повреждения, но и представляет основную антиоксидантную защиту мембран от повреждения [23]. При детальной оценке показано, что большее употребление диетических волокон ассоциируется со снижением риска ХОБЛ [24].
Хотя механизм связи между содержанием продуктов питания и риском ХОБЛ неясен, значение пищевых волокон может быть связано с их противовоспалительным и антиоксидантным действием [25]. Более ранние исследования предполагали, что употребление диетических волокон снижает уровень С-реактивного белка [26]. Кроме того, диетические волокна могут модулировать воспаление путем замедления всасывания глюкозы, снижая окисление липидов или повышая продукцию противовоспалительных цитокинов, оказывая влияние на формирование кишечной флоры [27]. Более того, некоторые исследования показали, что пищевые волокна, особенно водорастворимые (получаемые преимущественно из фруктов и овощей), также могут замедлить абсорбцию крахмала, при этом снижая сахарную нагрузку и, следовательно, предотвращая гиперинсулинемию [28], которая в свою очередь повышает риск развития ХОБЛ [29]. «Нездоровая» западная диета способствует повышению риска развития ХОБЛ. Это заключение соответствует предыдущим данным, свидетельствующим, что употребление красного обработанного мяса связано с повышенным риском ХОБЛ [30]. Этому есть несколько возможных объяснений. Во-первых, копченое или жареное мясо часто содержит массу нитратов, нитритов и нитрозаминов. Нитриты образуют реактивные нитрогенные соединения, которые могут усиливать воспалительный процесс в дыхательных путях и легочной паренхиме, вызывая повреждение ДНК, ингибируя митохондриальное дыхание, вызывая выработку нитротирозина и NO-зависимого оксидативного стресса, прогрессирование повреждения легочной функции [31]. Во-вторых, некоторые продукты (такие, как определенные зерновые или десерты) имеют высокий гликемический индекс. Предыдущие исследования показали, что гипергликемия связана с нарушением легочной функции – основным критерием ХОБЛ [32]. Результаты исследований подчеркивают важность изменения диеты для первичной профилактики ХОБЛ. Сегодня быстро меняются привычки в питании во всем мире, хотя распространенность неинфекционных заболеваний, включая гипертоническую болезнь, сахарный диабет (болезни, которые связаны с диетой), быстро растет. Это диктует необходимость дальнейших исследований зависимости неинфекционных заболеваний от различных паттернов питания.
Фенотипы ХОБЛ и биомаркеры воспаления
В классификации G.F. Filley et al. 1968 г. пациенты с тяжелыми проявлениями ХОБЛ делятся на «розовых пыхтельщиков» (эмфизематозный фенотип) и «синюшных отечников» (бронхитический фенотип). В 2014 г. A.M. Schols et al. опубликовали статью в журнале ЕРО (Европейское респираторное общество), где данная классификация дополнена и расширена, в ней более конкретно характеризуются сопутствующая патология и системные проявления ХОБЛ [33]. Выделено 3 метаболических фенотипа ХОБЛ, отражающих влияние (эпи)генетических, легочных факторов и образа жизни на телосложение, а именно структуру мышечной, костной и жировой тканей пациента с ХОБЛ. Эти фенотипы предполагают оценку функциональных возможностей и кардиоваскулярного риска и дифференцированный подход к выбору персонализированной терапии, а также могут отражать влияние не только курения, но и иных факторов риска развития ХОБЛ. Фенотип с кахексией часто связан с эмфиземой, гиперинфляцией, потерей скелетной мышечной массы, изменением структуры мышц, остеопорозом и уменьшением жировой массы. Фенотип с ожирением связан с хроническим бронхитом, увеличением подкожного и висцерального жира, ригидностью артерий и повышением кардиоваскулярного риска. Фенотип с саркопенией и скрытым ожирением характеризуется уменьшением мышечной массы, изменением структуры мышечной ткани с функциональными нарушениями, увеличением жировой ткани, ригидностью сосудов и повышенным кардиоваскулярным риском [34].
В 2015 г. по результатам известного 3-летнего обсервационного исследования ECLIPSE (The Evaluation of COPD Longitudinally to Identify Predictive Surrogate End-points) был сделан кластерный анализ с целью определения фенотипов ХОБЛ (2164 пациента с ХОБЛ, ОФВ1 <80% к должному значению). Деление на кластеры осуществлено с использованием таких показателей, как ОФВ1, ИМТ, уровень одышки, число лейкоцитов в периферической крови, уровень фибриногена.
В результате выделено пять подгрупп пациентов с ХОБЛ с различными клиническими проявлениями и прогнозом заболевания:
- кластер A («среднетяжелые относительно стабильные») – больные с наилучшими показателями функции внешнего дыхания (среднее значение ОФВ1 – 55%) и наименьшим числом обострений за 3 года;
- кластер B («функциональная эмфизема») – пациенты с промежуточными значениями ОФВ1, умеренной эмфиземой и низким уровнем биомаркеров. В этой группе наблюдалось наиболее выраженное прогрессирование эмфиземы, но наилучшая выживаемость по сравнению с другими подгруппами, кроме кластера А;
- кластер С («системное воспаление с сопутствующей патологией») – пациенты с множественными сопутствующими заболеваниями, выраженным системным воспалением и худшим прогнозом по выживаемости среди всех фенотипов;
- кластер D («эмфизема с частыми обострениями») – пациенты с низкими показателями функции внешнего дыхания (среднее значение ОФВ1 – 38%), выраженной эмфиземой и частыми обострениями;
- кластер E («смешанный») – наиболее гетерогенная группа, самая большая по численности (n=1117 человек) [35].
ХОБЛ характеризуется как гетерогенное заболевание с различными проявлениями, которые включают системное воспаление, мышечную дисфункцию и кардиоваскулярные заболевания [36]. Основой для постановки диагноза ХОБЛ служат спирометрические показатели, в частности модифицированный индекс Тиффно менее 70% от должного значения и ОФВ1, который используется для определения степени тяжести ХОБЛ. Как обструктивные нарушения, так и другие проявления ХОБЛ являются результатом системного воспалительного процесса, поэтому особое значение имеет изучение биомаркеров, которые отражают патогенетические процессы, лежащие в основе формирования разных фенотипов ХОБЛ, и, возможно, ответ пациентов на терапию [37].
Для выявления значения различных продуктов обмена в развитии болезни необходимо изучать метаболом больных ХОБЛ. Метаболом представляет собой совокупность всех низкомолекулярных метаболитов с массой <1500 Da, являющихся конечным продуктом обмена веществ в клетке, ткани, органе или организме [38]. В 2012 г. опубликованы результаты изучения метаболома в рамках исследования ECLIPSE.
У пациентов с ХОБЛ и соответствующих им по полу, возрасту и статусу курения лиц контрольной группы (всего n=244) осуществлен анализ сыворотки крови с помощью протонного ядерно-магнитного резонанса (ПЯМР). Для подтверждения полученных результатов использована жидкая хроматография и тандемная масс-спектрометрия. Контрольная группа составила 66 человек, пациенты с ХОБЛ II стадии – 70 человек, III стадии – 64 и IV стадии – 44 человека.
Особое внимание направлено на определение изменений состава аминокислот в сыворотке крови у пациентов с ХОБЛ, причем исследовалась сыворотка только у бывших курильщиков, чтобы исключить влияние активного табакокурения на метаболом. Метаболические показатели пациентов с ХОБЛ сравнивались с данными курильщиков, бывших курильщиков и никогда не куривших здоровых лиц.
В отношении пациентов с ХОБЛ в данной группе кроме критериев диагноза ХОБЛ учитывалось наличие и отсутствие эмфиземы. Метаболический профиль всех пациентов с ХОБЛ по сравнению с контрольной группой свидетельствовал о недостаточном поступлении с пищей определенных компонентов. Результаты исследования показали снижение уровня липопротеидов очень низкой плотности (ЛПОНП), липопротеидов низкой плотности (ЛПНП) и хиломикрон в сыворотке крови, повышенное использование кетонов как альтернативного источника энергии (3-гидроксибутират) и снижение ацетилированных гликопротеинов, которые являются продуктом белкового синтеза.
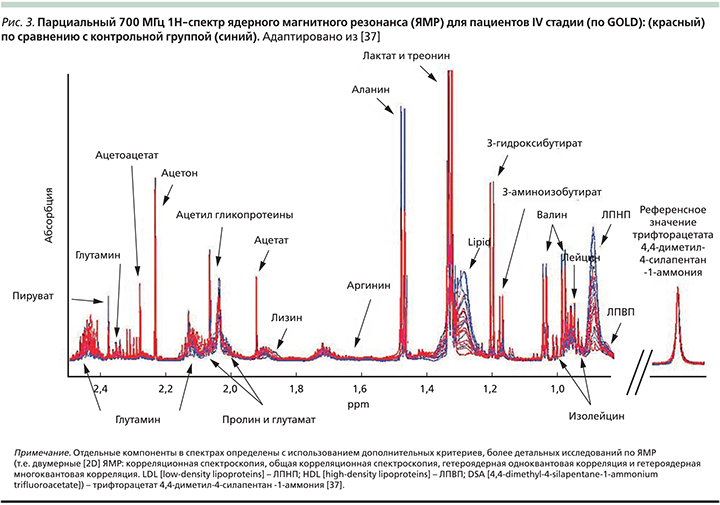
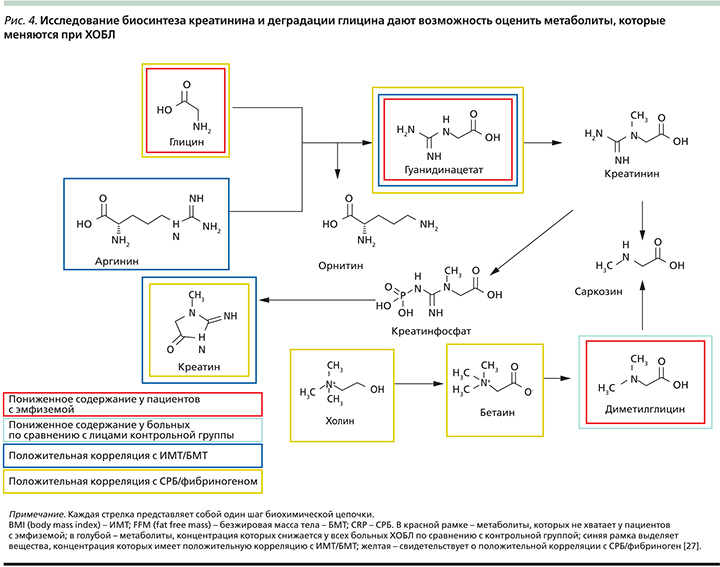
У всех больных ХОБЛ был повышен уровень сывороточного метилгистидина – аминокислоты, которая образуется при построении мышечного белка, это предполагает повышенную деградацию мышечного актина и миозина [39] даже у больных без клинических признаков кахексии. У больных ХОБЛ крайне тяжелой степени (IV стадии GOLD) значительно повышается деградация мышечных протеинов (3-метилгистидина) и утилизация аминокислот с разветвленными боковыми цепями BCAA (branched-chain amino acids) – альтернативного источника энергии для мышц и жировой ткани. Также у этих пациентов по сравнению с контрольной группой снижались уровни 3-гидроксибутирата, изобутирата, липопротеидов высокой плотности (ЛПВП). У больных эмфиземой выявлено нарушение синтеза креатинина и деградация глицина. У пациентов с высоким уровнем С-реактивного белка (СРБ), т.е. явлениями системного воспаления, также была повышена деградация мышечного протеина (3-метилгистидина) и утилизация BCAA (рис. 3).
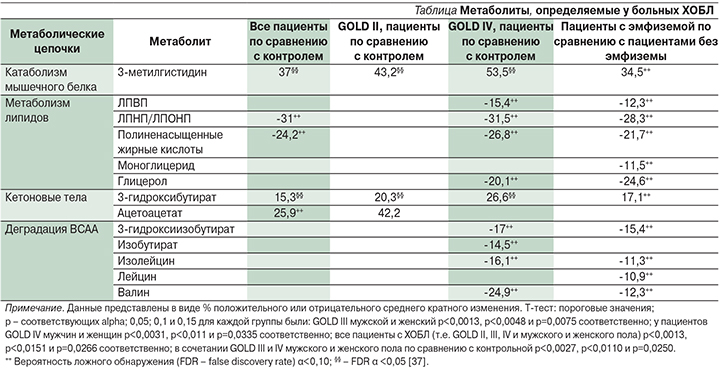
Метаболиты, существенно отличающие всех больных ХОБЛ и больных III и IV стадий (GOLD) от контрольной группы, а также пациентов с эмфиземой и без эмфиземы, представлены в таблице.
Скелетная мускулатура непрерывно обеспечивается BCAA из сыворотки крови, тем самым происходит регуляция обмена протеинов и уровня глюкозы в организме. Она продуцирует 90% общего глутамина [39], который в свою очередь является источником для пролиферации иммунореактивных клеток [40] В период голодания мышечный протеолиз и переаминирование BCAA обеспечивают поступление молекул углерода для глюконеогенеза. У пациентов с кахексией повышен уровень глюконеогенеза, который не блокируется поступлением глюкозы [41]. В исследовании ECLIPSE получена корреляция между уровнем BCAA и ИМТ. Таким образом, изменение уровня BCAA может быть проявлением физиологического ответа на снижение массы тела.
Приблизительно 25% пациентов с ХОБЛ страдают кахексией, что ассоциируется с неблагоприятным прогнозом [42]. Кахексия характеризуется снижением уровня BCAA в организме вследствие часто возникающей анорексии у больных ХОБЛ и недостаточного употребления белковой пищи, что сопровождается повышенным окислением BCAA и глюконеогенезом. Происходит деградация белка для повышения уровня BCAA в сыворотке, при этом образуются глюкогенные аминокислоты, которые участвуют в глюконеогенезе. В исследовании ECLIPSE метаболиты, которые имели сильную корреляцию с маркерами кахексии, также коррелировали с маркерами системного воспаления. В исследованиях показано, что при недостаточном употреблении пищи, при голодании повышается катаболизм белков с кратковременным повышением BCAA в сыворотке [43]. Через несколько недель уровень деградации мышечного белка снижается, а следовательно, снижается уровень BCAA в сыворотке, при этом повышается продукция кетоновых тел. Изучение метаболома больных ХОБЛ демонстрирует повышение уровня кетоновых тел и снижение BCAA, а у пациентов с эмфиземой также снижались уровни креатинина сыворотки, глицина, гуанидина ацетата и диметилглицина (рис. 4). По полученным данным высказывается предположение, будто у больных ХОБЛ снижается функциональная активность митохондрий скелетных мышц. Это соответствует результатам других исследований, которые свидетельствуют о том, что уже на ранних стадиях ХОБЛ нарушается цепь переноса электронов в митохондриях скелетных мышц и происходит избыточное образование активных форм кислорода [44].
Заключение
Таким образом, в исследовании показано, что изучение метаболома у пациентов с ХОБЛ дает дополнительную информацию о фенотипах ХОБЛ, поскольку метаболические факторы влияют как на функцию легких, так и на системные проявления заболевания. Наиболее значимо для всех больных ХОБЛ активное использование белка в метаболических процессах, при этом у пациентов с эмфиземой и кахексией происходит повышенная деградация белковых структур мышечной ткани. Сниженный ИМТ у больных коррелирует с недостаточным питанием данных пациентов, при этом в митохондриях происходит нарушение окислительных процессов, что подтверждается корреляцией повышенного образования кетоновых тел и клинических параметров. Комбинации таких метаболитов, как BCAA, метилгистидин, фенилаланин, ацетилированный гликопротеин, 3-гидроксипируват и т.д., в дальнейшем могут дать возможность стратифицировать больных ХОБЛ по уровню белкового обмена, функционального состояния митохондрий и статусу питания [44].


