Введение
Неалкогольная жировая болезнь печени (НАЖБП) на протяжении последних десятилетий занимает лидирующие позиции по распространенности среди диффузных заболеваний печени [1]. Чаще всего НАЖБП имеет доброкачественный характер, однако с жировой дистрофией печени ассоциированы воспалительные процессы в гепатоцитах с развитием неалкогольного стеатогепатита (20–30%) и в последующем – фиброза [2, 3]. Скорость наступления необратимых фиброзных трансформаций при НАЖБП меньше по сравнению с другими хроническими заболеваниями печени, такими как токсические (алкогольные) или вирусные, но в связи с высокой распространенностью данной патологии декомпенсированные циррозы печени в исходе этой проблемы являются третьими среди причин трансплантации печени в ряде стран [4–6]. Кроме того, пациенты с НАЖБП имеют высокий риск ранних сердечно-сосудистых заболеваний и смертности [7]. Вызывает беспокойство, что до 50% случаев НАЖБП-ассоциированных гепатоцеллюлярных карцином могут возникать в отсутствие цирроза, что ухудшает прогноз [8].
К настоящему времени опубликованы многочисленные работы, посвященные элементам многофакторного патогенеза НАЖБП: изменениям липидного обмена, митохондриальной дисфункции, паренхиматозному воспалению, оксидативному стрессу, роли кишечной микробиоты в патологическом процессе. Большое внимание уделяется вопросам молекулярных механизмов трансформации стеатоза в стеатогепатит, роли окислительного стресса как одного из важных звеньев патогенеза хронических заболеваний печени и поиску генов-кандидатов, потенциально ассоциированных с процессом развития стеатоза печени [9–12].
Аспекты модификации гепатоцитарного липидного обмена при НАЖБП
НАЖБП – состояние, при котором гепатоциты, обычно удерживающие только небольшое количество липидов, содержат сверхфизиологическое количество жира вследствие дисбаланса между процессами окисления и удаления липидов и превышающими их процессами поглощения и синтеза жиров [13, 14]. В исследованиях C. D. De et al. (1995) было установлено, что при стеатозе печени происходит повышенное окисление жира микро- и пероксисомами [15], увеличивается интенсивность как окисления липидов, так и цикла трикарбоновых кислот, тогда как кетогенез не модифицируется. Все это позволяет предположить, что гепатоциты пытаются противодействовать избытку липидов за счет усиления окисления [16]. Накопление в печени насыщенных жирных кислот (ЖК) может также способствовать редокс-дисбалансу и образованию активных интермедиатов кислорода, главным образом вызывая стресс и апоптоз эндоплазматического ретикулума [17]. Реактивные формы кислорода (ROS) в настоящее время рассматриваются в качестве регуляторов метаболизма липидов печени в физиологических и патологических условиях. Несмотря на то что ROS и реактивные формы азота образуются вследствие обычного метаболизма, при заболеваниях печени отмечается повышенная продукция свободных радикалов, превышающая защитный порог печеночных клеток и индуцирующая их гибель [18].
Известно, что печень играет центральную роль на всех этапах метаболизма липидов, включая липогенез посредством конверсии избыточных углеводов; окисление ЖК; метаболизм холестерина и фосфолипидов. Так как некоторые данные свидетельствуют, что увеличение уровней ROS индуцирует различные сигнальные пути, которые могут являться триггерами инсулинорезистентности, редокс-контроль может включаться при раннем развитии жирового гепатоза [19].
Контроль липидного обмена осуществляется сетью ядерных рецепторов, которые реагируют на несколько лигандов, регулируя экспрессию ферментов, участвующих в липогенезе или липоксидации печени [20]. Несколько эндогенных и экзогенных липидов, таких как холестерин или ЖК, действуют как физиологические лиганды ядерных рецепторов, которые в связи с этим можно рассматривать как «липостаты», поскольку их активация часто способствует метаболизму/катаболизму соответствующих лигандов и/или обеспечивает отрицательную обратную связь для самопрекращения синтеза [21].
Среди различных ядерных рецепторов, участвующих в физиологической регуляции метаболизма липидов и патологической модуляции свободными радикалами при стеатозе печени, важная роль отводится рецепторам, активируемым пролифераторами пероксисом-α/-γ/-δ (PPAR α/γ/δ). Особенно актуален для печеночной паренхимы PPAR-α, который регулирует гены, ответственные за захват и окисление ЖК, гены, отвечающие за липидный гомеостаз макрофагов, таким образом опосредуя баланс между клеточными ЖК и метаболизмом глюкозы, предотвращая накопление липидов в печени и играя протективную роль в патогенезе неалкогольного стеатогепатита. Активированные ЖК рецепторы PPAR регулируют метаболизм липидов в печени и других органах (PPARα), запасание жира в жировой ткани (PPARγ) [22]. Активация PPARα стимулирует экспрессию аполипопротеина АV и подавляет экспрессию аполипопротеина СIII печенью, что приводит к снижению уровней триглицеридов в хиломикронах и липопротеидов очень низкой плотности, высвобождению ЖК, которые захватываются и накапливаются в адипоцитах или метаболизируются в скелетных мышцах [23]. Несмотря на многочисленные исследования, нет полной ясности в вопросе, каким образом снижение активности PPAR может оказывать влияние на метаболизм и вероятность НАЖБП, что требует дальнейшего исследовательского поиска.
Роль полиморфизмов некоторых генов-кандидатов НАЖБП
Полагают, что разобщение окисления и фосфорилирования в митохондриях ассоциируется с контролем массы тела и жироотложения, в т.ч. и в гепатоцитах. Семейство митохондриальных разобщающих белков (UCP – uncoupling proteins) является членом семейства белков – носителей митохондриального аниона (MACP) и активно исследуется в последние 10–15 лет. Полагают, что белки UCP2, UCP3 и, возможно, другие разобщающие белки выполняют роль метаболического триггера, присутствие которого в митохондриальной мембране позволяет переключать метаболизм с углеводного на преимущественно жировой [24]. Ген UCP1 (термогенин) экспрессируется главным образом в бурой жировой ткани, однако при определенных условиях данный ген экспрессируется и в скелетных мышцах, белой жировой ткани и в β-клетках поджелудочной железы [25]. В последние годы активное внимание уделяется возможному участию белков UCP2 и UCP3 в патогенезе метаболических заболеваний, включая НАЖБП. Данные современной литературы об участии генов разобщающих белков, как UCP2, так и UCP3, в патогенезе НАЖБП противоречивы.
Белок UCP2 обнаруживается в скелетных мышцах, белой жировой ткани, легких и почках, а также в сердце и центральной нервной системе. Белок UCP2 расположен на внутренней мембране митохондрий и выступает в роли медиатора протонной утечки, что в конечном итоге приводит к уменьшению производства АТФ и высвобождению энергии. Ранее сообщалось о связи полиморфизма гена -866G >A UCP2 (rs659366) с ожирением и диабетом 2 типа. Основные полиморфизмы гена UCP2 составляют -866G>A (rs659366), 55 Ala/Val (rs660339). Помимо этого встречаются сведения о влиянии высокой экспрессии UCP2 на контроль продукции митохондриального супероксида, снижая таким образом активность перекисного окисления липидов (ПОЛ). Поэтому UCP2 может быть терапевтической мишенью для лечения окислительного повреждения и метаболического дисбаланса при НАЖБП [26].
Экспрессия UCP3 ограничена главным образом скелетными мышцами [27]. Ряд полиморфизмов был идентифицирован в гене UPC3. В частности, полиморфизм -55C/T отвечает за уровни м-РНК UPC3 и прирост массы тела. Например, по данным исследований, среди тучных индонезийских детей испытуемые с генотипами T/T UPC3 продемонстрировали более низкие общие затраты энергии, чем те, у которых были другие генотипы. Но не было подтверждено увеличение риска, связанного с вариантом rs1800849 с развитием НАЖБП [28]. Однако недавние исследования показывают, что основная роль белка UCP3 заключается в метаболизме ЖК и, возможно, в защите митохондрий от индуцированного липидами повреждения 10 за счет снижения продукции митохондриальных реактивных форм кислорода (ROS) [29].
Экспрессия генов UPC3 и UCP2, несомненно, оказывает влияние на увеличение скорости метаболизма. Однако остается спорным ассоциация таковых полиморфизмов с прогрессированием НАЖБП и это диктует необходимость проведения дополнительных исследований, позволяющих выявлять или опровергать потенциальные роли полиморфизмов UCP3 и UCP2 в патогенезе НАЖБП.
Роль полиморфизмов некоторых генов антиоксидантной защиты при НАЖБП
Антиоксидантные защитные механизмы в печени включают химические вещества, такие как глутатион (GSH), витамины C и E, и ферменты супероксиддисмутазы (SOD), каталаза (CAT), глутатионпероксидаза (GPX), глутатион S-трансфераза (GST), глутатионредуктазу (GRx), пероксиредоксины и тиоредоксины [30]. Система генов GST играет важную роль в процессах обеспечения и поддержания нормальной жизнедеятельности всех живых организмов. Это связано прежде всего с тем, что гены, входящие в состав данной системы, кодируют ферменты, катализирующие различные типы химических превращений в клетке. Именно данная система генов играет первостепенную роль, принимая участие во второй фазе детоксикации (обезвреживания) ксенобиотиков и в защите клеток против окислительного стресса [31].
В отчетах исследований последних лет сообщается также о тенденции к росту экспрессии м-РНК GST A1 и P1 в процессе прогрессирования НАЖБП. Индукция м-РНК GST P1 ранее была признана маркером гепатоцеллюлярного канцерогенеза у крыс, но может быть связана с гепатоцеллюлярной карциномой у людей и, вероятно, может быть предиктором предрасположенности к гепатоцеллюлярной карциноме [32].
Мнения ученых о процессах трансформации системы антиоксидантной защиты в печени при НАЖБП на сегодняшний день противоречивы. Показано, что содержание GSH в печени и активность SOD снижены у пациентов со стеатозом печени и еще более снижены у больных стеатогепатитом [33]. Исследование на животных (мышах fa/fa, получавших диету с высоким содержанием жиров) подтвердило снижение уровня GSH в печени, а также снижение активности GRx, GPX, SOD и CAT [34].
Напротив, в ряде исследований выявлялось, что активность Cu2+/Zn2+-SOD, CAT и GPX заметно повышена в печени пациентов с НАЖБП, так же как экспрессия гена SOD и CAT [35, 36]. Активность марганец-зависимой SOD (MnSOD) защищает от ROS детоксикационными супероксидами в кислород и пероксид водорода, увеличение содержания которых способствует более высокому окислительному стрессу при НАЖБП. В японской популяции у пациентов с НАСГ общий вариант гена 1183T/T MnSOD приводил к замещению аминокислот в сигнальной последовательности, нацеленной на фермент в митохондриях, что ослабляет способность MnSOD, способствуя уменьшению MnSOD и увеличению кислородных радикалов в митохондриях, в конечном итоге формируя гепатоцеллюлярное повреждение [37].
Другой полиморфизм, MnSOD (C47T, rs4880), был исследован как возможный ассоциативный фактор при НАСГ и фиброзе, поскольку белковый импорт в митохондриях уменьшался при таких вариантах гена. Отмечено, что концентрация MnSOD снижается у мужчин с НАЖБП, но не у женщин, возможно из-за различий в уровнях половых гормонов. Таким образом, низкий уровень MnSOD обеспечивает восприимчивость пациентов мужского пола к увеличению окислительного стресса и бóльшую вероятность прогрессирования заболевания [38].
Исследование показателей антиоксидантной системы и полиморфизма генов GSTA, GSTР, SOD2, PPARα, UCP2 и UCP3 у пациентов с НАЖБП
Первые ступени НАЖБП представляются изменениями гепатоцеллюлярного редокс-статуса, которые приводят к нарушенной регуляции метаболизма липидов. С другой стороны, изменения липидного обмена модифицируют окислительно-восстановительные процессы гепатоцита, приводя к митохондриальной дисфункции, инсулинорезистентности, накоплению жира, еще более усиливая повреждение печени. Молекулярные механизмы, лежащие в основе этих изменений, до конца не понятны, но, вероятно, включают редокс-модификацию активности и экспрессии ферментов, модуляцию посттрансляции и активации ядерных рецепторов с последующим изменением метаболической сети и ослаблением системы антиоксидантной защиты гепатоцеллюлярного матрикса. Специфические генетические изменения и мутации различных генов могут приводить к усиленному синтезу и поглощению липидов и/или снижению β-окисления свободных ЖК и накоплению триглицеридов. В свою очередь постоянное состояние увеличения ROS вызывает экспрессию антиоксидантных генов посредством активации элемента антиоксидантного ответа [39].
Цель нашего исследования:
- Оценить показатели антиоксидантной системы (АОС) у пациентов с НАЖБП: активность SOD, CAT, GST; общий антиоксидантный статус и показатели ПОЛ.
- Определить частоту полиморфизмов генов GSTA, GSTР, SOD2, PPARα, UCP2 и UCP3 у пациентов с НАЖБП.
Методы
Проведено одномоментное проспективное обсервационное аналитическое (случай–контроль). Путем сплошной выборки в исследование были включены 67 пациентов с верифицированной НАЖБП, сформирована основная группа исследования (группа 1). Диагноз НАЖБП устанавливался на основании результатов комплексного обследования в соответствии с существующими международными и российскими стандартами. Для достижения поставленных целей сформирована группа сравнения (группа 2) из 47 пациентов, не имевших НАЖБП и органической патологии желудочно-кишечного тракта. В исследование не включали пациентов старше 80 лет, с тяжелой коморбидной патологией; критериями исключения также стали острые гепатиты любой этиологии, хронические заболевания печени этиологии, иной, чем НАЖБП (вирусные, алкогольные, аутоимунные гепатиты и проч.).
Обследование пациентов проведено амбулаторно, а также в условиях стационара на базе клиники кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии Северо-Западного государственного медицинского университета им. И.И. Мечникова.
Все пациенты подвергались физикальному обследованию с акцентом на состояние желудочно-кишечного тракта. Выясняли жалобы, анамнез (длительность заболевания, наследственность, прием алкоголя, лекарственных препаратов, сопутствующую патологию), объективно оценивали состояние печени (размеры, однородность, плотность, край, болезненность и т.д.), проводилась оценка массы тела (ИМТ – индекс массы тела), измерение окружности талии.
Для оценки показателей антиоксидантной системы всем пациентам проведены лабораторные исследования образцов сыворотки крови, полученной из венозной крови стандартными методами. В сыворотке крови осуществлено спектрофотометрическое исследование активности общего антиоксидантного статуса и антиоксидантных ферментов: GST, ПОЛ, СОД и CAT. Определение активности выполнено с использованием наборов фирмы «Randox» согласно инструкции производителя.
Для определения частот полиморфизмов генов GSTA, GSTР, SOD2, PPARα, UCP2 и UCP3 всем участникам исследования был выполнен ПЦР-ПДРФ (полимеразная цепная реакция и полиморфизм длин рестрикционных фрагментов)-анализ. Использовали образцы ДНК, выделенные из лейкоцитов крови с помощью наборов «Проба–Рапид–Генетика» («ДНК-технология»).
ПЦР-ПДРФ-анализ генов GSTA, GSTР, SOD2, PPARA, UCP2 и UCP3 осуществлен с помощью соответствующих двухпраймерных систем (НПФ «Бигль», СПб., Россия). Для амплификации специфических фрагментов ДНК в реакционную смесь добавляли 2–3 мкл ДНК и проводили ПЦР на термоциклере «Терцик». Рестрикция синтезированных фрагментов ДНК проведена с помощью специфической для каждого однонуклеотидного генетического полиморфизма эндонуклеазы. Анализ длин рестрикционных продуктов проведен электрофоретическим разделением в 8%-ном полиакриламидном геле с последующей окраской бромистым этидием и визуализацией в проходящем ультрафиолетовом свете при помощи трансиллюминатора «ECX-20M» (Vilber Lourmat,Франция).
Все пациенты – участники исследования подписали информированное согласие, а также согласие на обработку персональных данных. Исследование одобрено локальным этическим комитетом ГБОУ ВО СЗГМУ им. И.И. Мечникова.
Группа пациентов с верифицированным диагнозом НАЖБП включала 67 пациентов, средний возраст – 46,5±11,7 года. В гендерном распределении несколько преобладали женщины – 39 (58,2%). Все пациенты страдали избыточной массой тела (среднее по группе значение ИМТ – 35,2±4,3 кг/м2).
Для решения задач, поставленных для достижения целей, сформирована группа сравнения из пациентов, не имевших НАЖБП. Всего в группу сравнения были включены 47 пациентов с синдромом раздраженного кишечника (СРК), из них – 29 (61,7%) женщин и 18 (38,3%) мужчин, средний возраст – 41,6±14,1 года. Диагноз СРК был установлен в соответствии с Римскими критериями III пересмотра. В этой группе средний ИМТ составил 22,2±3,2 кг/м2.
Для статистической обработки полученных данных была использована программа SPSS 17.0 (SPSS Inc., США). Вследствие выраженных отличий распределения вариационных рядов от нормального распределения, выявленных тестами Колмогорова–Смирнова и Фишера, для описательной статистики были выбраны медиана и квартили, а для анализа данных использованы непараметрические статистические критерии. Сравнение двух групп проведено по номинальным показателям с помощью χ2-критерия, по количественным показателям – с помощью критерия Манна–Уитни.
Результаты исследования
Результаты исследования антиоксидантного статуса в группах. В анализируемых группах при сопоставлении значений показателя общего антиоксидантного статуса у пациентов с НАЖБП и у пациентов группы сравнения статистически значимых различий не получено (Me=324,1 и Me=324,2 мкмоль/л соответственно; p=0,673), кроме того, отмечено, что данные значения были выше референтных.
Полученные результаты значений показателей общего антиоксидантного статуса, GST, CAT, СОД и ПОЛ у пациентов в обеих группах представлены в табл. 1.

Среднее значение ПОЛ в обеих исследовательских группах было выше референсного показателя. При сравнении показателей ПОЛ в группах отмечено статистически значимое увеличение среднего значения показателя у пациентов с НАЖБП (рис. 1). Показатели ПОЛ были выше референтных значений у подавляющего большинства (63; 94%) пациентов группы 1 и у большинства (32; 68,1%) пациентов группы 2.

Средние значения уровня СОД у пациентов группы 2 были снижены. Снижение показателя отмечено у 38 (56,7%) пациентов группы 1 и у 23 (48,9%) – группы 2, у других пациентов показатели были либо в пределах референтных значений, либо повышены, но достоверных различий в группах получено не было.
Уровень CAT выше референтных значений у пациентов 1-й группы диагностирован в 46 (68,7%), у пациентов 2-й группы – в 29 (61,7%) случаях. При оценке средних значений CAT также достоверных различий между группами 1 (Ме=780,4±270,4) и 2 (Ме=745,4±254,4) не было (р=0,431).
У 31 (46,3%) пациента группы 1 и у 36 (76,6%) – группы 2 показатели GST были снижены, при этом у пациентов группы 2 средние значения данного показателя снижались значительно, в то время как у пациентов группы 1 средний показатель значений GST был в пределах референсных (44,3±30,9 и 70, 36,8 соответственно, различия в группах достоверны; р<0,0004).
Результаты исследования полиморфизма генов GSTA, GSTР, SOD2, PPARA, UCP2 и UCP3 в анализируемых группах. При исследовании полиморфизма генов GSTA и GSTР статистически значимых различий между сравниваемыми группами не получено.
У пациентов обеих группа чаще выявлялся полиморфизм гена GSTA, замена аллеля С на аллель Т, что отмечено у 39 (58,2%) пациентов группы 1 и у 33 (70,2%) – группы 2 (табл. 2).

При оценке полиморфизма SOD2 и PPARα не было выявлено статистически значимых различий между исследуемыми группами. Чаще всего выявлялся гетерозиготный аллель Ala/Val гена SOD2, при этом в группе пациентов с НАЖБП – у 32 (47,8%) пациентов, в контрольной группе – у 28 (59,6%); 37 (55,2%) пациентов группы 1 чаще имели гомозиготный аллель G/G гена PPARα, при этом у 25 (53,2%) пациентов группы 2 отмечен полиморфизм гена PPARα в виде гетерозиготного аллеля G/C (табл. 3).
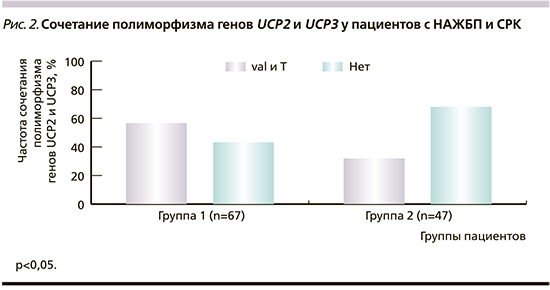
Обращает на себя внимание полиморфизм генов UCP2 и UCP3 и сочетанный полиморфизм обоих генов (табл. 4). У пациентов группы 1 полиморфизм генов UCP2 и UCP3 диагностирован в 79,1 и 65,7% случаев соответственно. У пациентов группы 2 полиморфизм гена UCP2 зарегистрирован в 57,4%, гена UCP3 – в 51,1% случаев. При этом комбинация полиморфизма генов UCP2 и UCP3 статистически значимо чаще выявлялась у пациентов группы с НАЖБП (у 38 [56,7%] пациентов) по сравнению с группой контроля – 15 (31,9%) пациентов (р<0,05; рис. 2).
Обсуждение
У пациентов с НАЖБП в данном исследовании отмечены более высокие значения показателей ПОЛ, что демонстрирует его активный статус. Полученные данные не противоречат сведениям литературы, посвященным этому вопросу, которые широко освещают роль активности ПОЛ в прогрессировании НАЖБП. Именно при усилении ПОЛ повреждаются мембраны гепатоцитов, их прогрессирующая гибель запускает воспалительную реакцию, создает предпосылки к активации фиброгенеза. На этом фоне нарастает выработка провоспалительных цитокинов, которые наряду с реактивными формами кислорода, дикарбоксильными кислотами и продуктами микросомального окисления способствуют разобщению процессов окислительного фосфорилирования, истощению митохондриальной АТФ и в конечном итоге – некрозу и апоптозу гепатоцитов. Продукты ПОЛ повышают продукцию макрофагами трансформирующего фактора роста β и продукцию коллагена, активируя звездчатые клетки, что приводит к активации фиброгенеза [40].
По многочисленным литературным данным, оксидативный стресс приводит к истощению антиоксидантных механизмов, в частности системы GSH, включающей GSH и ферменты его метаболизма: CAT, глутатионредуктазу, глутатионтрансферазу, глутатионпероксидазу. Известно, что GST – группа ферментов, ответственных за конъюгацию сульфгидрильной SH2 группы с электрофильными атомами C, N, S, O молекул ксенобиотиков. GST катализирует реакцию глутатиона с различными алифатическими, ароматическими, эпоксидными и гетероциклическими радикалами экзогенных повреждающих веществ [41]. Однако в представленном исследовании не было отмечено значимого снижения уровня GST в обследуемой группе пациентов с НАЖБП, средние значения этого показателя по группе оставались в пределах референсных значений, а сниженная активность фермента отмечена менее чем в половине случаев – у 46,3% больных. Кроме того, в группе сравнения у пациентов, не имевших НАЖБП, выявлены статистически значимо более низкие показатели активности GST. У обследуемых пациентов в обеих группах имела место высокая частота полиморфизма генов-кандидатов GSTA и GSTP (система GSH), но достоверных различий получено не было.
У обследованных нами пациентов с НАЖБП активность CAT в целом была выше нормативных значений, высокая активность фермента выявлена у большего, чем в контрольной группе, числа пациентов, но при этом не отличалась статистически значимо. Нами не было получено достоверных различий между группами по показателю активности SOD: уровень SOD отмечен в пределах референтных значений в обеих группах, но при этом снижение показателя отмечено у 38 (56,7%) пациентов группы 1 и у 23 (48,9%) – группы 2, что может указывать на более высокий уровень окислительного стресса. При оценке полиморфизма SOD2 и PPARα не были выявлены статистически значимые различия между исследуемыми группами.
Полученные в нашем исследовании данные – повышение активности ферментов антиоксидантной защиты, в частности общего антиоксидантного статуса, вероятно, можно связать с активацией защитных систем и ответным протективным «ударом» в ответ на усиление ПОЛ.
В ходе нашего исследования у пациентов с НАЖБП установлена более высокая частота мутаций гена UCP2 в виде замены аллеля ala на val и увеличение частоты комбинаций однонуклетидных полиморфизмов, касающихся наличия аллелей val и t, в генах UCP2 и UCP3. Возможно предположить, что высокая частота мутаций в генах разобщающих белков 2 и 3 ассоциирована с НАЖБП и вносит вклад в патогенез этого заболевания, вероятнее всего за счет дефектов разобщения жирных кислот, что в свою очередь способно вызывать митохондриальное повреждение, тем самым запуская порочный круг метаболических нарушений.
В результате проведенного исследования у пациентов обеих групп выявлены нарушения различных компонентов антиоксидантной системы, несмотря на это, средние показатели статистически значимо были неотличимыми. Возникает сложность оценки показателей в связи с тем, что невозможно подобрать пациентов для репрезентативной выборки одной возрастной группы, не имеющих патологии различных органов и систем.
Заключение
НАЖБП вызвана многими факторами, включающими в себя и чрезвычайно сложный патофизиологический процесс, и совместное действие множественных механизмов. Функция полиморфизмов генов, которые влияют на метаболизм ЖК, окислительный стресс и гепатофиброгенез, отражаются в каждой части патогенеза НАЖБП. Из-за сложности и ограничения исследований полиморфизма генов-кандидатов при НАЖБП большинство работ выполняется с невысокой статистической мощностью, воспроизводимостью и с наличием неоднородных по стадии заболевания изучаемых групп, что также влияет на эффективность результатов.
Более полные знания о молекулярных сигнальных путях, участвующих в патогенезе НАЖБП и способствующих прогрессированию стеатоза печени, могут открыть путь к научным стратегиям профилактики и терапии, таким как фармацевтические препараты, непосредственно нацеленные на антиоксидантную систему или действующие через ядерные рецепторы либо гены, в т.ч. разобщающих белков, а также на метаболизм ЖК. Тем не менее продолжение научного поиска в этом направлении оправданно, поскольку понимание воздействия полиморфизма генов на патогенез НАЖБП поможет определить риски заболевания и определить эффективные стратегии лечения.


