Эволюция эндокринной терапии рака молочной железы (РМЖ) насчитывает более 120 лет, с того момента как в 1896 г. G. Beatson впервые осуществил овариальную супрессию больным РМЖ путем хирургической кастрации – овариэктомии [1]. В 1939 г. P. Ulrich первым описал положительный опыт применения тестостерона двумя больными РМЖ [2]. В 1962 г. с помощью радиоактивного эстрадиола были обнаружены рецепторы к эстрагенам, позднее, в 1985 г., стали определять и рецепторы к прогестерону [3]. В 1971 г. Walpole и Cole в ходе клинических исследований впервые установили эффективность тамоксифена. В 1977 г. FDA зарегестрировала тамоксифен в качестве препарата для лечения метатстатического РМЖ, с того момента начался современный этап лекарственной терапии РМЖ.
В 1982 г. J. Klijn описал применение агонистов гонадотропин-релизинг гормона (аГнРГ) вместо овариоэктомии у женщин с метастатическим РМЖ и сохраненной менструальной функцией [4].
В настоящее время, согласно современным клиническим рекомендациям, у женщин в постменопаузе с первично операбельным РМЖ в качестве адъювантной гормональной терапии применяются селективные антиэстрогены (тамоксифен) и ингибиторы ароматазы (ИА). Механизм действия ИА состоит в том, что за счет блокировки фермента ароматазы снижается синтез эстрогенов в перефирических тканях, что приводит к повышению синтеза эстрогенов в яичниках. Следовательно, ИА противопоказаны при сохранной функции яичников и могут назначаться только больным, достигшим стойкой менопаузы, в т.ч. с помощью медикаментозной или хирургической овариальной супрессии (ОС). При назначении ИА в пременопаузе необходимо использовать их только в комбинации с ОС [6, 7].
Методы овариальной супрессии
Подавление функции яичников, или «овариальная супрессия», обычно достигается одним из трех методов: хирургическим, лучевым, лекарственным.
Термин ОС подразумевает необратимость воздействия, т.е. хирургическую кастрацию или облучение [6].
К обратимым методам подавления функции яичников относится лекарственный метод посредством применения аГнРГ, но при этом не всегда обеспечивается полное подавление функции яичников, особенно у женщин молодого возраста. Так как определение ФСГ в период лечения аГнРГ неинформативно, для подтверждения полной ОС необходимо определение эстрадиола в сыворотке крови. Прием ИА следует начинать через 6 недель после первого введения аГнРГ.
Зависимость частоты наступления аменореи от возраста и режима химиотерапии
Бесплодие после ХТ у женщин репродуктивного возраста встречается с частотой от 30 до 70%. До наступления пубертатного периода воздействие ХТ на яичники менее выражено. Широко известно, что ХТ разрушает овариальный резерв яичников, цитостатики вызывают деструкцию в ядрах клеток гранулезы, приводят к атрезии ооцита. Таким образом, подавление оогенеза с помощью аГнРГ может оказать защитное действие на фолликулогенез.
Многие исследования международного уровня доказали зависимость наступления аменории от возраста и выбора схемы ХТ. В процессе лечения женщине детородного возраста необходимо назначать надежные средства контрацепции как в период лекарственной терапии, так и в ближайший срок после ее окончания. Врачам следует предупреждать пациентов о возможном негативном влиянии лекарственного лечения на функцию яичников и фертильность. Данные о возможности сохранения фертильности с помощью аГнРГ противоречивы, поэтому до начала лечения молодым женщинам, планирующим беременность в перспективе, необходимо рекомендовать консультацию врача-репродуктолога для решения вопроса о возможных вариантах реализации детородной функции.
Самая низкая частота развития аменореи (13–15%) наблюдается у женщин моложе 40 лет, тогда как в возрасте старше 50 лет частота наступления менопаузы достигает 97% [8–10].
В недавно опубликованных результатах исследования «DATA», в которое были включены 329 пациенток с диагнозом РМЖ и установленной аменореей в результате проведения ХТ, было показано, что у 12% когорты произошло восстановление функции яичников в течение 30 месяцев после назначения гормонотерапии селективным нестероидным ИА (анастрозол) [11]. Также было отмечено, что у 5,1% пациенток с восстановленной менструальной функцией средний возраст на момент начала терапии ИА превышал 50 лет (у 25,2% пациенток, средний возраст – менее 50 лет). Также было показано, что уровень эстрадиола при приеме ИА был выше у женщин с восстановленной функцией яичников по сравнению с группой пациенток с аменореей после ХТ, которые также принимали ИА.
Исходя из данных этого исследования, следует сделать вывод, согласно которому при назначении гормональной терапии ИА необходимо определять уровни эстрадиола и ФСГ в крови, это связано с тем, что аменорея после проведения ХТ не является достаточным признаком достижения стойкой менопаузы. С учетом данных исследований, а также уровня заболеваемости РМЖ и структуры заболевания по возрасту можно предполагать, что назначение препаратов, приводящих к ОС, показано приблизительно 10% больным РМЖ [12–13].
Место аГнРГ в международных рекомендациях по сохранению фертильности у женщин со злокачественным новообразованием
Следует помнить, что задачей лечения больных ранним РМЖ в пременопаузе служит не только достижение клинического эффекта, но и сохранение фертильной функции с восстановлением исходного качества жизни по завершении адъювантной ХТ, что достижимо при применении лекарственной ОС с помощью аГнРГ: трипторелин 3,75 мг внутримышечно 1 раз в 28 дней; гозерелин 3,6 мг внутримышечно 1 раз в 28 дней; бусерелин 3,75 мг внутримышечно 1 раз в 28 дней; лейпрорелин 3,75 мг внутримышечно 1 раз в 28 дней.
По данным исследования J.M. Letourneau et al. (2012), около 47% молодых женщин, страдающих ранним РМЖ, хотели бы реализовать свою репродуктивную функцию после окончания лечения [14].
В последние годы было проведено множество крупных рандомизированных клинических исследований пациенток с РМЖ, получающих ОС с помощью аГнРГ на фоне адъювантной ХТ с целью оценки наиболее безопасной стратегии сохранения фертильной функции.
В исследовании (PROMISE-GIM6; Del Mastro L. et al., 2011) показано значительное снижение частоты развития преждевременной недостаточности яичников (ПНЯ) в группе, получавшей «ХТ+трипторелин» в течение года наблюдения после завершения курса ХТ (9 против 26%; относительный риск [OР]=0,28, 95% доверительный интервал [ДИ] – 0,14–0,59), а также при последующем длительном наблюдении (медиана – 7,3 года) [15]. Кроме того, отмечено увеличение частоты спонтанных беременностей в группе, получавших «ХТ+трипторелин».
Эта информация подтверждается данными мета-анализа 12 рандомизированных клинических исследований, опубликованного в 2015 г.: ОС с помощью аГнРГ значительно снижает риск развития преждевременной недостаточности яичников (ОР=0,36; p<0,001) и повышает число спонтанных беременностей (33 против 19; ОР=1,83; р=0,041) без негативного влияния на прогноз пациенток [16–17].
В 2016 г. изданы международные рекомендации по сохранению фертильности у женщин со злокачественным новообразованием [14]. В них была определена роль ОС с применением аГнРГ для сохранения репродуктивной функции.
При анализе 13 рандомизированных клинических исследований с применением аГнРГ во время проведения ХТ рабочей группой рекомендовано считать «ОС с использованием аГнРГ на время ХТ надежной стратегией для сохранения функции яичников и фертильности, по крайней мере у больных РМЖ, с учетом наличия новых данных, касающихся безопасности и эффективности данного метода (уровень достоверности высокий – IA)».
На прошедшем в 2017 г. конгрессе (Sаn Antonio) были представлены данные мета-анализа 5 крупных рандомизированных клинических исследований по применению аГнРГ во время ХТ больных операбельным РМЖ, которые еще раз подтвердили протективную роль овариальной супрессии с помощью аГнРГ на фоне ХТ данной категории пациенток.
Так, в группе больных, получавших аГнРГ, частота ПНЯ была ниже, чем в группе, получавшей только ХТ: 14,1 против 30,9% (OР=0,38, 95% ДИ – 0,26–0,57; p<0,001). Число спонтанных беременностей было также выше: 10,3 против 5,5% (ОР=1,83; 95% ДИ – 1,06–3,15; p=0,03).
Эффективность овариальной супрессии в адъювантном лечении
В 2005 и 2007 гг. Оксфордской группой по изучению раннего РМЖ (EBCTCG) представлено два крупных мета-анализа, которые продемонстрировали хоть и незначительный, но достоверный выигрыш при добавлении ОС к стандартным методам адъювантной терапии (ХТ±тамоксифен). Снижение риска рецидива и смерти от РМЖ оказалось наиболее значимым для женщин моложе 40 лет или с низкой вероятностью аменореи после ХТ [16].
Настоящей революцией в вопросе назначения ОС с использованием аГнРГ стали опубликованные результаты исследований «TEXT/SOFT» по определению роли ОС в адъювантной гормональной терапии РМЖ. Анализ этих результатов позволил внести изменения в ведущие клинические рекомендации (ASCO, ESMO, St. Gallen, NCCN) по лечению гормонозависимого РМЖ у женщин с сохраненной овариальной функцией [17–20]. В клинических рекомендациях «St. Gallen» 2017 г. указано, что в комбинированном анализе исследований TEXT и SOFT продемонстрировано очевидное преимущество от применения ИА эксеместана в комбинации с ОС по сравнению с комбинацией «тамоксифен+ОС», в основном с использованием трипторелина. Добавление ОС пациенткам, сохранившим менструальную функцию после ХТ, улучшает результаты по сравнению с монотерапией тамоксифеном, при этом комбинация «эксеместан+ОС» дает еще большее преимущество. Схожие выводы были сделаны экспертами и других рабочих групп.
В исследованиях TEXT и SOFT для ОС в отношении большинства пациенток использован аГнРГ трипторелин [21–22]. Исследования доказывают, что у больных гормонозависимым РМЖ с сохраненной менструальной функцией в целом достигается положительный эффект от применения комбинации «эксеместан+ОС» по сравнению с комбинацией «тамоксифен+ОС» по показателям выживаемости без признаков заболевания (91,1 против 87,3%; ОР=0,72, 95% ДИ – 0,60–0,85) и интервала без признаков РМЖ (92,8 против 88,8%). Абсолютное улучшение 5-летнего показателя интервала без признаков РМЖ при применении режима «эксеместан+ОС» достигало 15% по сравнению с тамоксифеном±ОС у больных гормонозависимым HER2-негативным РМЖ и высоким риском рецидива [23]. Добавление ОС к тамоксифену снижает риск смерти, рецидива и контралатерального рака на 22% по сравнению с монотерапией тамоксифеном (ОР=0,78, 95% ДИ – 0,62–0,98].
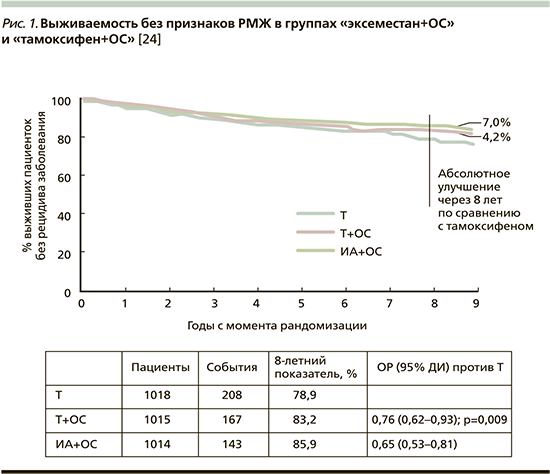
На конгрессе SABCS (2017) были представлены данные 8-летнего наблюдения в исследовании SOFT, в которых показано (рис. 1), что по сравнению с монотерапией тамоксифеном добавление трипторелина к лечению тамоксифеном или ИА снижает риск смерти, рецидива и контралатерального РМЖ на 24 и 35% соответственно [24].
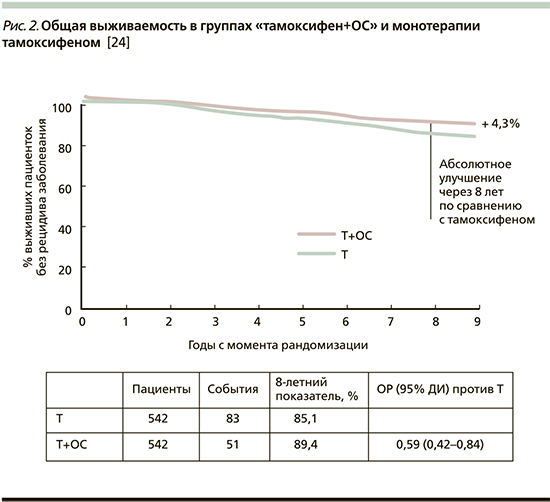
Комбинированный анализ данных исследований SOFT и TEXT показал, что уровень выживаемости без признаков заболевания был достоверно лучше в группе, получавшей комбинацию «эксеместан+ОС» по сравнению с группой «тамоксифен+ОС» независимо от возраста пациенток, хотя большая достоверность показана в группе до 50 лет [25]. На ежегодной конференции SABCS представлены и данные по общей выживаемости больных, принимавших участие в исследованиях SOFT и TEXT. Показано (рис. 2), что добавление ОС к тамоксифену ведет к снижению риска смерти на 33% по сравнению с монотерапией тамоксифеном, в подгруппе больных ER-позитивным РМЖ, получавших ХТ, – на 41% [24].
Важно отметить, что к факторам, свидетельствующим в пользу назначения ОС в комбинации с тамоксифеном или ИА больным ранним РМЖ, относятся [6, 24] пременопаузальный период, метастатическое поражение ≥4 лимфатических узлов, G3 или неблагоприятные результаты исследования мультипараметрических молекулярных маркеров, сохраняющийся пременопаузальный уровень эстрогенов после адъювантной ХТ.
При разработке плана лечения, включающего терапию аГнРГ, следует учесть, что оптимальная продолжительность подавления функции яичников должна составлять 5 лет. Женщинам в пременопаузальном периоде с вовлеченными лимфатическими узлами или другой отягчающей патологией необходимо рекомендовать продленную эндокринотерапию в течение 10 лет. Возможно рассмотреть прерывание эндокринотерапии через 18–30 месяцев лечения в целях попытки забеременеть, но только в отсутствие признаков высокого риска.
Снижение минеральной плотности костей у больных ранним РМЖ на фоне гормонотерапии в комбинации с аГнРГ
Снижение уровня эстрогенов в равной степени уменьшает минеральную плотность костей как в группе получавших ХТ до начала ОС, так и у больных без нее [26]. Добавление ОС к терапии тамоксифеном увеличивает риск развития остеопороза по сравнению с монотерапией тамоксифеном, но эта разница не столь существенна (20 и 12% соответственно) [21]. Данные исследования TEXT свидетельствуют, что частота развития остеопороза в группе «эксеместан+ОС» выше, чем в группе «тамоксифен+ОС» (38,6 и 25,2% соответственно), хотя число переломов в этих группах было схожим (6,8 и 5,2 % соответственно) [22].
По данным международных клинических рекомендаций, мониторинг и профилактику остеопороза необходимо проводить всем больным, получающим монотерапию тамоксифеном и лечение аГнРГ в комбинации с любой гормонотерапией [27–28]. Помимо остеопороза лечение тамоксифенов сопряжено с рядом других нежелательных явлений, таких как рак эндометрия и риск развития тромбоэмболии [29–30]. Необходимо отметить, что после завершения медикаментозной ОС у молодых женщин восстанавливается исходное качество жизни, нормализуется менструальный цикл, исчезают симптомы менопаузы, вызванные введением аГнРГ. Именно поэтому для женщин с операбельным гормонозависимым РМЖ и сохраненной менструальной функцией предпочтительна лекарственная адъювантная ОС с помощью аГнРГ.
Заключение
Добавление аГнРГ к терапии тамоксифеном или ИА снижает риск смерти, рецидива и контралатерального РМЖ по сравнению с монотерапией тамоксифеном больных ранним РМЖ группы высокого риска.
К факторам в пользу назначения ОС в комбинации с тамоксифеном или ИА больным ранним РМЖ относятся (объединенный анализ исследований SOFT/TEXT) метастатическое поражение ≥4 лимфатических узлов, пременопаузальный период, G3 или неблагоприятные результаты исследования мультипараметрических молекулярных маркеров, сохраняющих пременопаузальный уровень эстрогенов после адъювантной ХТ.
Необходимо отметить, что после завершении лекарственной ОС у молодых женщин нормализуется менструальный цикл, а значит, возвращается исходное качество жизни, исчезают симптомы менопаузы, вызванные введением аГнРГ.
Преимущества применения аГнРГ заключаются не только в восстановлении фертильности у молодых пациенток, но и в улучшении ее показателей по сравнению с больными, не получающими дополнительнпй терапии этими препаратам.



