Синдром Chronic widespread pain (CWP) – хроническая распространенная боль (ХРБ), являясь основным клиническим проявлением фибромиалгии (ФМ), нередко отождествляется с последней, но может возникать и при многих других патологических состояниях [1, 2]. По данным мета-анализа, распространенность ХРБ в разных странах варьируется в широком диапазоне – от 1,4% в Англии до 24% в Бразилии; в среднем составляет 9,6%. ХРБ преобладает среди женщин старше 40 лет [3]. По оценкам A.P. Marques et al., распространенность ФМ достигает 6,6% [4], следовательно, случаи ФМ занимают не менее 60% в структуре ХРБ. По данным О.Н. Стороженко и соавт., распространенность ХРБ в Екатеринбурге соответствует средним мировым показателям – 13,3% [5]. Эпидемиологические исследования в отношении ХРБ, в частности ФМ, в других регионах РФ не проводились. Сложности диагностики ХРБ обусловлены недостаточной осведомленностью врачей; отсутствием надежных объективных признаков и лабораторных маркеров заболевания; отсутствием единых стандартов, позволяющих верифицировать диагноз ХРБ.
Патогенез
В качестве основных факторов патогенеза ХРБ в настоящее время рассматривают следующие: феномен центральной и периферической сенситизации; дисфункция гипоталамо-гипофизарно-надпочечниковой и вегетативной нервных систем. Кроме того, доказано, что 48–52% случаев ФМ генетически детерминированы и обусловлены дефектом генов CCT5 и FAM173B, локализованных на 5p15.2 [6].
Феномен центральной сенситизации обусловлен повышением возбудимости нейронов в центральной нервной системе, в первую очередь в задних рогах спинного мозга в ответ на длительную периферическую ноцицептивную стимуляцию. Центральная сенситизация у пациентов с ХРБ обусловлена снижением серотонинергической и норадренергической активности. Так, при исследовании цереброспинальной жидкости (ЦСЖ) у пациентов с ФМ выявлено снижение уровня серотонина и его основного метаболита – 5-гидроксииндолуксусной кислоты, а также 3-метокси-4-гидроксифенилгликоля – активного метаболита норадреналина. Кроме того, при ФМ определяется повышенное содержание субстанции P, эндогенных опиоидов, глутамина и нейротрофических факторов в ЦСЖ, как известно, способствующих повышению возбудимости нейронов [7, 8].
Механизмы периферической сенситизации при ХРБ чрезвычайно разноо-бразны. Ноцицептивные афферентные волокна мышц представлены A-дельта и С-волокнами [9–11]. Известно, что хронические дегенеративные заболевания мышц не сопровождаются болью, в то время как воспалительные миопатии могут приводить к сенсибилизации болевых рецепторов. Гипоксия в сочетании с мышечной активностью и дефицит ферментов также могут вызывать боль. Таким образом, если ноцицепторы в глубоких тканях пациентов с ХРБ сенсибилизированы воспалительными или невоспалительными механизмами, может возникнуть гипералгезия. Механическая гипералгезия является характерной чертой т.н. тендерных точек, выявляемых при ФМ.
Локальная боль у пациентов с ХРБ часто обусловлена наличием миофасциальных триггерных точек (МТТ), которые могут быть активными или латентными. Развитие МТТ часто связывают с травмой мышечных волокон. Активные MTТ характеризуются спонтанной болью [12–14]. Признаки как активных, так и скрытых MTТ могут быть выявлены при проведении нейрофизиологического исследования (игольчатой электромиографии) в виде спонтанной биоэлектрической активности [15]. В нескольких исследованиях показано наличие массы активных МТТ у пациентов с ФМ [16, 17], а также доказана связь между числом активных МТТ и интенсивностью боли у пациентов с ФМ [18].
Исследования с использованием магнитно-резонансной спектроскопии показали, что у пациентов с ФМ наблюдаются значительно более низкие потенциал фосфорилирования и общая окислительная способность в мышцах (mm. quadriceps femori) как во время отдыха, так и при физических нагрузках [19]. У пациентов с ФМ также отмечаются значительно более низкие уровни креатинфосфокиназы и АТФ. Изменение рН мышц, связанное с ишемией, также приводит к периферической сенситизации и ХРБ [20].
У пациентов с ФМ выявлены нарушения микроциркуляции мышц [21]. Обнаружена аномальная капиллярная микроциркуляция в верхней части тела, а также в зонах тендерных точек. Эти изменения обусловлены вовлечением эндотелия капилляров [22]. Гипоксия мышечной ткани, усугубленная растяжением при мышечном сокращении, способствует активации мышечных ноцицепторов, расположенных в немиелинизированных волокнах [23].
У пациентов с ХРБ выявлено повышение уровня нейротрофинов, таких как фактор роста нервов (NGF – nerve growth factor), и нейропептидов (SP – substance p) в ЦСЖ [24]. NGF и SP не только повышают чувствительность ноцицепторов, но и связаны с воспалительной регуляцией [25]. Нейропептиды, в частности SP, могут индуцировать экспрессию цитокинов, которые в свою очередь сенсибилизируют периферические нервные окончания [26]. Повышенные уровни цитокинов (интерлейкин-1 – ИЛ-1, -6 и -8) в периферической крови и коже были зарегистрированы у пациентов с ФМ [27, 28]. Особый интерес представляет изучение ИЛ-8, поскольку он участвует в активации симпатической нервной системы [29].
Критерии диагностики
В 1977–1978 гг. H.A. Smythe и H. Moldofsky впервые описали синдром ХРБ, которую они назвали «фиброзитом». В дальнейшем термин был заменен на «фибромиалгия». В настоящее время ХРБ считают более широким, нежели ФМ, понятием – клиническим синдромом, присущим различным заболеваниям. ФМ признают самостоятельной нозологической формой (в Международной классификации болезней 10-го пересмотра она соответствует шифру M 79.7).
В 1990 г. специалисты ACR (The American College of Rheumatology) разработали рекомендации по диагностике, согласно которым ФМ определяли как боль длительностью более 3 месяцев, возникающую в левой и в правой половинах тела, выше и ниже уровня талии. Обязательная характеристика боли – локализация в области осевого скелета (в шейном отделе позвоночника или в передней части грудной клетки, или в грудном отделе позвоночника, или в пояснице). Второй диагностический критерий ФМ – возникновение боли в 11 из 18 «тендерных» точках (tender point) при надавливании на них с силой 4 кг (перечень упомянутых 18 точек доступен в статьях и справочниках). При наличии двух критериев диагноз ФМ считали верифицированным. Наличие другого доказанного заболевания не исключало такового ФМ [30, 31].
В 2010 г. ACR опубликовал новые критерии диагностики ФМ. Для диагностики ФМ предложили использовать два количественных показателя: WPI (Widespread pain index) – индекс распространенной боли, и SS (Symptom severity scale score) – шкала выраженности симптомов (см. таблицу).

Выделены симптомы, наличие которых необходимо было оценить за минувшую неделю: 1) усталость; 2) неудовлетворенность качеством сна; 3) нарушение когнитивных функций. Кроме того, был включен обширный перечень соматических симптомов, которые необходимо учитывать при оценке по шкале SS. Согласно современным рекомендациям ACR, диагноз ФМ считают доказанным, если соблюдены 3 следующих условия: 1) WPI≥7 и результат при оценке по шкале SS≥5 или WPI=3–6 и результат при оценке по шкале SS≥9; 2) симптомы сохраняются на одном и том же уровне на протяжении по крайней мере 3 месяцев; 3) не выявлено другого заболевания, наличие которого может объяснить возникновение боли [32].
В 2011 г. были модифицированы критерии диагностики ФМ, предложенные ACR в 2010 г., в результате чего был разработан опросник, при помощи которого пациент может самостоятельно производить расчет WPI и оценку по шкале SS [33].
В 2015 г. была разработана шкала PSD (Polysymptomatic distress) – ПСД (Полисимптомный дистресс), основанная на оценке количественных показателей ФМ (WPI и оценка по шкале SS). Определены категории тяжести полисимптомного дистресса: отсутствует (0–3), легкий (4–7), умеренный (8–11), тяжелый (12–19) и очень тяжелый (20–31) [34].
В 2016 г. были опубликованы результаты сравнения новых критериев ФМ, разработанных специалистами ACR, при использовании их докторами (версия ACR, 2010) и пациентами (версия ACR, 2011). Доказано, что WPI и оценка по шкале SS валидны как при врачебном осмотре, так и при самооценке пациентами [35].
Дифференциальная диагностика
Наиболее частой причиной ХРБ служит ФМ, но этот синдром может быть проявлением ряда других заболеваний, что требует проведения дифференциальной диагностики. Под маской ФМ могут протекать системные воспалительные, эндокринные, гастроэнтерологические, инфекционные, онкологические заболевания, неврологические расстройства, а также боль, вызванная применением лекарственных средств [2]. Но даже после верификации основного (ревматического, неврологического или иного) заболевания, сопровождающегося ФМ, необходимо учитывать возможность существования ассоциированной ФМ.
Клинические проявления ранних стадий системных воспалительных заболеваний (СВЗ), таких как ревматоидный артрит, системная красная волчанка, синдром Шегрена, склеродермия и анкилозирующий спондилоартрит (АСА), могут быть схожими с ФМ. Однако затем с течением времени появляются типичные клинические признаки поражения суставов и «системности» воспалительного процесса, а также регистрируются лабораторные признаки, подтверждающие основное заболевание.
Наиболее важной представляется дифференциальная диагностика ФМ и АСА, поскольку их ранние клинические проявления могут оказаться крайне схожими. Энтезит при АСА, проявляющийся в виде локальной болезненности в области прикрепления связок к костям, клинически может быть не отличим от «тендерных» точек, характерных для ФМ. Боль при АСА может напоминать ХРБ в случае, если энтезит затрагивает несколько областей. Кроме того, пациенты с АСА, как и при ФМ, могут испытывать усталость, нарушение сна и депрессию. К «красным флагам», свидетельствующим об АСА, относятся постепенное начало боли, особенно у больных моложе 45 лет, появление боли во второй половине ночи с усилением в утренние часы, утренняя скованность более часа, уменьшение боли после физических упражнений. Наличие в анамнезе псориаза, увеита или воспалительных заболеваний кишечника также свидетельствует в пользу диагноза АСА. В план обследования для верификации АСА необходимо включать магнитно-резонансную томографию позвоночника и крестцово-подвздошных сочленений, исследование уровня С-реактивного белка и человеческого лейкоцитарного антигена (HLA – Human Leukocyte Antigens) B27 [36–39].
Миофасциальный болевой синдром (МФС) представляет собой региональное мышечное болевое расстройство, характеризующееся наличием типичных скрытых и активных триггерных точек. Наиболее частая локализация МФС – позвоночник. В настоящее время отсутствуют лабораторные или рентгенологические критерии, верифицирующие МФС. Необходимо обращать внимание на наличие «красных флагов», подтверждающих диагноз МФС: локализация боли в области шеи, плеча и нижней части спины; наличие триггерных точек [18]. Несмотря на то что различия между МФС и ФМ принципиальны, что обусловлено патогенезом болевого синдрома (при ФМ боль является дисфункциональной, при МФС – ноцицептивной) [38], клинически отличить «тендерные» точки от триггерных бывает затруднительно.
Среди эндокринных и метаболических заболеваний, которые могут протекать под «маской» ФМ, особое внимание заслуживают гипотиреоз, гиперпаратиреоз, акромегалия и дефицит витамина D [40, 41]. Для этих заболеваний характерны жалобы на боль и усталость в теле, но для каждого из них существуют четкие клинические и лабораторные критерии, наличие которых позволяет верифицировать диагноз. Наиболее часто ФМ ассоциируется с аутоиммунным тиреоидитом Хашимото. Также доказано, что гиповитаминоз D приводит к развитию ФМ, что послужило поводом обсуждать возможности лечения ХРБ витамином D [42].
Инфекционные заболевания (Лайм-боррелиоз, вирусный гепатит С и ВИЧ-инфекция) зачастую проявляются симптомами, схожими с ФМ. Необходимость тестирования в отношении этих инфекций определяется в соответствии с клиническими показаниями [43–45]. Кроме того, ФМ нередко развивается после инфекционных заболеваний, чаще всего вирусных.
В дебюте онкологических заболеваний пациенты часто предъявляют жалобы на диффузную боль, сочетающуюся с усталостью, что может напоминать ХРБ.
Среди неврологических заболеваний, сопровождающихся ХРБ, выделяют рассеянный склероз, болезнь Паркинсона (БП) и периферические невропатии. Частота и распространенность ФМ среди неврологических больных, вероятно, несколько выше по сравнению с общей популяцией.
Спинальный стеноз довольно часто может проявляться только ХРБ. Для верификации диагноза необходимо проведение магнитно-резонансной или компьютерной томографии. Результаты визуализации не всегда коррелируют с клиническими проявлениями, окончательный диагноз необходимо определять, ориентируясь на клиническую картину заболевания [46–48].
При ряде заболеваний мышц (миозит, дерматомиозит, макрофагический миофасцит, болезнь Помпе, болезнь Мак-Ардла, миотоническая дистрофия II типа, нейромиотония, миопатия, ассоциированная с дефицитом витамина D) в клинической картине помимо слабости может возникать ХРБ [49, 50].
У пациентов с ФМ распространенность психических нарушений (тревога, депрессия) выше по сравнению с общей популяцией. Кроме того, психические расстройства оказывают негативное влияние на результаты лечения ХРБ. Поэтому всем пациентам с ХРБ рекомендован скрининг для выявления психических расстройств [50–52].
Прием некоторых лекарственных препаратов (статины, опиоиды), некоторых химиотерапевтических агентов (ингибиторы ароматазы и бисфосфонаты) может приводить к развитию боли. Наиболее часто развиваются полифокальная миалгия и артралгия, требующие дифференциальной диагностики с ФМ. Среди пациентов, принимающих статины, ФМ выявлена у 10%. В случае умеренной или тяжелой мышечной боли и/или слабости необходимо прекратить прием препаратов. Патологические симптомы обратимы и должны исчезнуть в течение 2 месяцев [53–55]. При лечении высокими дозами опиоидов (иногда уже на ранней стадии терапии и даже при использовании низких доз) может возникать гипералгезия [56, 57]. Причиной ХРБ может служить невропатия, вызванная химиотерапией. У некоторых пациентов с предшествовавшей ФМ курс химиотерапии может спровоцировать выраженное обострение ХРБ. Ингибиторы ароматазы вызывают мышечно-скелетную боль у 50% женщин, заболевших раком молочной железы. В основном пациенты испытывают боль в костях или суставах, однако в 20% характер боли похож на ХРБ. Доказано ятрогенное действие бисфосфонатов [58, 59]. Полимиозит и другие болезни мышц зарегистрированы у больных, принимающих ингибиторы протонной помпы [60]. «Красным флагом», подтверждающим связь между употреблением лекарств и ХРБ, является внезапное начало многоочаговой боли в течение 1–2 месяцев после начала новой лекарственной терапии.
Известно, что ФМ может быть коморбидной другим хроническим заболеваниям, отрицательно влияя на результаты лечения и качество жизни пациентов. Наиболее часто ФМ сопутствует СВЗ, в т.ч. АСА (до 21%), ревматоидному артриту (до 21%) и системной красной волчанке (до 37%). Доказано, что АСА в сочетании с ФМ протекает с бóльшим числом энтезитов, более высокой активностью и более грубыми функциональными нарушениями [33, 61]. На ранних стадиях БП помимо скованности пациенты могут жаловаться на боль. В исследовании G.L. Defazio et al., L. Negre-Pages et al. показано, что многие пациенты с БП страдают от боли [62, 63]. Наличие выраженной ХРБ в дебюте заболевания, когда моторные проявления БП незначительные, может приводить к отсроченной, иногда на несколько лет, диагностике БП [62–64]. Невропатическая боль может быть маской ХРБ. В исследовании U. Yilmaz et al. по результатам опроса пациентов с наследственной невропатией со склонностью к параличам от сдавления оказалось, что в трети случаев боль соответствовала критериям диагностики ФМ [65]. В настоящее время активно изучается ассоциация между ФМ и невропатией с поражением тонких волокон. N. Uceyler, C. Sommer рассматривают эти заболевания как самостоятельные, однако некоторые авторы считают невропатию тонких волокон основным патофизиологическим механизмом развития ФМ [66–68].
Практические рекомендации по диагностике
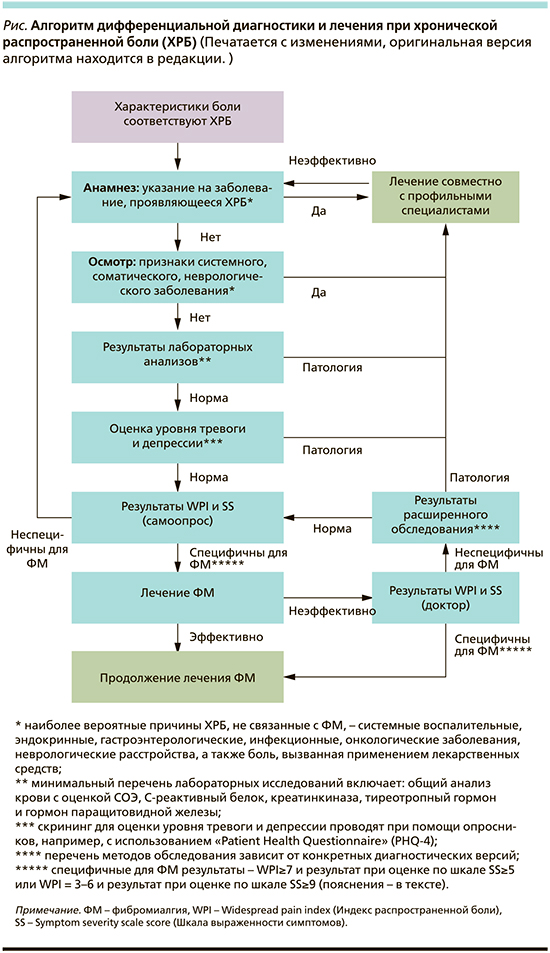
Вначале необходимо оценить локализацию боли (шаг 1), например, с помощью диаграммы боли или путем опроса на предмет того, возникает ли боль в левой и в правой половинах тела, выше и ниже уровня талии, длится ли она более 3 месяцев. Если боль действительно является распространенной и хронической, следует продолжить опрос и осмотр больного с акцентом на поиск причины ХРБ. Чрезвычайно важно собрать подробный анамнез (шаг 2) для исключения других заболеваний, которые могут служить «маской» ФМ. Для этого необходимо получить информацию о заболеваниях в семье, наличии системных, эндокринных, гастроэнтерологических, инфекционных, онкологических заболеваний, неврологических расстройств; применении лекарственных препаратов, которые могут вызывать ФМ (статины, опиоиды, некоторые химиотерапевтические препараты). Во время оценки общего состояния больного и его неврологического статуса (шаг 3) необходимо особое внимание обратить на наличие клинических проявлений перечисленных выше заболеваний, сроки начала и темп развития симптомов заболевания, а также на факторы, усиливающие и уменьшающие выраженность боли. При оценке анамнеза и данных врачебного осмотра необходимо обращать внимание на наличие «желтых флагов», указывающих на ФМ.
«Желтые флаги», указывающие на ФМ [30]:
- Особенности боли, которые включают:
- вариабельность локализации и интенсивности;
- характеристики напоминают невропатический характер боли (жгучая боль);
- ухудшение возникает при перемене погоды, перенапряжении, недостаточном сне и стрессах.
- Объективное обследование:
- состояние скелетно-мышечной системы соответствует возрастной норме;
- болезненность мягких тканей и всего тела;
- дизестезия.
Затем необходимо провести рутинные лабораторные исследования (шаг 4) для исключения соматической патологии. Минимальный перечень таких исследований включает общий анализ крови с оценкой СОЭ, уровни C-реактивного белка, креатинкиназы, тиреотропного гормона и гормона паращитовидной железы.
Перечень диагностических мероприятий при выявлении хронической распространенной боли (ХРБ) [30]:
- Характеристика боли:
- локализация (можно использовать диаграмму боли);
- время возникновения;
- наличие факторов, усиливающих и облегчающих боль.
- Оценка сопутствующих симптомов:
- усталость и неэффективный сон (можно использовать опросник FSQ (Fibromyalgia Symptom Questionnaire);
- симптомы поражения других органов и систем;
- симптомы системного заболевания (потеря массы тела, нарушение аппетита, лихорадка и др.).
- Анализ сведений анамнеза заболевания и жизни (в т.ч. оценка социально-психологической ситуации).
- Анализ сведений семейного анамнеза (в т.ч. оценка социально-психологической ситуации).
- Объективный осмотр:
- детальный общий врачебный осмотр, необходимо обратить особое внимание на болезненность различных участков тела, наличие дизестезии или аллодинии, отечность в области суставов, напряжение (дефанс) мышц спины и болезненность участков прикрепления связок и сухожилий к костям (энтезисов);
- оценка неврологического статуса.
- Если есть подозрение на ФМ для скрининга наиболее частых соматических заболеваний, следует использовать минимальный набор лабораторных исследований крови (общий анализ крови с оценкой СОЭ, C-реактивный белок, креатинкиназа, тиреотропный гормон и гормон паращитовидной железы).
После этого следует провести скрининг для оценки уровня тревоги и депрессии (шаг 5), например, с использованием опросника PHQ-4 (Patient Health Questionnaire). Ключевым моментом в подтверждении диагноза ФМ является тестирование больных с применением самоопросников для оценки индекса WPI и выраженности симптомов по шкале SS (учитываются дополнительные симптомы, такие как усталость, нарушение сна и когнитивные нарушения) (шаг 6). Положительные ответы позволяют утвердиться в мнении о высокой вероятности диагноза ФМ. При исключении соматической патологии, согласно критериям ACR от 2010 г., диагноз ФМ можно считать подтвержденным и назначать лечение (шаг 7) в соответствии с представленными ниже клиническими рекомендациями.
В отсутствие эффекта от лечения через 6 месяцев необходимо повторное обследование пациента с использованием опросника для оценки индекса WPI и SS с непосредственным участием врача с последующим расширенным дообследованием пациента.
Наглядно алгоритм дифференциальной диагностики и лечения при ХРБ представлен на рисунке.
Собственные наблюдения
Был проведен анализ встречаемости ФМ среди пациентов с ХРБ, находившихся на стационарном лечении в различных по профилю (неврологическом, ревматологическом, онкологическом) отделениях. Для определения диагноза ФМ были использованы рекомендации ACR с оценкой количественных показателей (WPI, SS, FS) как врачом, так и самим пациентом (с использованием самоопросника). Всем пациентам проводили скрининг для оценки уровней тревоги и депрессии с использованием опросника PHQ-4. Кроме того, проводили оценку невропатического компонента боли с использованием шкалы TSS (Total Symptom Score).
После предварительной оценки боли и классификации ее как ХРБ были проанкетированы 59 пациентов, из них 42 (71%) женщины и 17 (29%) мужчин, средний возраст которых составил 54 года. Наиболее частой причиной ХРБ (69,5%) служили СВЗ: ревматоидный артрит (33,9%), АСА (16,9%), недифференцированный артрит (10,3%), генерализованный остеоартроз (8,5%). В 16,9% случаев боль была обусловлена наличием дегенеративно-дистрофических заболеваний позвоночника, в 5,1% – онкологическими заболеваниями.
Среди опрошенных у 5 (8,5%) человек диагноз ФМ полностью соответствовал международным критериям. Все пациенты находились на стацио-нарном лечении в неврологическом отделении с диагнозом «дорсопатия», что свидетельствует о недостаточной информированности и настороженности врачей в отношении данной проблемы.
Среди пациентов с ФМ преобладали женщины (80%), средний возраст которых составил 51 год. При оценке количественных показателей с использованием опросника врачом и самим пациентом статистически значимой разницы не установлено. Так, в среднем WPI и SS при оценке врачом составили 11,6 и 7,4 соответственно, а WPI и SS при самооценке пациентом – 12,0 и 6,8 соответственно. Полученные данные подтверждают, что WPI и оценка по шкале SS валидны (как при врачебном осмотре, так и при самооценке пациентами) в отношении представителей популяции г. Саратова. Индекс FS (Fibromyalgia Syndrome) в среднем составил 18,8, что свидетельствует о наличии тяжелого полисимптомного дистресса.
При использовании опросника PHQ-4 у всех пациентов с ФМ выявлен умеренно повышенный уровень соматизации (16,8) и дистресса (12,2). Значимых тревожных и депрессивных нарушений при опросе ни у кого выявлено не было.
При оценке невропатической боли показатель TSS в среднем составил 7,8, что соответствует умеренно выраженному уровню позитивных нейропатических симптомов.
Лечение ФМ
В настоящее время наиболее известны три клинических руководства по терапии пациентов с ФМ, основанные на мета-анализе рандомизированных клинических исследований (РКИ).
Специалисты AWMF (Arbeitsge-meinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften) в 2010 г. в руководстве по терапии ФМ указали приоритетным направлением нормализацию физической активности пациента и когнитивно-поведенческую терапию.
В рекомендациях CFGC (The Canadian Fibromyalgia Guideline Committee) в 2012 г. по терапии ФМ отмечено, что фармакологическая терапия может быть умеренно эффективной только в случае регулярной физической активности пациента.
В 2016 г. EULAR (European League Against Rheumatism) разработало рекомендации, согласно которым немедикаментозная терапия получила наивысший уровень доказательств, что служит значительным отличием от предыдущих руководств EULAR, в которых основным считалось фармакологическое лечение [69].
Выбор медикаментозной терапии должен определяться клиническими особенностями, профилем побочных эффектов и ответом на терапию.
В качестве патогенетического лечения при ФМ наиболее эффективны антидепрессанты, антиконвульсанты и анальгетики центрального действия.
Использование нестероидных противовоспалительных средств (НПВС) при ФМ не рекомендуется экспертами EULAR и AWMF. Аналогичные данные имеются в Кокрановском обзоре по терапии ФМ [70]. Однако рекомендации CFGC предусматривают использование НПВС в минимально допустимой дозе и короткими курсами при наличии СВЗ (например, при остеоартрите). Также доказано, что ацетаминофен оказывает модулирующее действие на эндогенную каннабиноидную систему [71] и является агонистом серотониновых рецепторов [72]. Нет прямых доказательств в отношении использования ацетаминофена для купирования боли при ФМ, однако есть сведения о его эффективном применении в комбинации с трамадолом [73].
Трициклические антидепрессанты (амитриптилин), как известно, ингибируют обратный захват серотонина и норадреналина и активно используются для лечения невропатической боли. Aмитриптилин рекомендован экспертами AWMF в дозе 10–50 мг/сут, в то время как в рекомендациях EUALR рекомендуется использовать только низкие дозировки. По данным B. Nishishinya et al., амитриптилин в дозе 25 мг/сут уменьшает боль, усталость и нормализует сон у пациентов через 6–8 недель [74].
Активно изучается эффективность ингибиторов обратного захвата серотонина и норадреналина у пациентов с ФМ.
Установлено, что дулоксетин оказывает в 5 раз более сильное влияние на серотонин, чем на норадреналин [75]. Эксперты AWMF рекомендуют дулоксетин в дозе 60 мг/сут для пациентов с сопутствующим депрессивным расстройством независимо от наличия тревожных расстройств. Эта рекомендация также одобрена EULAR. Доза препарата и продолжительность терапии зависят от «ответа» пациента и профиля побочных эффектов. Однако применение дулоксетина в дозе 20–30 мг/сут было неэффективным. Не выявлено существенной разницы при применении дулоксетина в дозе 120 мг/сут по сравнению с таковой 60 мг/сут [76].
Милнаципран оказывает в 3 раза более сильное воздействие на норадреналин, нежели на серотонин. Он рекомендован для терапии экспертами EULAR, хотя установлено, что дулоксетин превосходит милнаципран в своем влиянии на купирование боли и нормализацию качества сна [75, 77]. Эксперты AWMF не рекомендуют назначать милнаципран. Это основано на данных о незначительном обезболивающем эффекте и высоком риске побочных эффектов.
В настоящее время недостаточно сведений в отношении использования других препаратов, таких как венлафаксин, в терапии ФМ.
Согласно Кокрановскому обзору, отсутствуют доказательства в отношении преимуществ селективных ингибиторов обратного захвата серотонина (СИОЗС) по сравнению с плацебо при лечении основных симптомов ФМ (боль, усталость и проблемы со сном), однако они могут рассматриваться как препараты выбора для лечения депрессии у пациентов этой группы [78]. Эксперты EULAR не рекомендуют использовать СИОЗС больным ФМ, тогда как в рекомендациях AWMF флуоксетин в дозе 20–40 мг/сут или пароксетин в дозе 20–40 мг/сут рассматривают при ФМ как терапию сопутствующих депрессивных и (или) тревожных расстройств [79, 80]. Циталопрам не доказал эффективности в терапии пациентов с ФМ [81].
Анальгетический эффект антиконвульсантов (прегабалин и габапентин) связан с их способностью связываться с каналами кальциевого типа в центральной нервной системе [82]. В результате 8-недельного РКИ у 529 пациентов с ФМ доказана эффективность прегабалина в терапии боли при использовании его в дозе 450 мг/сут. Также отмечено улучшение других показателей, включая качество сна, уменьшение усталости [83].
В Кокрановском обзоре ежедневная доза 600 мг не показала преимуществ по сравнению с таковой 450 мг для терапии боли [84]. Рекомендации в отношении использования этих препаратов различны: эксперты AWMF рекомендуют использовать прегабалин (150–450 мг/сут), если невозможно использовать антидепрессанты, в то время как эксперты EULAR не рекомендуют использовать антиконвульсанты для терапии пациентов с ФМ.
Использование антиконвульсантов может быть ограничено их профилем побочных эффектов: головокружение, сонливость, увеличение массы тела, периферические отеки и когнитивные нарушения [85].
Применение наркотических анальгетиков не рекомендовано при лечении ФМ. У пациентов с ФМ отмечается дефицит опиоид-опосредованной нисходящей антиноцицептивной активности, а также повышение уровня эндогенных опиоидов в ЦСЖ [86] и уменьшение числа центральных μ-опиоидных рецепторов [56], что может объяснить отсутствие эффективности экзогенных опиоидов в этой группе пациентов. Трамадол – это слабый опиоид, комбинированный агонистом μ-рецепторов, ингибирующий активность серотонина и норэпинефрина [87]. Именно это обусловливает его эффективность при ФМ в отличие от других опиоидов. Эффективность трамадола при ФМ изучалась в ряде исследований [73, 88–90], хотя долгосрочная эффективность и оптимальная доза трамадола не уточняются. Трамадол рекомендован экспертами EULAR и CFGC, тогда как AWMF воздерживается от каких-либо рекомендаций ввиду отсутствия клинически достоверных данных.
Несмотря на рекомендации по назначению антидепрессантов и антиконвульсантов в качестве препаратов первой линии для купирования боли при ФМ, достаточных данных в отношении оптимальной дозы и продолжительности терапии в настоящее время нет. Согласно рекомендациям AWMF, пробную терапию необходимо назначать на 6 месяцев, после чего, если эффекта не наблюдается, терапию следует прекратить. Это основано на максимальной длительности исследования применения амитриптилина, дулоксетина и прегабалина [91].
Лечение пациентов с ФМ должно быть комплексным, особое внимание необходимо уделять немедикаментозным методам лечения. В настоящее время отсутствуют единые рекомендации по ведению пациентов с ФМ. Подбор медикаментозной терапии необходимо осуществлять индивидуально для каждого пациента с учетом особенностей клинических проявлений, противопоказаний и «ответа» на терапию.


