Инфекционные заболевания являются наиболее частым поводом для обращения к врачу-педиатру. Несмотря на развитие новых методов диагностики, лечения и профилактики, количество инфекционных заболеваний не уменьшается. По данным ВОЗ, ежегодно в мире регистрируется около 2 млрд диарейных заболеваний, причем в 1,9 млн случаев заболевание заканчивается смертью детей в возрасте до 5 лет [1]. Известно, что около 78% этих эпизодов приходится на развивающиеся страны Азии и Африки. По данным Центра по контролю и профилактике заболеваний, частота диарейных заболеваний в США составляет 47,8 млн в год с финансовыми затратами 14 млрд долл. [2]. По данным Роспотребнадзора, в Российской Федерации отмечена четкая тенденция к увеличению частоты диарейных заболеваний примерно на 6–7% в год, что у детей составляет 470–530 тыс. случаев [3, 4].
В международных руководствах термины «диарея», «диарейный синдром» и «острый гастроэнтерит» (ОГЭ) часто используются как синонимы, т.к. при развитии острых кишечных инфекций параллельно с диареей возникает рвота. C 2014 г. в России используется Консенсус ESPGHAN (2014 г. c дополнениями 2015 г.) по ведению ОГЭ у детей [5]. Впервые единые рекомендации по ведению ОГЭ у детей опубликованы Европейским обществом детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN) совместно с Европейским обществом детских инфекционистов (ESPID) в 2008 г. [6] и далее обновлены в 2014 г. на основании исследований, выполненных с учетом принципов доказательной медицины. Эти методические рекомендации включают данные эпидемиологии, этиологии, диагностики и терапии указанной патологии.
В этиологии острой диареи у детей раннего возраста основной агент – ротавирус (ESPGHAN 2014, уровень доказательности III, C), что прослеживается в странах Европы (рис. 1).
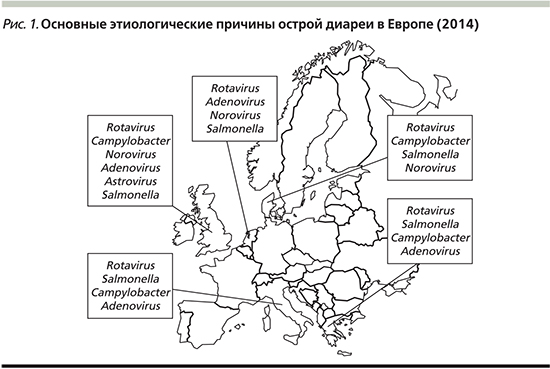
В табл. 1 представлены основные этиологические факторы ОГЭ в зависимости от возраста. В течение первых трех лет жизни дети переносят от одного до трех эпизодов диареи, нередко в тяжелой форме [8]. До последнего времени именно ротавирус был наиболее частой причиной госпитализации детей, особенно раннего возраста. На сегодняшний день в связи с проводимой в ряде стран вакцинацией против ротавируса отмечено значимое снижение обусловленной им заболеваемости у детей раннего возраста в Европе. Например, в Финляндии с 2009 г. заболеваемость ротавирусной инфекцией снизилась на 82%, количество госпитализаций сократилось на 76%. При этом отмечено снижение частоты ротавирусной инфекции у детей во всех возрастных группах, хотя прививаются только дети первых месяцев жизни [9]. По контагиозности и значимости норовирус находится на втором месте, поскольку в связи со снижением доли ротавируса в этиологии ОГЭ стали чаще выявляться норовис и астровирус [5].

Бактериальные факторы занимают второе место в этиологии острых кишечных инфекций. В основном это Campylobacter и Salmonella, особенно в южных регионах Российской Федерации. Проанализирована значимость этиологических факторов в развитии ОГЭ у детей, проживающих в Новосибирске, за 2005-2007 гг. При анализе 1898 историй болезни детей, перенесших острые кишечные инфекции, в 80,5% случаев выявлена вирусная этиология заболевания. Ротавирус в 35% случаев явился основным этиологическим фактором ОГЭ у детей до 3 лет, из них 72% составили дети до 1 года. В 45,5% случаев была выявлена ассоциация нескольких вирусов или вирусов с бактериями.
Микст-инфекция характеризовалась сочетанием ротавируса с норовирусом или астровирусом, а также с бактериальнoй инфекциeй (сальмонелла, шигелла, энтероинвазивная кишечная палочка, кампилобактер) [10].
В настоящее время разработан и внедрен в практику единый алгоритм ведения детей с ОГЭ. В основе Консенсуса лежат оценка тяжести состояния ребенка, единые методы терапии, применяемые вне зависимости от этиологии диареи.
Диарея, согласно терминологии ВОЗ, представляет собой учащение частоты дефекаций >3 раз в сутки, сопровождающееся появлением водянистого жидкого стула с патологическими примесями (кровь, слизь, гной). Как правило, данное утверждение может быть использовано для детей старше 3 лет [2]. У детей более раннего возраста необходимо оценивать характер каловых масс, примеси и объем потерянной жидкости. В норме объем кала у детей раннего возраста не превышает 50 г/сут, а частота дефекаций, как правило, соответствует числу кормлений. У младенцев на грудном вскармливании частота дефекаций больше, чем у младенцев на искусственном вскармливании. Для педиатра первостепенное значение имеет оценка объема ежедневно теряемой с калом жидкости.
Алгоритм терапии ОГЭ у детей предусматривает воздействия, направленные на основные звенья патогенеза данной инфекции: восстановление объема циркулирующей крови и водно-электролитного баланса (регидратация, диетотерапия), снижение потери жидкости, детоксикацию (энтеросорбцию) и элиминацию возбудителя (по показаниям – антибактериальная терапия, применение пробиотиков) [6]. При водянистой диарее эксперты ВОЗ (2006) признали абсолютно доказанной эффективность только двух терапевтических мероприятий – регидратации и адекватного питания.
Дегидратация (эксикоз: МКБ-10 T67.4) – это потеря организмом воды и солей, что ведет к повышению вязкости крови, гипоксии и нарушению кровообращения с последующим влиянием на функции гипоталамуса и центра терморегуляции. Правильная оценка тяжести состояния и вовремя назначенная регидратация имеют ключевое значение при терапии диареи любого генеза [5]. Оценка тяжести дегидратации представлена в табл. 2.

Экспертами ESPGHAN предложена упрощенная шкала оценки дегидратации Clinical Dehydration Scale (CDS) в баллах, где 0 баллов – дегидратация отсутствует, от 1 до 4 – легкая дегидратация, 5–8 баллов соответствуют дегидратации средней и тяжелой степеням (табл. 3) [12].
Расчет объема жидкости для пероральной регидратации проводится в два этапа [13–15]:
Этап I – в первые 6 часов при первой степени дегидратации объем жидкости рассчитывается как 40–50 мл/кг массы тела, при второй степени – 80–90 мл/кг массы тела.
Этап II – весь последующий период проводят поддерживающую терапию с учетом потерь жидкости со стулом и суточной потребности в жидкости. При массе тела <25 кг суточный объем жидкости составляет 80 100 мл/кг.

На основании мета-анализа 16 рандомизированных клинических исследований c участием 1545 детей в различных странах мира эксперты ESPGHAN рекомендуют использование растворов для оральной регидратации с пониженной осмолярностью 225–240 мосм/л, что улучшает всасывание воды и электролитов в кишечнике по сравнению с гиперосмолярными растворами [6, 8, 16]. Чем ранее начата оральная регидратация, тем реже отмечаются осложнения дегидратации и необходимость проведения внутривенных инфузий (отношение рисков – 0,36; 95% доверительный интервал – 0,14–0,89) и меньше время пребывания в стационаре (примерно на сутки) [17].
Возможности использования лекарственных препаратов в терапии ОГЭ с учетом новых рекомендаций, основанных на данных доказательной медицины, существенно ограничены. Рекомендованы к применению энтеросорбенты, определенные штаммы пробиотиков, в развивающихся странах – препараты цинка. Использование антибактериальных препаратов даже при инвазивных диареях активно обсуждается с позиций их ограниченного применения только в случае крайней необходимости при бактериальной этиологии заболевания.
Назначение энтеросорбентов рекомендовано с момента прекращения рвоты. На основании 9 рандомизированных контролируемых исследований (n=1238) показано, что смектит диоктаэдрический значимо уменьшает продолжительность диареи по сравнению с группой плацебо [18]. Смектит диоктаэдрический уменьшает воспаление, модифицирует реологические свойства слизи, адсорбирует бактерии и их энтеротоксины, вирусы, что не только уменьшает объем выделенного стула, нормализует двигательную активность кишечника, но и уменьшает дегидратацию (уровень доказательности II, B) [18, 19].
По данным Кокрановского обзора систематического (2010), на основании анализа 63 клинических исследований, в которых участвовали 8045 человек, показано, что применение пробиотиков в терапии диарейных заболеваний приводит к улучшению общего состояния пациентов с уменьшением числа дефекаций и интоксикации уже на вторые стуки [20]. В протоколе терапии диарейных заболеваний у взрослых применение пробиотиков не имеет достаточной поддержки [2].
В настоящее время терапевтическое действие пробиотиков продолжает изучаться. На сегодняшний день эксперты пришли к единому мнению, что применение пробиотиков у детей возможно и приводит к уменьшению воспаления, к сокращению периода диареи. Однако не все пробиотики имеют одинаковый терапевтический эффект в лечении диарейных заболеваний. Только несколько из них имеют высокий уровень доказательности I, A. Рекомендованные для терапии диарейных заболеваний пробиотики представлены в табл. 4 [20–22].
С целью уменьшения полипрагмазии при ОГЭ вирусной этиологии российскими учеными проведены исследования по использованию растворов для оральной регидратации, содержащих в своем составе пробиотик. Доказана их эффективность в терапии аденовирусной и норовирусной инфекций у детей [23, 24].
На рис. 2 представлены основные подходы к терапии диарейных заболеваний у детей.
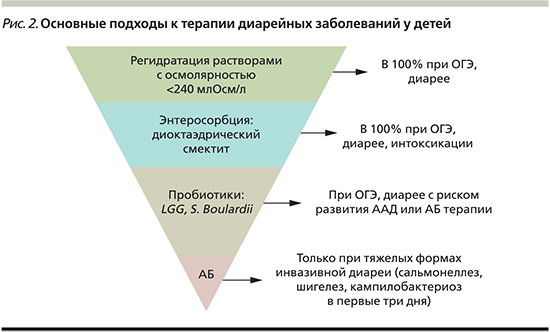
Суммируя методические рекомендации по лечению диарейных заболеваний у детей, следует отметить, что первой линией терапии является регидратация и энтеросорбция. По показаниям рекомендовано применение пробиотика. Для назначения антибактериальных препаратов при диарейных заболеваниях у детей должны быть строгие показания. Фармакоэпидемиологические исследования, проведенные в России, немногочисленны, но даже из этих ограниченных данных следует, что госпитализированным с диарейным синдромом детям в 72–100% случаев немедленно назначаются антибактериальные препараты, хотя у 2/3 из этих пациентов нет показаний к их применению. Анализ историй болезни многих стационаров свидетельствует о применении у детей достаточно токсичных антибиотиков широкого спектра действия, таких как хлорамфеникол, защищенные пенициллины, рифампицин, цефалоспорины III поколения и др. [25, 26].
Наиболее частыми бактериальными причинами развития диареи у детей являются Salmonella, Shigella, патогенные штаммы Escherichia coli, Campylobacter, Staphylococcus, Klebsiella и др. [27]. Применение антибактериальной терапии возможно только при бактериальной этиологии или микст-инфекции в тяжелых случаях течения заболевания [28]. Одним из препаратов выбора в данной ситуации является производное 5-нитрофурана – нифуроксазид. Он характеризуется широким антимикробным спектром, воздействуя не только на грамположительные (Staphylococcus spp., Streptococcus spp.), грамотрицательные (Escherichia coli, Schigella spp., Salmonella spp.) бактерии и патогенные грибы (Candida albicans и др.), но и на простейших (Lamblia intestinalis и др.). Важно отметить, что нифуроксазид оказывает терапевтическое действие в просвете кишечника и не всасывается в системный кровоток. Экспертами нифуроксазид рекомендуется в качестве стартовой терапии острых диарей бактериальной этиологии [27, 28].
По данным клинических исследований, нифуроксазид не оказывает значимого действия на облигатную флору кишечника. В клиническом исследовании у 100 детей с острой кишечной инфекцией в возрасте от года до 13 лет нифуроксазид применялся в комплексной терапии наряду с регидратацией и энтеросорбцией. Этиологически шигеллы выявлялись у 15%, сальмонеллы у 10%, кампилобактер у 11%, стафилококк у 9% пациентов. У 55% больных этиология заболевания не была установлена. Применение нифуроксазида продемонстрировало высокую эффективность и безопасность для 89% детей [29]. В другом исследовании из 40 детей с острой диареей установить этиологический фактор удалось только в 17 (42,5%) случаев, причем у 41,2% пациентов была выделена шигелла Зонне, а у 29,4% – Salmonella enteritidis. На фоне терапии нифуроксазидом было отмечено быстрое восстановление аппетита, купирование диарейного и болевого синдрома, рвоты [30].
Нифуроксазид влияет на патогенную бактериальную клетку путем нарушения ее энергетического обмена, блокируя структурный ген ДНК, угнетая метаболизм пирувата, активность дегидрогеназ, альдолаз и транскетолаз. Действие препарата может быть как бактеристатическим, так и бактерицидным в зависимости от дозы. Как и все нитрофураны, нифуроксазид активирует фагоцитарную активность лейкоцитов [31].
Таким образом, рост антибиотикорезистентности, вероятности развития антибиотикассоциированной диареи и других системных осложнений, обусловленных нерациональным использованием антибактериальных препаратов в педиатрии, диктует необходимость использования современного Консенсуcа ESPGHAN (2014) по терапии диарейного синдрома. Выбор стартовой антибактериальной терапии должен определяться спектром антибактериального действия, высоким профилем безопасности и возможностью использования препарата в разных формах для детей младшего и старшего возраста.



