Остеоартрит (ОА) – наиболее частое заболевание костно-мышечной системы, характеризующееся дегенеративно-дистрофическими изменениями сустава и субхондральной кости, приводящее к снижению качества жизни [1, 2]. В патогенез заболевания вовлекаются структурные, механические и биологические пути, что вызывает дегенерацию тканей сустава одновременно с повреждением костной ткани [3]. В физиологических условиях неповрежденная субхондральная кость выполняет защитные функции в отношении хряща, предотвращая разрушение последнего. Уже на ранних стадиях ОА отмечается уменьшение толщины субхондральной кости [4]. Одновременно с этим повышается резорбция костной ткани вследствие повышения активности остеокластов, что приводит к потере целостности и пластичности костно-хрящевых соединений раньше, чем проявятся клинические признаки остеопороза [5]. Процесс костного ремоделирования считается центральным в прогрессировании ОА [6], в связи с чем патогенетически обоснована тактика, при которой субхондральная кость становится потенциальной терапевтической целью в лечении ОА [7]. В то же время ряд публикаций свидетельствует об интересе, направленном на изучение особой роли цитокиновой сети в патогенезе ОА с обсуждением широкого спектра возможных вариаций основных и провоспалительных цитокинов в зависимости от длительности и тяжести заболевания [8–10]. Безусловно, это ставит вопросы не только о возможности влияния той или иной терапевтической стратегии на острофазный период ОА, но и о более длительной перспективе снижения цитокиновой активности. Более того, пациенты с ОА не только имеют коморбидный соматический статус, но в большинстве случаев у них диагностируется та или иная степень дегенеративно-дистрофических изменений позвоночника с клиническими проявлениями боли в спине. Изучение лекарственных средств для пациентов с различными фенотипами ОА, когда имеет место множественность повреждения костно-мышечной системы, крайне важно для дальнейшего их рационального использования в условиях клинической практики.
Целью исследования АЛЬБАТРОС стала оценка антирезорбтивно-цитокиновой эффективности хондропротективной терапии ОА и неспецифической боли в нижней части спины.
Материал и методы
Критерии включения в исследование:
- амбулаторные пациенты с верифицированным диагнозом ОА коленных суставов в соответствии с критериями, опубликованными R. Altman и соавт. [11], и объективной информацией, подтвержденной данными автоматизированной системы АИС «Поликлиника», имевших в анамнезе данные о наличии боли в нижней части спины;
- пациенты, впервые обратившиеся в данном календарном году по поводу болевого синдрома в области коленного сустава и ранее не принимавшие хондропротективных препаратов;
- мужчины и женщины старше 60 лет.
Критерии невключения:
- перенесенный ранее инсульт и (или) транзиторная ишемическая атака;
- эрозивно-язвенные изменения слизистой оболочки желудка или двенадцатиперстной кишки;
- активное желудочно-кишечное кровотечение;
- цереброваскулярное или иное кровотечение;
- воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенный колит) в фазе обострения;
- гемофилия и другие нарушения свертываемости крови;
- выраженная сердечная недостаточность (III–IV функциональные классы по классификации NYHA);
- выраженная печеночная недостаточность (более 9 баллов по шкале Чайльд–Пью) или активное заболевание печени;
- почечная недостаточность тяжелой степени (клиренс креатинина <30 мл/мин), прогрессирующие заболевания почек;
- период после проведения аортокоронарного шунтирования;
- клинически выраженная ишемическая болезнь сердца (ИБС);
- стойко сохраняющиеся значения артериального давления (АД)>140/90 мм рт.ст.
Этап скрининга прошли 489 чело-век, из них критериям включения/невключения соответствовали 170 больных. Все включенные больные методом конвертов были рандомизированы в две группы: пациенты 1-й группы (n=85, основная группа) получали нестероидные противовоспалительные средства (НПВС) и препарат Алфлутоп, пациенты 2-й группы (n=85, группа сравнения) – только НПВС. Каждому больному был назначен один из четырех НПВС: мелоксикам (в дозе 15 мг/сут), эторикоксиб (60 мг/сут), нимесулид (200 мг/сут) или целекоксиб (200 мг/сут). Алфлутоп назначали в дозе 1 мл внутримышечно 1 раз в сутки в течение 20 дней. Курс лечения Алфлутопом начинался при включении пациента в исследование и через 6 месяцев назначали повторный курс Алфлутопа. Все пациенты принимали корригирующую терапию в соответствии с имеющимися в анамнезе сопутствующими заболеваниями. Группу контроля (n=53, 3-я группа) составили лица, сопоставимые с пациентами 1-й и 2-й групп по клинико-демографическим признакам без ОА и болей в нижней части спины в анамнезе.
Длительность наблюдения составила 12 месяцев, в этот период было проведено три визита (V), из которых V1 – в начале исследования, V2 – через 6 месяцев, V3 – через 12 месяцев. В электронные индивидуальные регистрационные карты для каждого пациента на V1 вносились клинико-демографические данные, включая пол, возраст, индекс массы тела (ИМТ); параметры диастолического артериального давления (ДАД), систолического артериального давления (САД); длительность ОА, данные о сопутствующих заболеваниях, показатель индекса WOMAC (суммарно), а также показатель боли по WOMAC. Индекс WOMAC (Western Ontario and McMaster Universities) — высокоинформативный показатель, который, как правило, используется для оценки эффективности медикаментозного лечения больных ОА [12]. Тест WOMAC представляет собой анкету для самостоятельного заполнения больными (в течение 5–7 минут), состоящую из 24 вопросов, характеризующих выраженность боли (5 вопросов), скованность (2 вопроса) и функциональную способность больных (17 вопросов). Уровень боли в нижней части спины оценивали по визуальной аналоговой шкале (ВАШ, мм).
Определяли следующие биохимические параметры крови: уровни общего холестерина (ХС), липопротеидов низкой плотности (ЛПНП), триглицеридов (ТГ), а также показатели скорости клубочковой фильтрации (СКФ). Во время V1 проводили процедуру тщательного последовательного ознакомления пациентов с дизайном исследования, информировали их о возможных побочных эффектах терапии НПВС и Алфлутопом, пациенты подписывали добровольное информированное согласие на участие в исследовании. Также все пациенты были извещены, что в любой момент они могут выйти из исследования по любой причине.
На всех визитах проводили лабораторные исследования: определение содержания в сыворотке крови трансформирующего фактора роста β1 (TGF-β1 – Transforming growth factor beta), интерлейкина (ИЛ)-1β и ИЛ-6 методом иммуноферментного анализа с использованием стандартных наборов на фотометре для микропланшет 680 («Bio-RadLaboratories», США) и программного обеспечения MicroplateManager (Япония). Концентрацию TGF-β1 определяли иммуноферментным методом в строгом соответствии с инструкцией производителя. Для количественного определения TGF-β1 в сыворотке крови использовали тест-системы («DRG InstrumentsGmbH», Германия) с порогом чувствительности 1,9 пг/мл. Определение в сыворотке крови показателя Beta–Crosslaps (β-CrossLaps) проводили строго натощак с предварительным периодом голодания до 7 часов, за референсные значения принимали значения менее 0,955 нг/мл для женщин в возрасте от 50 до 70 лет включительно и менее 0,705 нг/мл для мужчин в возрасте от 50 до 70 лет включительно. Показатель формирования костного матрикса P1NP (N-терминальный пропептид проколлагена 1-го типа) определяли методом электрохемилюминесцентного иммуноанализа, за референсные значения принимали показания 15–75 нг/мл (для женщин в возрасте от 50 до 70 лет) и 15–80 нг/мл (для мужчин в возрасте от 50 до 70 лет). Выявление в моче уровня дезоксипиридинолина (ДПИД) проводили с помощью метода твердофазного хемилюминисцентного иммуноанализа. С целью устранения влияния вариаций мочеобразования результаты сопоставлялись с концентрацией креатинина в моче. Единицы измерения – нмольДПИД/моль креатинина. За референсные значения для женщин в возрасте от 50 до 70 лет принимали результаты от 3,0 до 7,5 нмольДПИД/моль креатинина и 2,3–5,5 нмольДПИД/моль креатинина для мужчин.
Полученные данные обрабатывали c помощью стандартной программы Microsoft Excel и пакета статистических программ Statistiсa for Windows, v. 6.0. Описание нормально распределенных количественных признаков приведено с указанием среднего значения признака и среднего квадратичного отклонения (M±SD). Для анализа была использована описательная статистика с применением параметрического t-критерия Стьюдента. Для описания признаков с распределением, отличным от нормального, указывали медиану, верхний (25-й) и нижний (75-й) квартили – Me [Q25; Q75]. Для сравнения независимых групп применяли однофакторный дисперсионный анализ (one-way ANOVA – ANalysis Of VAriance), для исследования связи между количественными признаками использовался ранговый коэффициент корреляции Спирмена (r). Различия между изучаемыми параметрами признавали статистически значимыми при p<0,05. Расчет основных характеристик диагностических методов вели в соответствии с требованиями CONSORT (CONSORT Group., 1996).
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен этическим комитетом Самарского государственного медицинского университета.
Результаты исследования
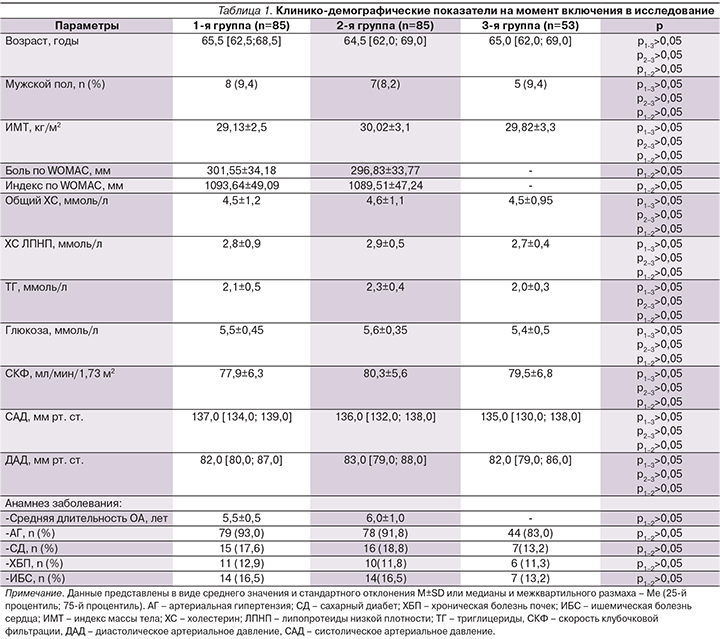
Исследование завершил 161 (94,7%) больной, выбыли 4 (4,7%) пациента основной группы и 5 (5,9%) – группы сравнения по причине несоблюдения условий протокола. Побочных эффектов при приеме лекарственных средств в обеих группах отмечено не было. Длительность приема НПВС от начала включения в исследование в обеих группах больных была сопоставимой, без статистически значимых различий. В первой группе пациенты принимали НПВС 26±4,5 дня, больные 2-й группы – 27±3,5 дня соответственно. Пациенты обеих групп (как основной, так и группы сравнения) не различались на V1 по клинико-демографическим показателям, данные подробно представлены в табл. 1.
Следует отметить, что, по полученным нами данным, больные ОА, имевшие в анамнезе боль в нижней части спины, – это лица с коморбидной патологией, а именно: с наличием артериальной гипертензии (АГ), сахарного диабета (СД), ИБС, хронической болезни почек (ХБП). Пациенты 1-й и 2-й групп по представленным характеристикам статистически достоверно (р>0,05) не различались. Отягощенный соматический статус имел место и у лиц 3-й группы, что обусловлено возрастными характеристиками и отражает общую картину представленной патологии в популяции среди населения старших возрастных групп. У всех пациентов 1-й и 2-й групп на момент включения после проведения диагностического теста было отмечено следующее: среди пациентов основной группы показатель боли в нижней части спины по ВАШ составил 30,5±10,5 мм, в группе сравнения – 30,0±10,5 мм без статистически значимой разницы между группами (p=0,95).
На V2 у пациентов 1-й и 2-й групп, по данным индекса WOMAC, отмечено статистически значимое уменьшение болей в коленном суставе в покое, снижение выраженности ночных болей и уменьшение болей при ходьбе по лестнице. При оценке болей в нижней части спины через 6 месяцев установлено статистически значимое снижение по индексу ВАШ у больных как основной, так и группы сравнения: 1-я группа p=0,03; 2-я группа p=0,034.
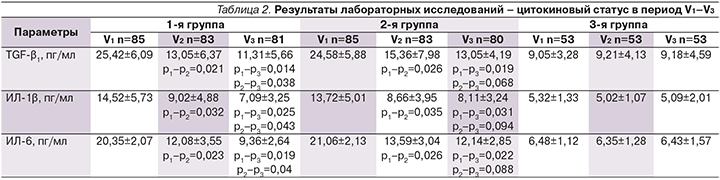
По данным проведенного дисперсионного анализа ANOVA на начало исследования пациенты 1-й и 2-й групп имели более высокие значения по изучаемым параметрам цитокинового статуса по сравнению с группой контроля (статистически значимо). Так, у пациентов 1-й группы отмечены более высокие показатели TGF-β1 (p=0,002), ИЛ-1β (p=0,0023), ИЛ-6 (p=0,001) по сравнению с аналогичными параметрами цитокинового статуса группы контроля. У пациентов 2-й группы также получены результаты, отразившие статистически значимые высокие уровни TGF-β1(p=0,0011), ИЛ-1β (p=0,003), ИЛ-6 (p=0,002) по сравнению с аналогичными параметрами цитокинового статуса группы контроля. Подробно динамика изучаемых параметров представлена в табл. 2.
Было отмечено, что через 6 и 12 месяцев у пациентов как основной, так и группы сравнения произошло статистически значимое снижение уровня TGF-β1, ИЛ-1β и ИЛ-6 по сравнению с аналогичными показателями на V1. Однако у больных 1-й группы, которым на V2 был назначен повторно Алфлутоп в дозе 1 мл ежедневно внутримышечно длительностью 20 дней, отмечено дальнейшее статистически значимое снижение уровня TGF-β1, ИЛ-1β и ИЛ-6 при сравнении этих показателей между V2–V3. Несмотря на то что во 2-й группе больных также имело место снижение уровней TGF-β1, ИЛ-1β и ИЛ-6 между V2 и V3, оно не было статистически значимым. В группе контроля на всех визитах показатели цитокинового статуса не продемонстрировали статистически значимой динамики.
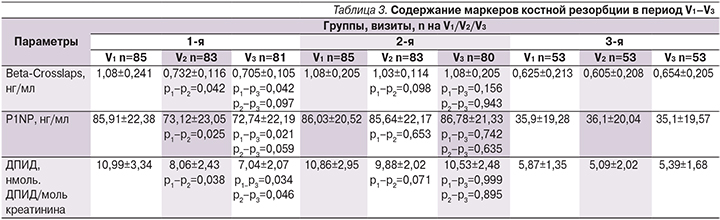
На начало исследования по данным дисперсионного анализа ANOVA установлено следующее: у пациентов 1-й группы отмечены более высокие показатели β-CrossLaps (p=0,028), P1NP (p=0,018), ДПИД (p=0,015) по сравнению с аналогичными у лиц группы контроля (статистически значимо). От пациентов 2-й группы также получены результаты, отразившие статистически значимые высокие уровни β-CrossLaps (p=0,026), P1NP (p=0,013), ДПИД (p=0,021) по сравнению с аналогичными показателями лиц группы контроля. Подробно динамика изучаемых маркеров костной резорбции представлена в табл. 3.
Нами установлено, что через 6 месяцев у пациентов основной группы произошло статистически значимое снижение изучаемых маркеров костной резорбции по сравнению с показателями на V1. Через 12 месяцев в этой группе отмечено дальнейшее снижение уровня Beta–Crosslaps, P1NP, ДПИД, однако статистически значимым оно было только для ДПИД. В группе сравнения не установлена статистически значимая динамика показателей костной резорбции на V2 и V3 по сравнению с показателями на V1, где все маркеры сохраняли свои значения практически без изменений к началу исследования.
Для уточнения характера взаимосвязи, влияния изменения уровня цитокинов и показателей костной резорбции нами проведен корреляционный анализ в каждой группе больных. Установлено, что на V2 у пациентов 1-й группы имели место статистически значимые корреляционные связи всех изучаемых параметров цитокинового статуса с маркерами костной резорбции. Выявлена статистически высокозначимая следующая корреляционная связь: β-CrossLaps с TGF-β1 (r=0,51; p=0,0014), ИЛ-1β (r=0,54; p=0,0022), ИЛ-6 (r=0,48; p=0,0017); P1NP с TGF-β1 (r=0,49; p=0,0021), ИЛ-1β (r=0,52; p=0,0038), ИЛ-6 (r=0,48; p=0,0064); ДПИД с TGF-β1 (r=0,46; p=0,0073), ИЛ-1β (r=0,43; p=0,0092), ИЛ-6 (r=0,45; p=0,0067).
Обсуждение
Проведенное нами исследование АЛЬБАТРОС стало пилотным в отношении изучения антирезорбтивно-цитокиновой эффективности хондропротективной терапии ОА и неспецифической боли в спине на фоне комплексной медикаментозной коррекции. Следует отметить ряд трудностей, с которыми мы столкнулись на этапе включения пациентов в исследование. В первую очередь это компенсированный соматический статус в отношении АГ и СД, а также формирование группы контроля, сравнимой по основным клинико-демографическим характеристикам, но без ОА и болей в нижней части спины. Однако задача протокола была выполнена в полном объеме и полученные нами данные достоверны.
Особо обращает внимание, что больные ОА на момент включения самостоятельно не предъявляли жалоб на боли в спине, т.к. основной повод обращения за медицинской помощью были боли и ограничение движений в коленном суставе. Но при оценке по ВАШ 100% пациентов основной группы и группы сравнения отметили уровень боли выше 0 мм. Все пациенты указали, что имели в анамнезе боли в нижней части спины (что являлось критерием включения) и неоднократно ранее проходили лечение у специа-листов различных профилей.
Фенотип больного ОА очень вариабельный, но сочетание повреждения периферического сустава и позвоночника встречается часто. С нашей точки зрения, такой вариант следует рассматривать как дегенеративно-дистрофический. Использование данного термина обоснованно и правомочно с точки зрения комплекса патофизиологических изменений в анатомических структурах позвоночника и периферического сустава, включая субхондральные костные структуры, с высокой вероятностью формирования хронического болевого синдрома. Известен ряд факторов, повышающих риск хронизации боли, в т.ч. женский пол, пожилой возраст, низкий социально-экономический статус [13, 14]. Однако вне зависимости от анатомического субстрата развития боли в спине данный процесс неизбежно сопровождается дегенеративно-дистрофическими процессами в межпозвонковых суставах с развитием артроза, формированием спондилолистеза (переднее или заднее смещение позвонка относительно выше- или нижележащего позвонка дегенеративного характера и/или вследствие сужения позвоночного канала) [15, 16].
Известно, что провоспалительные цитокины (ИЛ-1, ИЛ-6, фактор некроза опухоли α и TGF-β1) играют главную роль в прогрессировании ОА [17]. Цитокины нарушают метаболизм хондроцитов, что приводит к деградации хрящевой ткани и ремоделированию субхондральной кости в межпозвонковых суставах, а также в телах и дугоотростчатых суставах позвонков [18].
В исследованиях ряда авторов отмечено повышение уровня цитокинов у пациентов с дегенеративно-дистрофическими повреждениями позвоночника, хотя механизм и пути их вовлечения до конца неизвестны [19–23]. С учетом данных фактов для изучения воздействия хондропротективной терапии нами был выбран Алфлутоп – оригинальный хондропротектор, обладающий доказанным патогенетическим механизмом действия при дегенеративно-дистрофических процессах на молекулярном, генетическом и клеточном уровнях. Алфлутоп ингибирует гиалуронидазу и нормализует биосинтез гиалуроновой кислоты, снижает экспресиию генов ИЛ-1β, ИЛ-6, ИЛ-8 и ингибирует их внеклеточное высвобождение, а также снижает оксидативный стресс в хрящевой ткани [24–26].
В нашем наблюдении на V1 высокий уровень цитокинов у пациентов 1-й и 2-й групп был обусловлен активностью ОА, что подтверждено индексом WOMAC. Их снижение на V2 проходило на фоне терапии НПВС в обеих группах, что, безусловно, связано с механизмом действия данной группы препаратов. Однако нами отмечена дальнейшая динамика со статистически значимым снижением уровня TGF-β1, ИЛ-1β, ИЛ-6 у пациентов 1-й группы в условиях хондропротективной терапии при сравнении показателей на V2 и V3. У пациентов 2-й группы также отмечено снижение уровня изучаемых цитокинов, но без статистической значимости между V2 и V3. Следует отметить, что по результатам исследования на V3 уровень исследуемых цитокинов у пациентов 1-й и 2-й групп был выше, чем в группе контроля. При проведении дисперсионного анализа ANOVA у больных 1-й группы отмечены статистически значимо более высокие показатели TGF-β1 (p=0,031), ИЛ-1β (p=0,0042), ИЛ-6 (p=0,024) по сравнению с аналогичными параметрами цитокинового статуса у лиц группы контроля. От пациентов 2-й группы также получены результаты, отразившие статистически значимые высокие уровни TGF-β1 (p=0,013), ИЛ-1β (p=0,045), ИЛ-6 (p=0,027) по сравнению с аналогичными параметрами цитокинового статуса в группе контроля. Важно отметить, что, несмотря на достижение ремиссии и отсутствие активных жалоб на боли в суставах и спине и через 6 и 12 месяцев наблюдения, цитокиновый профиль включенных в исследование больных 1-й и 2-й групп был хуже, чем у лиц группы контроля.
Предполагаем, что обсуждаемый нами фенотип больного ОА – это пациенты не только с клиническими проявлениями боли и ограничением движений в спине и суставах в период обострения, но и с хронизацией болевого синдрома, поддерживающим механизмом которого является повышение концентрации провоспалительных цитокинов. Более того, считаем, что полученные нами данные могут служить материалом для дальнейших исследований и наблюдений в аспекте изучения цитокинового статуса как механизма длительной ноцицептивной активации, инициирующей рецидивы болевого синдрома и поддерживающей хронизацию боли.
Прогрессирование дегенеративно-дистрофического процесса невозможно обсуждать без акцента на механизмах резорбции в костной ткани.
В популяции большинство лиц с ОА – это женщины, что было подтверждено и в нашем исследовании. Известно, что снижение уровня эстрогенового фона оказывает системное воздействие на ткани суставов, как периферических, так и позвонков, и эти процессы нельзя рассматривать изолированно. Экспериментальные и клинические данные подтверждают существование остеопоротического фенотипа ОА [27]. Активность цитокинов способствует прогрессированию резорбтивных процессов в костной ткани. В частности, функционально TGF-β1 обеспечивает регуляцию ряда процессов в организме, в первую очередь механизма клеточного апоптоза во всех органах и тканях, дифференцировку клеток, в т.ч. ростков гемопоэза, а также реляцию различных реакций противовоспалительного и иммуносупрессивного действий [18]. В костной ткани TGF-β1 продуцируется остеобластами, оказывает тормозное влияние на процессы пролиферации остеокластов и одновременно активирует и стимулирует пролиферацию преостеобластов и их дифференцировку.
Исследование маркеров резорбции позволило нам продемонстрировать их более высокие показатели на начало исследования пациентов с ОА и болью в спине по сравнению с группой контроля. Полученные данные свидетельствуют об активности процессов костной резорбции у пациентов с ОА и болью в спине, что в свою очередь может стать отражением наличия остеопороза у данной группы больных. Следует отметить, что ранее остео-пороз у включенных в исследование пациентов верифицирован не был.
За весь период наблюдения отмечена и статистически подтверждена положительная динамика в отношении снижения маркеров резорбции на фоне хондропротективной терапии. Однако по аналогии с изучаемыми цитокинами значения Beta-Crosslaps, P1NP, ДПИД на V3 у пациентов 1-й и 2-й групп были выше, чем в группе контроля. При проведении дисперсионного анализа ANOVA у больных 1-й группы через год отмечены статистически значимо более высокие показатели β-CrossLaps (p=0,031), P1NP (p=0,024), ДПИД (p=0,042) по сравнению с аналогичными у лиц группы контроля. От пациентов 2-й группы также получены результаты, отражазившие статистически значимые высокие уровни β-CrossLaps (p=0,037), P1NP (p=0,028), ДПИД (p=0,005) по сравнению с аналогичными у лиц группы контроля. Это свидетельствует о том, что, несмотря на проведенную терапию с положительной динамикой в отношении снижения уровня цитокинов и маркеров костной резорбции, сохраняются патофизиологические механизмы, поддерживающие уровень воспаления и негативные изменения структуры костной ткани.
Полученные нами данные позволяют говорить о едином патогенетическом процессе дегенеративно-дистрофического повреждения костно-суставной ткани у пациентов с ОА и болью в нижней части спины с вовлечением и разрушением костной ткани. Эти больные с нарушенной биомеханической функцией позвоночника и периферических суставов требуют особого подхода с использованием различных стратегий лечения и клиническим пониманием, что именно эту группу актуально рассматривать с точки зрения высоких рисков переломов, обусловленных остеопорозом. Однако, как бы ни были привлекательны те или иные лекарственные средства и способы немедикаментозной коррекции, сегодня необходимо глубокое понимание патофизиологических изменений, происходящих как в суставе, так и в позвоночнике, с учетом единых биомеханических взаимоотношений костно-мышечного и суставного аппарата.
Заключение
Проведенное нами исследование АЛЬБАТРОС показало, что пациенты с ОА и болью в спине имеют повышенные уровни цитокинов и маркеров костной резорбции как отражение единого патофизиологического механизма повреждения костно-мышечно-суставной ткани. В связи с этим целесообразно обсуждать дегенеративно-дистрофический фенотип больного ОА с высоким риском развития остеопороза и переломов.
Отмечено статистически значимое снижение уровня цитокинов и маркеров костной резорбции в группе больных, получавших курсы препарата Алфлутоп двукратно в течение года в комплексном лечении НПВС.
Полученные результаты позволяют рассматривать хондропротективную терапию Алфлутопом в стратегии лечения больных ОА и болью в спине с точки зрения ее антирезорбтивно-цитокиновой эффективности.
Признаем, что наше исследование имело ряд ограничений, в первую очередь в результате изучения небольшой выборки, что не позволяет в полной мере сформулировать популяционные выводы. Но мы сочли возможным предоставить полученные данные, т.к. необходимо дальнейшее изучение фенотипа больного ОА и неспецифической болью в спине.
Декларация о финансовых и других взаимоотношениях
Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Исследование не имело спонсорской поддержки.
Исследование не преследовало цели оценить клиническое превосходство конкретного лекарственного средства. В случае возникновения спорных вопросов авторы готовы предоставить протокол исследования и первичную документацию в полном объеме.
Авторский вклад: концепция и дизайн исследования – И.А. Золотовская, И.Л. Давыдкин; получение данных, обработка данных, анализ и интерпретация результатов, написание статьи – И.А. Золотовская; утверждение рукописи для публикации – И.А. Золотовская, И.Л. Давыдкин.


