Вирусные кишечные инфекции (ВКИ) – одна из актуальных проблем здравоохранения, наносящая значительный экономический ущерб как нашей стране, так и всему миру [1, 2]. Уровень заболеваемости ВКИ среди детей значительно выше, чем среди взрослых, а наибольшее число регистрируемых случаев приходится на детей в возрасте до 7 лет [3, 4]. Среди возбудителей ВКИ у детей не менее половины всех случаев приходится на ротавирусную инфекцию (РВИ), около четверти – на норовирусную [5, 6]. Значительна также доля сочетанной рота-норовирусной инфекции (РНВИ) [7], приводящей к развитию не менее 3–8% верифицированных эпизодов острых кишечных инфекций (ОКИ) у детей [8].
Накопленный к сегодняшнему дню объем знаний в области клинической иммунологии показал, что необходимым условием для понимания манифестации, развития и исхода любого инфекционного процесса служит описание его иммунопатогенеза с учетом механизмов защитных реакций организма. Однако, несмотря на массу публикаций, посвященных эпидемиологии, клиническому течению и лечению ОКИ ротавирусной этиологии, особенности иммунного ответа при РВИ изучены недостаточно и носят фрагментарный характер. Иммунологические особенности норовирусной инфекции (НВИ), а также сочетанной с РНВИ освещены в единичных публикациях и представляют несомненный научный интерес для дальнейшего исследования.
Целью работы стало изучение особенностей параметров иммунограмм у детей с ВКИ, вызванной рота- и норовирусами в острый период заболевания и в период реконвалесценции.
Материал и методы
Было проведено иммунологическое исследование 41 ребенка в возрасте от 1 года до 7 лет: c РВИ (n=20), НВИ (n=11) и РНВИ (n=10), проходивших лечение в 2015–2016 гг. в отделе кишечных инфекции ДНКЦИБ ФМБА России. У 8 (19,5%) детей имела место тяжелая форма ВКИ, у 33 (80,5%) – средней тяжести. Группы были сопоставимыми по полу (U-тест: p=0,97), возрасту (H=0,69; p=0,71) и тяжести инфекции (H=5,03; p=0,18).
Параметры оценивались в динамике дважды: в разгар заболевания (3–5-е сутки болезни, период I) а также в период реконвалесценции (18–21-й день болезни, период II). Принимая во внимание наличие общих закономерностей в иммунном реагировании при вирусных инфекциях различной этиологии [9], результаты иммунологического исследования оценивались с учетом не только этиологии, но и суммарно – без учета таковой.
Иммунологическое исследование включало:
- изучение лейкограммы с определением уровня основных субпопуляций лейкоцитов;
- определение концентрации сывороточных иммуноглобулинов классов иммуноглобулин А (IgА), IgМ, IgG;
- определение интерферонового статуса.
Изучение параметров иммунного статуса больных проведено на базе лаборатории иммунологии ФГБУН НИИ ЭМ им. Пастера.
Исследование лейкограммы крови осуществлено стандартным методом. Фенотипирование лимфоцитов проведено в лимфоцитотоксическом тесте с использованием МКАТ серии ИКО (НГЩ «Медбиоспектр», Москва): анти-CD3, анти-СD4, анти-СD8, анти-СD16, анти-СD20, анти-СD25, анти-СD5, путем сравнения их с референсными значениями [10].
Оценка концентрации сывороточных иммуноглобулинов классов IgА, IgМ, IgG осуществлено методом радиальной иммунодиффузии по G. Manchini с использованием моноспецифических антисывороток производства НИИ особо чистых биопрепаратов.
Уровень индуцированной вирусами продукции интерферона-α (ИФН-α) и ИФН-β лейкоцитами, а также продукцию ИФН-γ, индуцированного фосфоглицериновым альдегидом, определен по методу С. Григорян [11].

Результаты исследования
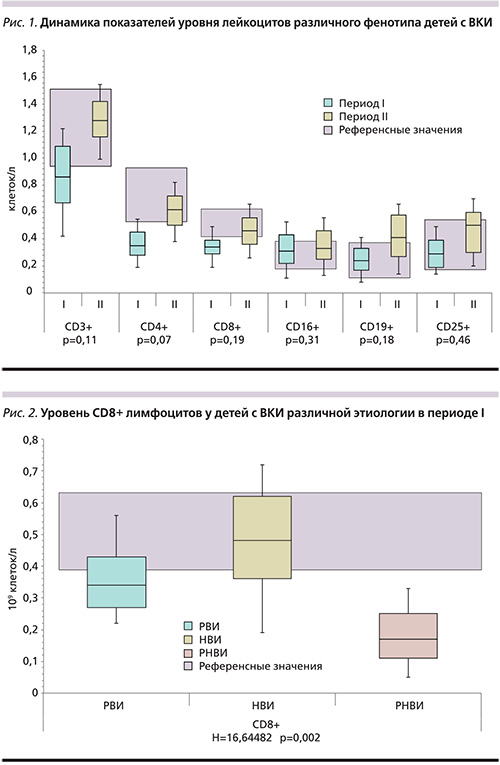
При оценке уровня субпопуляций лимфоцитов в острый период инфекционного процесса вне зависимости от этиологии ОКИ отмечена отчетливая тенденция к снижению относительного и общего числа зрелых CD3+-лимфоцитов: CD3+-, CD4+-Т-хелперов и цитотоксических CD3+-, CD8+-Т-лимфоцитов по сравнению с референсными значениями. Указанные изменения большинство исследователей объясняют способностью рота- и норовирусов индуцировать апоптоз лимфоцитов [12, 13]. Результаты определения уровня лимфоцитов различных фенотипических классов представлены на рис. 1.
В I период средний уровень CD16+-натуральных киллеров, CD19+ зрелых В-лимфоцитов и CD25+-активированных лимфоцитов с рецептором интерлейкина-2 находился в пределах референсных значений, однако при детальном анализе показателей иммунограмм отдельных пациентов обращало на себя внимание наличие большого разброса значений относительных уровней субпопуляций лимфоцитов, более заметное в отношении CD19+- и CD25+-лимфоцитов, вероятно связанное с индивидуальными особенностями иммунного реагирования детей.
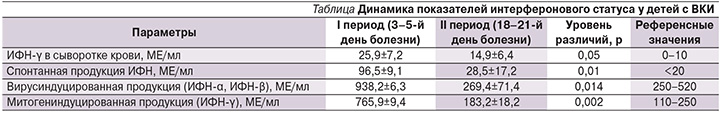
Сопоставление результатов фенотипирования лимфоцитов при ВКИ различной этиологии не позволило выявить значимых отличий в уровне CD4+-Т-хелперов (H=0,77; p=0,68), CD16+-натуральных киллеров (H=1,457; p=0,68), CD19+-В-лимфоцитов (H=2,89; p=0,24) и CD25+-лимфоцитов (H=0,15; p=0,92) в I периоде исследования. Отмечена тенденция к снижению CD8+ зрелых Т-лимфоцитов у пациентов с РНВИ и РВИ по сравнению с нормальными значениями и отсутствие подобных изменений у пациентов с НВИ (H=4,5; p=0,11), что совпадает с результатами, полученными другими авторами [14], и могут быть объяснены как прямым цитопатическим воздействием вирусов, так и интенсификацией механизмов апоптоза лимфоцитов. Стоит заметить, что более выраженное уменьшение числа цитотоксических CD8+-лимфоцитов (0,15±0,04×109 клеток/л) было выявлено у детей с РНВИ (рис. 2).
Во II периоде отмечена нормализация показателей абсолютного и относительного содержания основных субпопуляций лимфоцитов. Уровень CD19+ зрелых В-лимфоцитов демонстрировал тенденцию к умеренному повышению по сравнению с референсными значениями, что, вероятно, свидетельствует о поляризации иммунного ответа и об активизации синтеза защитных антител во II периоде исследования.
При анализе результатов фенотипирования лимфоцитов у детей в зависимости от тяжести ОКИ установлено, что у пациентов с тяжелой формой ВКИ в I периоде имело место достоверное снижение уровня зрелых CD3+-лимфоцитов по сравнению с пациентами со среднетяжелой формой заболевания (0,76±0,19×109 и 0,94±0,13×109 клеток/л соответственно; p=0,02) и CD3+, CD8+ эффекторных лимфоцитов (0,46±0,11×109 и 0,54±0,09×109 клеток/л соответственно; p=0,04). Во II периоде у детей с тяжелой ВКИ отмечен более высокий уровень CD16+ натуральных киллеров, чем у детей со среднетяжелой формой (0,46±0,11×109/л и 0,32±0,09×109/л соответственно; p=0,01), одновременно со сниженными показателями содержания зрелых B-лимфоцитов (0,33±0,09×109/л и -0,53±0,11×109/л соответственно; p=0,009).
Косвенным подтверждением важной роли механизмов программируемой клеточной гибели в снижении уровня иммунных клеток служит сочетание у пациентов с выраженным снижением эффекторных Т-лимфоцитов низкого уровня ИФН-γ, служащего одним из ключевых цитокинов, обеспечивающих выживание иммунных клеток за счет стимуляции пролиферации и устойчивости лимфоцитов [15].
При оценке антителообразования в I периоде не было выявлено отличий среднего уровня сывороточных иммуноглобулинов всех исследуемых классов от референсных значений.
У части детей (n=7; 17,1%) имело место умеренное снижение уровня IgG. Содержание сывороточных иммуноглобулинов в I и II периодах исследования представлено на рис. 3.
Во II периоде наблюдалось повышение среднего уровня иммуноглобулинов, статистически значимое для IgA. Данные результаты подтверждают, что окончательное выздоровление от ВКИ связано с влиянием факторов гуморального иммунитета, в частности с действием IgA. Отмечена статистически незначимая тенденция к менее выраженной продукции IgA и IgG при НВИ по сравнению с РВИ и РНВИ (H=12,7; p=0,1). Анализ показателей уровней IgG и IgM также не позволил выявить статистически значимых отличий между пациентами с ВКИ различной этиологии.
Тяжесть ВКИ не оказывала влияния на средний уровень IgM и IgG ни в I, ни во II периодах. В то же время из 9 (22,0%) детей, у которых уровень IgA во II периоде не был повышен, 5 (12,2%) страдали тяжелой формой ВКИ. Средний уровень IgA при тяжелой форме заболевания был достоверно ниже, чем при среднетяжелой (2,31±0,35 и 4,23±1,32 г/л соответственно; p=0,01). В литературе найдены данные, свидетельствующие о важной роли IgA, в частности его секреторной фракции в противовирусном иммунитете [16]. Несмотря на то что определение уровня секреторного IgA в данном исследовании не проводилось, выявленные особенности изменения концентрации сывороточного IgA свидетельствуют о важной роли антител данной группы в противовирусной защите при ВКИ.
Изменения интерферонового статуса у детей с ВКИ в I периоде исследования характеризовались повышением уровня сывороточного ИФН-γ, а также продукции ИФН по сравнению с референсными значениями. Наиболее выраженное изменение отмечено в отношении митогениндуцированной продукции ИФН-γ (средний уровень более чем в 3 раза превысил максимальное значение референсных показателей). Результаты оценки интерферонового статуса пациентов в динамике наблюдения представлены в таблице.
Во II периоде наблюдалось статистически значимое снижение всех показателей интерферонового статуса до нормальных значений (для митогениндуцированной и вирусиндуцированной продукции ИФН).

Среднее содержание ИФН-γ в сыворотке как в I, так и во II периоде достоверно не отличалось у детей с ВКИ различной этиологии (H=10,01; p=0,07 и H=0,77 соответственно; p=0,17). Выявить корреляцию между средней продукцией ИФН-γ и тяжестью ВКИ в I периоде не удалось. При среднетяжелых формах ВКИ имело место большое разнообразие значений сывороточного ИФН-γ, по-видимому отразившее индивидуальные особенности иммунного реагирования детей.
В то же время при сопоставлении уровня сывороточного ИФН-γ во II периоде было выявлено значимое повышение данного показателя у детей с тяжелой формой заболевания (рис. 4).
Сохранение повышенного уровня ИФН-γ как в I, так и во II периодах, характерное для тяжелых форм ВКИ у большей части детей (n=6; 75%), контрастировало с данными, полученными для ВКИ средней тяжести, при которых наблюдалось высокое содержание ИФН-γ в I периоде и его полная нормализация во II периоде у всех пациентов.
Таким образом, в иммунном ответе при ВКИ принимают участие различные звенья иммунного ответа, роль каждого из которых меняется в зависимости от периода инфекционного процесса. В острый период ВКИ отмечается повышение сывороточного уровня ИФН-γ, а также снижение уровней CD3+-, CD4+-Т-хелперов и цитотоксических CD3+-, CD8+-лимфоцитов, более выраженное при РВИ и РНВИ, чем при НВИ, причем для CD3+-лимфоцитов и CD8+-лимфоцитов выявленное снижение количества коррелировало с тяжестью инфекционного процесса. В период реконвалесценции отмечается нормализация уровня основных субпопуляций лимфоцитов и умеренное повышение числа зрелых В-лимфоцитов, отражающих активное вовлечение гуморального звена иммунной системы на поздних этапах противовирусного иммунного ответа.



