Введение
По данным различных авторов, частота кровотечений из нижних отделов пищеварительного тракта как причина госпитализации составляет порядка 20–30 случаев на 100 тыс. взрослого населения в год [1, 2]. К причинам толстокишечных кровотечений (ТКК) наиболее часто относятся дивертикулез, артериовенозные мальформации, ишемический колит, воспалительные заболевания толстой кишки (ВЗТК), инфекционные колиты, неоплазии. Также встречаются постполипэктомические кровотечения, кровотечения из области анастомозов после оперативных вмешательств и после проведения лучевой терапии [1–6]. Интенсивность их может варьироваться от умеренной до массивной кровопотери, угрожающей жизни пациента. Для пациентов, находящихся на лечении в отделениях реанимации и интенсивной терапии (ОРИТ), риск массивной кровопотери сопряжен с коагулопатией, формирующейся на фоне осложненного течения основного заболевания либо его декомпенсации. Коагулопатия может быть обусловлена многими факторами, например массивной кровопотерей во время предшествующего оперативного вмешательства, в т.ч. после многократных повторных операций, применением антикоагулянтов и дезагрегантов пациентами, которым выполняли протезирование клапанов, реконструктивно-пластические операции на магистральных артериях и аорте, наблюдается при септических состояниях [7]. К вынужденной гипокоагуляции прибегают при необходимости проведения экстракорпоральных методов лечения при выраженной почечной и печеночной недостаточности, полиорганной недостаточности [8].
Кровотечения из толстой кишки, возникающие на фоне таких состояний, являются сложными для эндоскопической диагностики и лечения ввиду тяжести состояния пациента [9]. Не вызывает сомнений необходимость использования эндоскопических методов исследования для диагностики и лечения данной патологии, однако продолжительность эндоскопических исследований и манипуляций у данного контингента больных значительно ограничена [1–5].
В настоящее время существуют разнообразные методики эндоскопического гемостаза: механические (клипирование, лигирование), коагуляция, инъекционный метод, аппликация гемостатических препаратов. Выбор метода эндоскопического воздействия определяется характером выявленного источника кровотечения [1, 2, 4, 10, 11]. Наибольшую проблему для проведения эндоскопического гемостаза представляют случаи, в которых имеется обширная площадь поражения с диффузным капиллярным кровотечением, особенно у пациентов с нарушениями свертывания крови [10].
Цель работы: оценить возможности диагностической колоноскопии (КС) и эндоскопического гемостаза при кровотечениях из толстой кишки у пациентов из ОРИТ.
Материал и методы
С 2012 по 2015 г. (за 3 года) в ОРИТ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского было выполнено 22 срочных КС для диагностики источника кровотечения, проведения эндоскопического гемостаза и определения тактики дальнейшего лечения. В данной работе нами не рассматривались результаты плановых КС, проведенных с целью диагностики патологии ТКК при хронической анемии, ректальных кровотечениях, ранее диагностированных воспалительных заболеваниях толстой кишки и других состояниях, обусловливающих кровопотерю менее 200 мл/сут. Также в исследование не включали пациентов с осложненным течением послеоперационного периода после полипэктомии и случаи, в которых источник кровотечения был локализован в прямой кишке (неоплазии, варикозные вены прямой кишки). Исключили пациентов, у которых источник кровопотери был выявлен только в верхних отделах пищеварительного тракта (ВОПТ).
Для проведения КС использовали видеоэндоскопическую систему Olympus EVIS EXERA II и колоноскоп Olympus CF-Q 165L (Япония), однако в подавляющем большинстве случаев (когда исследования проводили в ОРИТ №2, куда невозможно было доставить видеоэндоскопическую систему) использовали фиброколоноскоп Olympus CF 10L (Япония).
Для эндоскопического лечения выявленных ТКК применяли такие методы, как эндоскопическое клипирование, орошение препаратом Гемоблок, инъекционный гемостаз, эндоскопическое распыление гемостатических порошков (Эндоклот и Желпластан), а также комбинацию вышеперечисленных способов.
Эндоскопическое клипирование с использованием металлических клипс осуществляли вращающимся клипатором HX-110UR (Olympus, Япония).
Ирригацию препарата Гемоблок (1% раствор в количестве от 20 до 50 мл) осуществляли через промывочную трубку (катетер) PW-1V-1 (Olympus, Япония). Это медицинское средство является местным гемостатиком и зарегистрировано в России как медицинское изделие. В его состав входит неполная серебряная соль полиакриловой кислоты, содержащая наночастицы серебра, это обусловливает выраженное бактерицидное и бактериостатическое действие. Гемостатический эффект достигается за счет образования компонентами препарата сгустка с белками плазмы крови (главным образом, альбумином). Последние исследования, проведенные в лаборатории Московского областного НИИ крови, показали, что механизм действия данного препарата не зависит от концентрации белковых кровесвертывающих факторов в плазме крови, но зависит, главным образом, от содержания альбумина. На первом этапе действия складывается полиакриловая матричная структура, содержащая молекулы альбумина в ячейках полиакриловой матрицы. Такая структура является первичной и время ее существования невелико, поскольку полиакрилат-анион не образует сильных связей с молекулами белка и удерживается лишь за счет слабых взаимодействий. Однако эта структура является первичным организатором устойчивой пленки. На следующем этапе ионы серебра восстанавливаются молекулами альбумина, образуя устойчивый комплекс: полиакрилат-анионы образуют прочную связь с положительно заряженными молекулами белка. Такая структура упаковывается в несколько микрослоев, создавая прочную полиметакрилатную пленку на поверхности раны. При этом восстановленное металлическое серебро в комплексе с белками является мощным бактерицидным фактором, что и обеспечивает отсутствие нагноений. В дальнейшем поверхностная структура гемоблок- белок замещается фибрином. А полиакрилатная матрица плазмолизуется в течение суток.
В состав EndoClot PHS входит гомеостатический порошковый субстрат, созданный по инновационным технологиям и содержащий рассасывающиеся модифицированные полимеры (AMP). Полисахарид AMP® – вещество растительного происхождения, является биосовместимым, апирогенным, нетоксичным. Для эндоскопического нанесения этого препарата применяли созданный по инновационным технологиям аппликатор, который включает в себя катетер и специально разработанную смесительную камеру, подключенную к контейнеру с порошковым субстратом и внешней помпе для нагнетания воздуха. Принцип действия этого порошка основан на быстром поглощении жидкой составляющей крови. Процесс дегидратации приводит к повышению концентрации тромбоцитов, эритроцитов и белков (тромбоцитов, фибриногенов и т.д.), что запускает нормальный процесс каскадного тромбообразования. При контакте с кровью частицы полисахарида формируют гелеобразный клейкий матрикс, который обеспечивает механический барьер, предотвращающий дальнейшее кровотечение. Рассасывание продукта занимает несколько дней, что зависит от количества использованного вещества и места применения. Частицы полисахарида расщепляются амилазой и глюкоамилазой.
Препарат Желпластан представляет собой аморфно-кристаллический порошок, который содержит лиофилизированную плазму крови крупного рогатого скота, канамицина моносульфат, желатин пищевой. При нанесении оказывает местное кровоостанавливающее, бактерицидное и заживляющее действия. Для эндоскопического нанесения данного порошкового субстрата была разработана специальная помпа. Принцип действия препарата основан на том, что при непосредственном контакте с кровоточащей поверхностью желатиновая матрица с заданным оптимальным размером ячеек быстро поглощает жидкую составляющую крови, формирует гелеобразный водо- и воздухонепроницаемый структурно устойчивый сгусток и тем самым создает механическую преграду дальнейшему кровотечению. Входящая в состав препарата лиофилизированная плазма крови крупного рогатого скота выступает в роли природного концентрата тромбина и фибриногена. Подобно естественному тромбину плазменный тромбин, входящий в состав, способствует превращению фибриногена в фибрин и образованию кровяного сгустка на раневой поверхности. Одновременно с этим волокна экзогенного коллагена, попадая на рану в составе препарата, подобно коллагеновым волокнам поврежденных кровеносных сосудов способствует активации коагуляционного гемостаза по внутреннему пути (с участием ХII и ХI факторов, прекалликреина, высокомолекулярного кининогена), а также с образованием тромбина и нитей фибрина. Дальнейшая необратимая агрегация тромбоцитов приводит к образованию фибринового сгустка, закрытию места повреждения и полной остановке кровотечения.
Результаты
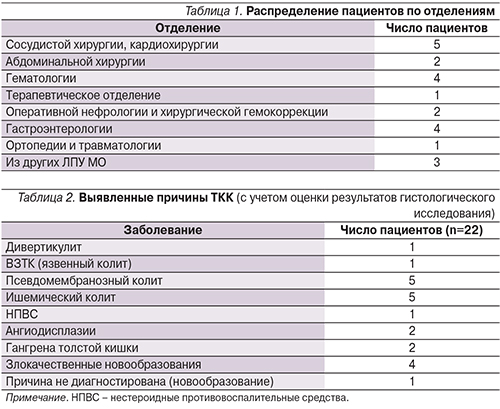
Среди 22 пациентов (13 мужчин и 9 женщин) в возрасте от 25 до 81 года (среднее возраст составил 57,7±2,9 года). Эндоскопические исследования у всех пациентов были выполнены в ОРИТ, куда пациенты были переведены из других отделений института или других лечебно-профилактических учреждений (ЛПУ) Московской области в связи с необходимостью проведения специализированной интенсивной терапии. Продолжительность пребывания в ОРИТ – от 1 до 53 суток, в среднем 13,6±3,2 суток. Исходно пациенты поступали для проведения лечения в различные отделения МОНИКИ (табл. 1).
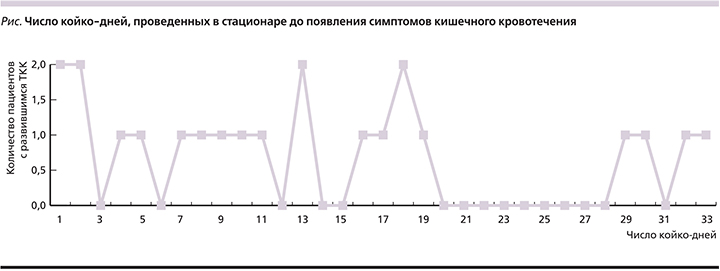
Число койко-дней, проведенных в стационаре (МОНИКИ) у данных больных варьировалось от 5 до 75 и в среднем составило 35,1±3,9 дня. Число койко-дней, проведенных в стационаре до появления симптомов кишечного кровотечения отражено на диаграмме (см. рисунок) и составило от 1 до 33 койко-дней, в среднем – 13,5±2,2 койко-дня. Два пациента поступили для проведения лечения основной патологии с клиникой сопутствующего продолжающегося кишечного кровотечения.
Состояние всех пациентов с развившимися ТКК, которым выполнили срочные эндоскопические исследования, расценивалось как тяжелое. Тяжесть его, в основном, определялась основным заболеванием и в ряде случаев отягощалась массивной кровопотерей.
У 6 пациентов срочная КС была проведена в первые 6 часов от момента диагностики кишечного кровотечения, у 11 пациентов от выявления признаков ТКК до исследования прошло более 6, но менее 12 часов, у 6 – более 12, но менее 24 часов.
Без проведения специальной подготовки к исследованию было выполнено 5 КС, с помощью очистительных клизм готовили 17 пациентов, 4 больных принимали препараты перорально для подготовки методом кишечного лаважа.
Уровень осмотра ограничивался из-за тяжелого и крайне тяжелого состояний пациентов с учетом того, что исследования проводились в условиях недостаточной подготовки или вовсе без нее. Тотальная КС была выполнена 9 больным, неполный осмотр проведен у 13, в т.ч. только ректосигмоскопия – у 10 больных. У 2 пациентов исследование было прервано в связи с критическим ухудшением соматического состояния. У 4 пациентов диагностическую и лечебную КС завершали до достижения купола слепой кишки в связи с риском ятрогенного повреждения (перфорации) при дивертикулезе (1 пациент), гангрене толстой кишки (1 пациент), ишемическом колите с обширными зонами некроза стенки толстой кишки (2 пациента). Шести пациентам тотальную КС не выполнили в связи с крайне тяжелым соматическим состоянием при выявлении очевидных признаков патологии, вызвавшей кровотечение. Одному пациенту с аденокарциномой, сузившей просвет сигмовидной ободочной кишки, колоноскоп был проведен только до ректосигмоидного перехода, где находилась опухоль.
Выявить и верифицировать (с помощью визуального осмотра, морфологически по результатам гистологического исследования, на основании других лабораторных анализов, в частности посевов и серологических исследований на Clostridium difficile), источник кровотечения в толстой кишке при эндоскопическом исследовании удалось установить 21 больному из 22 (табл. 2). Одному пациенту инвазия злокачественной опухоли в толстую кишку, ставшая причиной ТКК, была диагностирована лишь при аутопсии. Число проведенных диагностических эндоскопических исследований толстой кишки варьировалось от 1 до 3.
В случаях диагностики ангиодисплазий многократные исследования проводились двум пациентам и при кровотечении из аррозированного сосуда устья дивертикула одному пациента, что обусловлено трудностями эндоскопической верификации данной патологии. Пяти пациентам повторные КС были назначены по причине неудовлетворительных результатов подготовки к предыдущим исследованиям, в случае сохраняющейся необходимости диагностики патологии толстой кишки (продолжение или рецидив ТКК). Биоптаты при КС для морфологической верификации выявленных изменений были получены от 15 больных.
По интенсивности кишечные кровотечения подразделялись на капиллярные (14 пациентов) и профузные (8). При анализе факторов риска и рецидивов кровотечений было выявлено, что на фоне введения антикоагулянтов, дезагрегантов и фибринолитиков развилось 9 ТКК. У 11 пациентов с синдромом острой почечной и/или печеночной недостаточности, обусловленным основным заболеванием, ТКК были ассоциированы с проведением экстракорпоральных методов гемокоррекции и детоксикации и/или заместительной почечной терапии (гемофильтрация, гемодиафильтрация, гемосорбция, гемодиализ). Двое пациентов с миелодиспластическими синдромами страдали выраженной тромбоцитопенией. У 10 пациентов ТКК развивались на фоне коагулопатии, подтвержденной данными лабораторных исследований, в т.ч. у 3 был диагностирован синдром диссеминированного внутрисосудистого свертывания (ДВС). Такие нарушения были отмечены в случае предшествовавших продолжительных и осложненных массивной кровопотерей оперативных вмешательств (4 пациента), при сепсисе (1 пациент), при сопутствующих кровотечениях из ВОПТ (6 пациентов), из трахеобронхиального дерева (1 больная). У 3 пациентов в анамнезе до эпизода ТКК была длительная хроническая кровопотеря.
Для диагностики источника и дифференциальной диагностики кровотечений из верхних и нижних отделов желудочно-кишечного тракта также выполняли эзофагогастродуоденоскопию. У 15 пациентов были выявлены сопутствующие эрозивно-язвенные поражения ВОПТ, из них у 9 с признаками состоявшегося или продолжающегося кровотечения (проведен эндоскопический гемостаз). У трех пациентов кровотечение из ВОПТ по интенсивности и объему значительно превышало кровопотерю из источников, локализованных в толстой кишке. Массивная кровопотеря одновременно из эрозивно-язвенных дефектов и верхних, а также нижних отделов желудочно-кишечного тракта была у 1 больного.
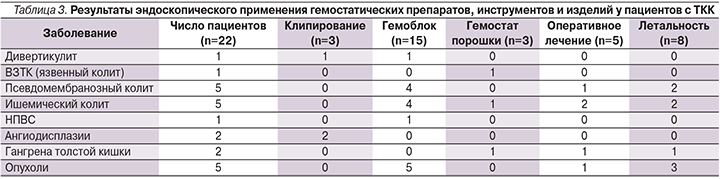
Эндоскопический гемостаз был выполнен 21 пациенту. Для одного больного с гангреной сигмовидной кишки при выявлении данной патологии лечебное эндоскопическое вмешательство было нецелесообразным ввиду необходимости экстренной лапаротомии. Для троих больных проведение эндоскопического гемостаза для снижения интенсивности ТКК было методом выбора в связи с невозможностью провести оперативное вмешательство (неоперабельные).
Успешная эндоскопическая безрецидивная остановка кровотечения была достигнута у 12 (55%) больных. У 6 (27%) больных на фоне ДВС и коагулопатии при сомнительном прогнозе течения основного заболевания ТКК рецидивировали неоднократно, что требовало повторных лечебных эндоскопических вмешательств. Во всех случаях при повторных КС проводили орошение кровоточащих дефектов Гемоблоком, сводя к минимуму интенсивность и объем кровопотери.
Для локальных источников кровопотери (ангиодосплазии и аррозированный сосуд дивертикула толстой кишки) использовали клипирование (1 пациент) и комбинированный эндогемостаз Гемоблок+клипирование (2 больных). Во всех трех случаях рецидива кровотечения не отмечено.
В случае выявления обширной кровоточащей поверхности (18 больных) проводили ее орошение препаратом Гемоблок (15 больных) и эндоскопическое распыление гемостатических порошков Эндоклот (1 больной) и Желпластан (2 больных). В результате успешная безрецидивная остановка диффузных ТКК была достигнута в отношении 9 (50%) пациентов: у 6 – препаратом Гемоблок, в 2 случаях – Желпластаном. Четырем пациентам применение препарата Гемоблок позволило остановить ТКК, стабилизировать состояние пациентов, подготовить и успешно провести оперативное лечение по жизненным показаниям в объеме субтотальной колэктомии и гемиколэктомии. Результаты проведенного эндоскопического воздействия отражены в табл. 3.
Обсуждение
Трудности эндоскопической диагностики и лечения кровотечений из толстой кишки пациентов ОРИТ обусловлены многими факторами: тяжестью их состояния, вынужденным положением, в большинстве случаев невозможностью провести адекватную полноценную подготовку. Общее состояние пациентов и перенесенные на брюшной полости оперативные вмешательства у 7 (32%) пациентов не позволили провести полноценную инсуффляцию воздуха для осмотра толстой кишки, а также ограничивали применение порошкообразных гемостатических препаратов. Очищение кишечника клизмами для подготовки к исследованию, проведенное 17 (77%) пациентам, позволило выявить патологию при первой диагностической КС только у 12 (71%) человек, т.к. наличие в просвете кишечника массы промывных вод с геморрагическими сгустками и остатками каловых масс, напротив, значительно препятствует осмотру. В таких случаях многие авторы рекомендуют проводить исследование без подготовки [1, 10]. В нашем исследовании 4 из 5 пациентов, которым подготовку перед осмотром толстой кишки не проводили, удалось успешно диагностировать источник кровотечения и провести эндоскопический гемостаз.
При сравнении методик эндоскопического гемостаза, примененных в данном исследовании, эндоскопическое клипирование показало высокую эффективность при выявлении локальных источников кровотечения. В отличие от других исследований, где широко применяли электро- и термокоагуляцию, для данной группы пациентов они были патогенетически не обоснованы (дополнительный повреждающий фактор), потому ограничены к применению [1, 4, 6].
Нанесение гемостатических порошков показало достаточную эффективность при капиллярных кровотечениях и наличии большой площади поражения [10]. В данной группе больных эта методика, несмотря на хорошие результаты, оказалась ограниченной к применению, поскольку сопряжена с избыточной инсуффляцией, технической сложностью применения. Препарат Гемоблок в отличие от гемостатических порошков не требует специальных средств и навыков для эндоскопического нанесения, не препятствует визуализации после его применения.
В данной группе пациентов его использование было патогенетически обоснованным, поскольку в большинстве случаев кровотечения развивались на фоне коагулопатии, и эффективным.
Выводы
Эндоскопическая диагностика и лечение ТКК у пациентов ОРИТ относится к числу сложных лечебных мероприятий, требующих специальной подготовки и большого опыта работы. Наибольшую проблему для проведения эндоскопического гемостаза представляют диффузные капиллярные кровотечения при распространенных поражениях. В данном исследовании было выявлено, что современные высокотехнологичные материалы для эндоскопического гемостаза позволяют своевременно, патогенетически обоснованно и безопасно проводить местное воздействие на источник кровотечения. При лечебных КС в условиях реанимационных отделений большое значение имеет техническая простота применения гемостатических средств. Гемостатические препараты могут более широко использоваться для эндоскопической остановки кровотечений из толстой кишки.


