Введение
Фиброз – это универсальный ранозаживляющий механизм, при котором поврежденные участки ткани инкапсулируются внеклеточным каркасным веществом или экстрацеллюлярным матриксом, т.е. рубцуются [1, 2]. Клеточные и растворимые факторы, участвующие в этом механизме в печени, схожи с таковыми, вовлеченными в процесс фиброзирования при паренхиматозном повреждении почек, легких или кожи [3]. Таким образом, вне зависимости от локализации повреждения в организме механизм заживления один и тот же.
Хроническое повреждение печени, которое наблюдается при гепатите С, приводит к возникновению и прогрессированию фиброза [4, 5]. Основным условием для прогрессирования фиброза является хронический характер повреждения [5]. В конечном итоге прогрессирующий фиброз приводит к циррозу печени, жизнеугрожающему состоянию, для которого характерно формирование узлов регенерации и уменьшение органа в целом [7, 8].
Стадия фиброза является показателем таковой заболевания и степени его тяжести при хроническом гепатите С. Кроме того, схема и продолжительность терапии гепатита С во многом определяются стадией фиброза печени [6].
Наибольшее признание в гепатологической практике получили 3 шкалы оценки стадии печеночного фиброза, основанные на системе баллов:
1) шкала METAVIR, 2) индекс гистологической активности (ИГА) с оценкой стадии фиброза по Knodell и 3) модифицированный индекс гистологической активности с оценкой стадии фиброза по Ицхаку (Ishak). Каждой стадии фиброза в этих шкалах соответствует определенная гистологическая картина, полученная в результате биопсии печени. Чаще других для определения стадии фиброза при хроническом гепатите С в последние годы используется балльная шкала, разработанная группой французских исследователей METAVIR, отличительной чертой которой является независимость разграничения стадий фиброза от степени активности воспаления [9–12].
Методы диагностики фиброза печени подразделяются на инвазивные (биопсия печени) [13, 19] и неинвазивные, включающие а) инструментальные методы (транзиентная эластография, используемая в приборе Фиброскан® [14, 15], эластография сдвиговой волной [Share Wave Elastography, SWE], применяемая в ультразвуковом сканнере AiXplorer® [16] и б) сывороточные маркеры (Фибротест® [17] и др.).
В последние годы все большее распространение получают неинвазивные методы диагностики фиброза, что обусловлено двумя причинами:
- их возросшая точность [18];
- ограничения применения биопсии печени [19].
Диагностический метод пункционной биопсии печени имеет три основных ограничения: риск побочных эффектов [20], ошибки при заборе биоптата [21] и расхождения в трактовке разными морфологами одного и того же образца, а иногда и расхождения трактовок одного и того же образца, выполненных повторно в разное время, одним и тем же морфологом [22]. Анализ соответствующих публикаций выявляет 3 категории рисков пункционной биопсии печени: боль (около 30 на 100 случаев), выраженные побочные явления (3 на 1000 случаев) и смерть (3 на 10 тыс. случаев) [20]. Ошибки при заборе биоптата являются основной причиной вариабельности результатов [21, 23].
Транзиентная эластография (иногда применяется термин «транзиентная эластометрия») – это метод, используемый в приборе Фиброскан и заключающийся в непрямом определении стадии фиброза посредством замеров ригидности печеночной ткани [24, 25, 27]. Метод зарекомендовал себя как точный и легко осуществимый в клинической практике, однако имеющий ряд ограничений [26]. К основным из них относятся оператор-зависимость, приводящая к вариабельности результатов и низкой воспроизводимости; влияние стеатоза печени и алиментарного ожирения на результат; анатомические особенности пациента (величина кожно-капсульного расстояния, плотность капсулы печени, степень развитости межреберных мышц и т.п.), вызывающие трудности при проведении процедуры. Для нивелирования влияния стеатоза и алиментарного ожирения компанией – производителем прибора Фиброскан был создан XL-датчик, имеющий иные, чем у традиционно применяемого М-датчика, характеристики генерируемых волн.
Целью настоящего исследования было сравнение диагностических потенциалов М- и XL-эластометрии (эластометрии, проводимой с использованием М-датчика, и эластометрии, проводимой с использованием XL-датчика, соответственно), определение факторов риска, связанных с ложными результатами М- и XL-эластометрии, разработка дополнительных критериев, используемых в алгоритме выбора между М- и XL-датчиком.
Результаты сравнительного анализа
Для участия в настоящем исследовании была отобрана группа из 99 человек, признанных соответствующими критериям включения (наличие в крови исследуемого РНК ВГС, подтвержденное методом ПЦР; срок давности указанного теста не более 1 месяца, предшествовавшего проведению эластометрии; отсутствие сопутствующего инфицирования вирусом иммунодефицита человека [ВИЧ], подтвержденное отрицательным результатом лабораторного исследования крови на антитела к ВИЧ методом ИФА; срок давности указанного теста не более 1 месяца, предшествовавшего проведению исследования; отсутствие противовирусной терпит на момент исследования или окончание такой терапии не менее чем за 6 месяцев до исследования).

Основные характеристики группы: средний возраст – 39,6±1,0 год, число мужчин – 61 (61,6%), женщин – 38 (38,4%).
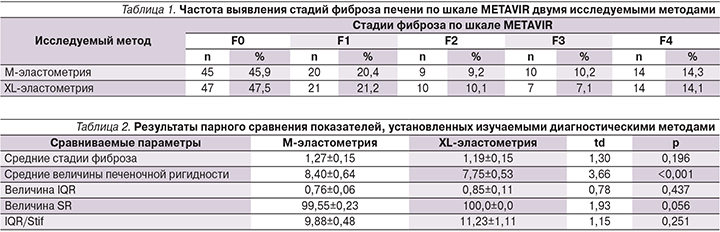
Распределение по стадиям фиброза в исследуемой группе разнилось в зависимости от применяемого метода диагностики (табл. 1).
В ходе настоящего исследования была отмечена следующая закономерность: величина печеночной ригидности у одного и того же пациента, измеренная датчиком М, существенно отличалась от величины ригидности, измеренной датчиком XL. Как правило, датчик XL давал меньшие значения ригидности, выраженные в килопаскалях (кПа). При этом измерение обоими датчиками проводилось в одной и той же точке в ходе одного и того же исследования с интервалом не более 5 минут между измерениями. Сравнительный анализ (с использованием парного td-критерия Стьюдента) средних значений стадий фиброза по шкале METAVIR, установленных фибросканированием XL-датчиком и М-датчиком, не выявил статистически достоверных различий (р=0,196; табл. 2).
В то же время сравнительный анализ средних величин печеночной ригидности, измеренной при помощи датчика М и датчика XL и выраженной в кПа, выявил статистически достоверную разницу (р<0,001; табл. 2). Важным является тот факт, что качество обоих исследований – как при помощи датчика М, так и с использованием датчика XL, было сопоставимым, о чем свидетельствовало отсутствие достоверных отличий в величине интерквартильного размаха (IQR), коэффициенте IQR/Stif (р>0,05) и частоте успешных попыток эластометрии (SR). В отношении последнего параметра следует отметить, что значение вероятности (р) при сравнении величины SR для обоих датчиков указывало на наличие тенденции к различию (td=1,93; р=0,056), причем SR при использовании XL–датчика (100,0±0,0%) была несколько большей, чем для M-датчика (99,6±0,2%). Дополнительно проведенный сравнительный анализ с помощью парного Ud-теста подтвердил отсутствие достоверных различий между частотами успешных измерений обоими датчиками (z=1,83; р=0,068).
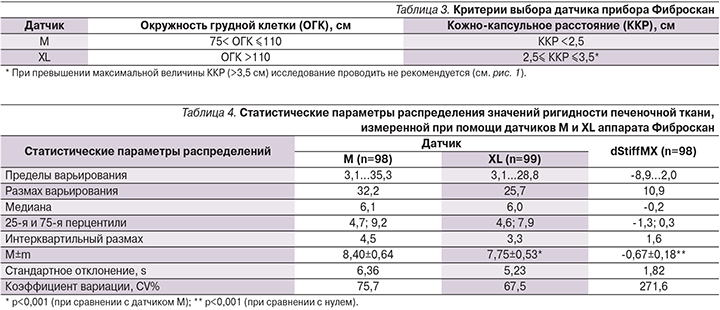
В методических рекомендациях (Е107М001.7 – версия 7 – 05/2009) Echosens, SA, Франция (компании – производители аппарата Фиброскан), по технике проведения эластометрии в части, касающейся методических подходов к выбору датчика, приводится несколько факторов, предопределяющих такой выбор (табл. 3).
В табл. 4 представлены сравнительные результаты определения ригидности печеночной ткани датчиками M и XL.
Учитывая исключительную важность правильного выбора датчика как ключевого фактора точности оценки стадии фиброза, мы наряду с рекомендуемыми производителем антропометрическими показателями (ОГК на уровне мечевидного отростка грудины и величина ККР, измеренного в ходе ультразвукового исследования), оценивали значение ряда других признаков (рост, вес, масса тела, индекс массы тела, окружность живота на уровне пупка, окружность бедер на уровне больших вертелов бедренных костей, толщина кожной складки в точке проведения эластометрии).
Поскольку между величинами ригидности печеночной ткани, определяемыми с помощью датчиков M и XL, существует достоверная систематическая разница (td=3,66; p<0,001; Ud=1394,00; p <0,003); табл. 2) и при этом другие статистические характеристики результатов работы M- и XL-датчиков (пределы варьирования, размах варьирования, медиана и др., представленные в табл. 4) не проявляют достоверных различий, нами были введены два новых расчетных показателя:
- dStiffMX – абсолютная разность показаний датчиков XL и М, выраженная в кПа. В нашем исследовании (табл. 4) dStiffMX = -0,67±0,18 (значимо отличается от нуля: t=3,66; p<0,001);
- rStiffMX – относительная разность показаний датчиков XL и М, рассчитанная как отношение абсолютной разности к показаниям датчика М: (XL–М)/М×100%. В нашем исследовании rStiffMX = -3,93±1,72 (менее значимо отличается от нуля: t=2,28; p<0,05).
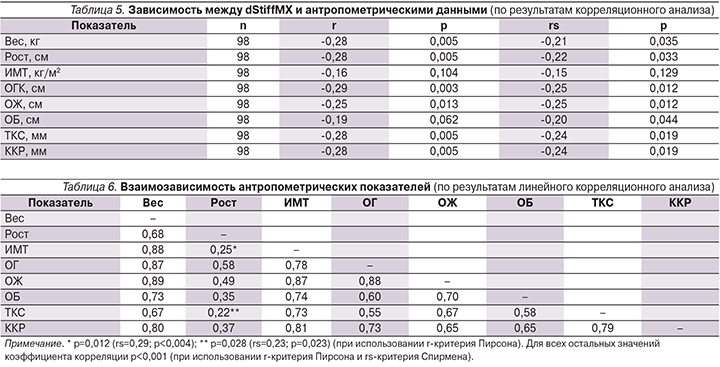
Нами была проанализирована зависимость этих двух новых показателей от основных антропометрических данных пациентов. Результаты корреляционного анализа для dStiffMX представлены в табл. 5.
Из всех протестированных нами антропометрических данных только индекс массы тела (ИМТ) не коррелировал с величиной dStiffMX (r=-0,16; p=0,104; rs=-0,15; p=0,129). В то же время отмечена общая закономерность: с увеличением роста и массы тела пациента величина dStiffMX увеличивается (рис. 2).
Для уточнения причины такого феномена нами был осуществлен корреляционный анализ взаимозависимости тестировавшихся антропометрических показателей. Результаты этого анализа представлены в виде треугольной корреляционной матрицы в табл. 6. Ана-лиз полученных данных указывает на высокую степень взаимообусловленности (коллинеарности) всех рассмотренных антропометрических показателей, поэтому требуется другой подход к решению поставленной задачи.
Таким подходом стал множественный регрессионный анализ. При изучении влияния совокупности антропометрических величин на разницу между показаниями датчика М и датчика XL (dStiffMX) с использованием метода множественного регрессионного анализа мы получили ряд уравнений, имеющих значения коэффициента множественной детерминации (R2) выше 0,10 (p<0,001). Наиболее часто в эти уравнения в качестве аргументов входили следующие показатели: масса тела, ОГК на уровне мечевидного отростка грудины и толщина кожной складки (ТКС) в точке измерения печеночной ригидности датчиком аппарата Фиброскан.
Два обстоятельства затрудняли использование многофакторного подхода к вопросу о выборе датчика (М или XL) для конкретного пациента:
- высокая степень коллинеарности (взаимосвязанности; см. табл. 6) антропометрических признаков;
- трудность графического (4-мерного) представления результатов анализа.
Поэтому для упрощения решения задачи нами были последовательно рассмотрены частные двумерные линейные и нелинейные модели зависимостей между dStiffMX, с одной стороны, и массой тела (Вес), окружностью грудной клетки (ОГ) и ТКС, с другой (формулы 1, 2 и 3 соответственно приведены в порядке увеличения статистической значи-мости).
dStiffMX=0,577 – 0,00019×(Вес в кг)2 (1)
R2=0,075; F=8,92; p=0,0036,
где R2 – коэффициент множественной детерминации; F – критерий Фишера.
dStiffMX=1,439–0,00026×(ОГ в см)2 (2)
R2=0,081; F=9,44; p=0,0028.
dStiffMX=0,110–0,00229 × (ТКС мм)2 (3)
R2=0,083; F=9,80; p=0,0023.
Принципиально, что все три регрессионные модели нелинейны (имеют вид квадратической параболы с выпуклостью, обращенной вверх). Это означает, что по мере увеличения массы тела, ОГ и ТКС прогрессивно увеличивается и показатель dStiffMX.
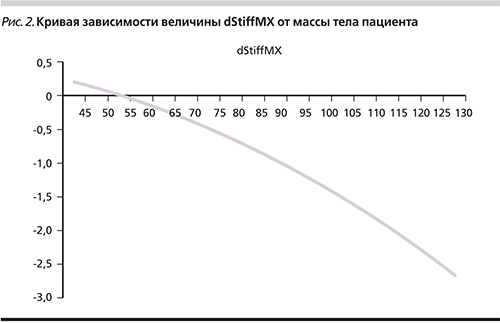
На рис. 2 приведена (в качестве примера) в графическом виде зависимость, описываемая формулой 1. По оси абсцисс – масса тела в кг, по оси ординат – величина dStiffMX в кПа. Оценка величины расхождений (dStiffMX) получена аналитическим путем (метод Ньютона).

В точке пересечения кривой с нулевой горизонтальной линией на рис. 2 разницы между показаниями датчиков М и XL нет, она соответствует массе тела, равной 55 кг. При массе тела 91,1 кг разница в показаниях датчиков составляет 1,0 кПа, при 116,46 кг – 2,0 кПа.
В табл. 7 приведены обобщенные характеристики для формул 1–3.
Для большей наглядности разницы показаний датчиков исследуемая группа пациентов была разделена на следующие подгруппы в зависимости от массы тела:
1. На 2 подгруппы по каждую сторону от медианного значения массы тела (78 кг):
а) пациенты с массой тела, меньшей или равной медианному значению;
б) пациенты с массой тела, превышающей значение медианы.
2. На 3 подгруппы в соответствии с перцентилями значения массы тела:
а) пациенты с массой тела, меньшей значения 25-й перцентили;
б) пациенты с массой тела, превы-шающей значение 75-й перцентили;
в) пациенты с массой тела, значение которой располагалось в пределах между 25-й и 75-й перцентилями.
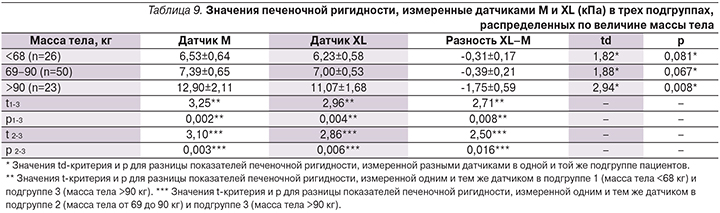
Значения печеночной ригидности для каждой из двух подгрупп приведены в табл. 8 и 9 соответственно.
В подгруппе пациентов с массой тела до 78 кг включительно достоверных отличий показаний датчика М от показаний датчика XL выявлено не было (td=1,71; p=0,094). В подгруппе пациентов с массой тела более 78 кг величины печеночной ригидности, установленные сравниваемыми датчиками, достоверно отличались друг от друга: показания датчика XL были меньше таковых датчика М на 1,11±0,33 кПа (td=3,34; p=0,002).
Более точное понимание влияния массы тела на разницу показателей датчиков было получено при разделении когорты на 3 подгруппы в соответствии с перцентилями значения массы тела (табл. 9). Достоверные отличия в показаниях М- и XL-датчиков в этом случае наблюдались в подгруппе пациентов со значениями массы тела, расположенными в пределах между 25-й и 75-й перцентилями, т.е. более 90 кг (t=2,94; p=0,008).
В зависимости от ТКС в области замеров печеночной ригидности датчиком Фиброскана мы разделили исследуемую когорту пациентов на две подгруппы (табл. 10):
- подгруппа 1 (n=49) с ТКС, меньшей или равной медианному значению (≤17 мм);
- подгруппа 2 (n=50) с ТКС, большей медианного значения (>17 мм).
В результате сравнительного анализа была выявлена достоверная разница в значениях печеночной ригидности, измеренной последовательно при помощи М- и XL-датчиков в подгруппе 2 (n=50; td=3,52; p<0,001) и отсутствие достоверной разницы по данному показателю в подгруппе 1 (td=1,38; p=0,175).
Таким образом, в дополнение к рекомендациям компании – производителя аппарата Фиброскан можно предложить еще 2 показателя в качестве критериев выбора датчика (М или XL) – это масса тела и ТКС в точке замера печеночной ригидности. При массе тела пациента до 90 кг включительно и/или ТКС до 17 мм включительно нет принципиальной разницы между показаниями М- и XL-датчиков. При массе тела пациента, превышающей 90 кг, и/или ТКС, превышающей 17 мм, необходимо сначала последовательно выполнить М- и XL-эластометрию (в любой очередности), а затем сопоставить результаты обоих измерений. При наличии выраженного стеатоза и отсутствии клинически значимых расхождений результатов М- и XL-эластометрии (более чем в одну стадию фиброза) стадию фиброза следует устанавливать, основываясь на показаниях датчика XL.
В результате проведенного корреляционного анализа нами были выявлены лабораторные показатели, достоверно влияющие на абсолютную величину разницы показаний М- и XL-датчиков Фиброскана, выраженную в кПа (табл. 11).
По данным корреляционного анализа, значимыми лабораторными показателями, достоверно влияющими на dStiffMX, оказались активность ГГТП (γ-глутамилтранспептидаза), активность АСТ и уровень глюкозы. Активность АЛТ при оценке с применением непараметрического rs-критерия достоверно влияла, а при использовании r критерия не влияла на величину разницы показателей М- и XL-датчиков Фиброскана. Поскольку повышение активности АСТ (в большей степени, чем АЛТ) в комбинации с повышением активности ГГТП при хроническом гепатите С часто ассоциируется с циррозом печени, можно говорить о систематическом занижении значений печеночной ригидности, измеренной XL-датчиком при циррозе печени. В настоящем исследовании с помощью как датчика М, так и датчика XL в исследуемой когорте было установлено 14 случаев цирроза (табл. 12). Однако это не одни и те же пациенты. Совпадения по выявлению цирроза наблюдались в 13, а расхождения – в 2 случаях. Из 14 случаев цирроза печени, установленных при помощи датчика М, в одном случае при помощи датчика XL была установлена стадия фиброза F1 (табл. 12), что является клинически значимым расхождением и может быть расценено как ложноотрицательный результат X-эластометрии.
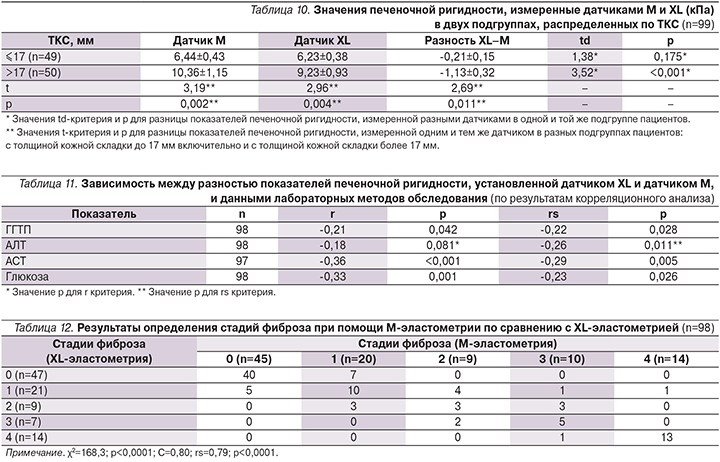
В табл. 12 в строках указаны частоты выявления стадии фиброза в исследуемой когорте пациентов (с F0 по F4 включительно слева направо) одним сравниваемым методом (М-эластометрия), а в столбцах – частóты выявления стадии фиброза в исследуемой когорте пациентов (F0 по F4 включительно сверху вниз) вторым сравниваемым методом (XL-эластометрия).
В ячейках, расположенных по диагонали, указано количество совпадений при определении стадии фиброза обоими сравниваемыми методами. В соседних ячейках, расположенных непосредственно выше и ниже диагонали, отображено количество расхождений в одну стадию фиброза; значения, указанные выше и ниже диагонали через одну ячейку, отражают расхождения в две стадии фиброза и т.д. Так, например, с помощью М-эластометрия у 9 пациентов была установлена стадия фиброза F2 (METAVIR). При этом в 3 из 9 случаев имелось совпадение данных, полученных при помощи обоих сравниваемых методов. У оставшихся 6 пациентов, которым при помощи эластометрии датчиком М была установлена стадия фиброза F2, с помощью датчика XL были установлены следующие стадии: F1 – в 4 случаях, F3 – в 2 случаях. Таким образом, в приведенном примере наблюдалось 3 случая совпадения стадий фиброза, установленных при помощи сравниваемых методов, и 6 случаев расхождений в одну стадию. В целом в когорте совпадений стадий фиброза, установленных при помощи сравниваемых методов, насчитывался 71 случай, расхождений в 1 стадию фиброза – 25, расхождений в 2 стадии – 1, расхождений в 3 стадии – 1 случай. Расхождений в 4 стадии фиброза в когорте не наблюдалось.
Из 14 случаев цирроза, установленных датчиком XL, в одном случае при помощи датчика М была установлена стадия фиброза F3 (табл. 12), что, на наш взгляд, не является клинически значимым расхождением. Таким образом, можно предположить ложноотрицательный потенциал у датчика XL при разграничении наличия цирроза и его отсутствия. Следовательно, в ситуациях, когда при помощи фибросканирования датчиком М устанавливается стадия фиброза F4, а при помощи датчика XL устанавливается стадия фиброза F2 и ниже, результат XL-эластометрии следует подвергать сомнению как ложноотрицательный и уточнять стадию фиброза при помощи других методов диагностики.
Вторым клинически значимым случаем является расхождение в две стадии фиброза, при этом с помощью М-эластометрии установлена стадия фиброза F3, а при XL-эластометрии – стадия фиброза F1. Истинную стадию фиброза в этом случае в рамках настоящего исследования установить не представилось возможным.
Выводы
- При массе тела исследуемого пациента до 90 кг включительно и/или ТКС в предполагаемом месте эластометрии до 17 мм включительно нет достоверной разницы между показаниями М- и XL-датчиков. В этих случаях при выборе датчика следует пользоваться основным алгоритмом, рекомендованным производителем аппарата Фиброскан.
- В случаях когда масса тела пациента превышает 90 кг и/или ТКС превышает 17 мм, необходимо сначала последовательно выполнить М- и XL-эластометрию (в любой очередности), а затем сопоставить результаты обоих измерений. При наличии выраженного стеатоза и отсутствии клинически значимых расхождений (более чем в одну стадию) результатов М- и XL-эластометрии оценку фиброза следует проводить, основываясь на показаниях датчика XL.
- В ситуациях, когда при помощи фибросканирования датчиком М устанавливается стадия фиброза F4 (цирроз), а при помощи датчика XL устанавливается стадия фиброза F2 и ниже, результат XL-фибросканирования следует подвергать сомнению как ложноотрицательный и уточнять стадию фиброза при помощи других методов диагностики.
- При разграничении наличия цирроза с его отсутствием возможность ложноотрицательного результата XL-эластометрии следует рассматривать всегда, когда данные XL-эластометрии клинически значимо (на 2 или более стадии фиброза) занижают результат по сравнению с таковым М-эластометрии и это сопровождается повышением сывороточных уровней АСТ и ГГТП.



