Основной причиной смерти и осложнений для пациентов с сахарным диабетом 2 типа (СД2) служат сердечно-сосудистые заболевания (ССЗ). Более 60% пациентов с СД2 умирают от ССЗ; кроме того, у большего процента пациентов имеются серьезные осложнения [1]. В мире широко обсуждается влияние снижения уровня глюкозы на сердечно-сосудистые осложнения. В рамках трех основных исследований (ACCORD, ADVANCE, VADT) оценивалось влияние поддержания нормогликемии (ACCORD) или уровня, близкого к нормогликемии (ADVANCE, VADT), у пациентов с СД2 и высоким сердечно-сосудистым (СС) риском [2–4]. Ни в одном из этих исследований – ни в индивидуальных, ни в обобщенных результатах – не было продемонстрировано снижения общей смертности или СС-смертности, хотя мета-анализ показал снижение случаев нелетального инфаркта миокарда (ИМ) на 15–17% у лиц в группе с более жестким контролем гликемии [5]. Наиболее высокая смертность наблюдалась в группе интенсивного контроля глюкозы в исследовании ACCORD, который привел к досрочной отмене гипогликемической терапии данного исследования [2]. Кроме того, частота эпизодов гипогликемии (всех и серьезных) была более высокой в группах интенсивного контроля глюкозы во всех трех исследованиях [1]. Кроме гипергликемии у пациентов с СД2 часто присутствовали дополнительные факторы риска возникновения ССЗ. Среди этих факторов – инсулинорезистентность, ожирение, артериальная гипертензия, дислипидемия, аномалии и дисфункции тромбоцитов, а также хроническое воспаление [6].
На протяжении последних 25 лет (1976–2001) в рамках Фремингемского исследования наблюдалось снижение (-48%) общей смертности, вызванной всеми причинами и ССЗ (-62%) как среди мужчин, так и среди женщин с СД, по сравнению с 1950–1975 гг. [7]. Контроль за совокупностью СС-факторов риска (артериальное давление и снижение содержания липидов) привели к значительному улучшению прогноза для пациентов, получающих лечение в связи с СД2 в развитых странах (США, страны ЕС, Канада, Австралия). Данные Государственного диабетического регистра продемонстрировали снижение уровня смертности среди пациентов с СД2 на 40% в период с 1997 до 2007 г. [8]. Подобно этому высокий уровень смертности среди пациентов с СД2 в Канаде (штат Онтарио) и в Великобритании (база данных THIN) понизился на 44 и 43% соответственно по сравнению с 1996–2009 гг. [9]. Кроме того, данные, полученные из Австралии, продемонстрировали снижение уровня смертности, стратифицированного по возрасту, с 9,4 до 5,5 на 1000 пациенто-лет в 1997–2010 гг. [10]. Несмотря на это, во многих странах как мужчины, так и женщины с СД2 по-прежнему подвержены более высокому риску общей смертности и по причинам ССЗ по сравнению с людьми без СД, несмотря на меры по снижению риска, включающие снижение уровня холестерина и снижение артериального давления, а также отказ от курения [11].
К сожалению, не проводилось долгосрочных исследований многофакторного вмешательства в отношении пациентов с впервые диагностированным СД2. Недавно опубликовано масштабное исследование, проведенное в Швеции [12], в котором принимали участие пациенты с СД2 из Национального диабетического регистра. При этом каждый пациент из пяти был наугад выбран из общей популяции в соответствии с возрастом, полом и регионом (общая численность контрольной группы, n=2 117 483). Результаты показали, что смертность при СД2 была значительно выше при ухудшении гликемического контроля, нарушении функции почек, а также в молодом возрасте. Характеристика набранных в исследование пациентов: средний возраст – 65,8 года, возраст при диагностировании СД2 – 60,2 года, женщины – 44,9%, средний индекс массы тела – 29,8 кг/м2, стаж СД – 5,6 года. После наблюдения в течение 5 лет 77 117 из 435 369 пациентов с СД2 (7,7%) скончались по сравнению с 306 097 из 2 117 483 контрольной группы (14,5%) (скорректированное СР – 1,15; 95% ДИ – 1,14–1,16) [12]. Риск общей смертности был очень низким по сравнению с предыдущими наблюдениями, когда анализ корректировался по возрасту и полу, риск уменьшился на 15% в зависимости от сопутствующего заболевания. Относительно низкий уровень смертности среди шведских пациентов с СД2 можно объяснить интенсивным лечением статинами и препаратами для контроля артериального давления, а также хорошим контролем диабета. Среднее артериальное давление составило 140/78 мм рт.ст., средний уровень гликированного гемоглобина (HbA1c) – 7,1%, а средний уровень липопротеидов низкой плотности (ЛПНП) – 2,94 ммоль/л. Среди пациентов в возрасте 65–74 лет повышенный риск смерти был 30–40% по сравнению с контрольной группой аналогичного возраста, в то время как среди лиц моложе 55 лет повышенная смертность составила 100–200% по сравнению с контрольной группой. Поразительно, что общая (рис. 1а) и СС-смертность (рис. 1б) были тесно связаны с гликемическим контролем (HbA1c) во всех возрастных группах. Несмотря на это, взаимосвязь была более выраженной у более молодых пациентов и менее выраженной у пожилых больных. У пациентов в возрасте 65–74 лет с нормоальбуминурией и уровнем HbA1c≤6,9% наблюдался более низкий риск по сравнению с контрольной группой. Аналогично уровень риска был ниже у пациентов в возрасте ≥75 лет с уровнем HbA1c≤7,8%, чем у контрольной группы, но среди пациентов моложе 55 лет риск был значительно выше, несмотря на то что уровень HbA1c находился в заданном диапазоне и на наличие нормоальбуминурии.

В недавнем большом исследовании [13] с участием около 860 тыс. пациентов оценивалась частота госпитализаций по причине значительных СС-событий и общей смертности среди взрослых больных СД2 с ССЗ или без ССЗ в связи с неудовлетворительным контролем диабета (HbA1c), высоким содержанием холестерина ЛПНП (Х-ЛПНП), высоким артериальным давлением (АД) и курением. Неудовлетворительный контроль фактора риска расценивался в случаях ХС ЛПНП ≥100 мг/дл, HbA1c >7%, АД ≥140/90 мм рт.ст. либо при наличии никотиновой зависимости. Представляется интересным, что по сравнению с лицами, у которых исходно отсутствовало ССЗ, у пациентов с наличием ССЗ на начальном этапе наблюдался лучший контроль в отношении курения (8,0 против 9,8%), HbA1c ≥7% (42 против 53%), и ХС ЛПНП ≥100 мг/дл (38 против 58%). Также отмечалось схожее процентное соотношение пациентов с систолическим/диастолическим АД ≥140/90 мм рт.ст. (23 против 21%). Средний возраст исходно составил 59 лет, среди пациентов было 48% женщин, 45% принадлежали к европеоидной расе и у 31% были ССЗ. Средний срок последующего наблюдения составил 59 месяцев. Значительные СС-события основаны на диагнозах при выписке из больницы: ИМ, острого коронарного синдрома (ОКС), инсульта или сердечной недостаточности (СН). Частота событий на 100 пациенто-лет у взрослых с СД и наличием ССЗ по сравнению с теми, у кого отсутствовало ССЗ, составила 6,0 против 1,7 для ИМ/ОКС, 5,3 против 1,5 для инсульта, 8,4 против 1,2 для СН, 18,1 против 40 для всех СС-событий и 23,5 против 5,0 для смертности по всем причинам. Процентное отношение всех СС-событий и смертей, ассоциированных с неудовлетворительным контролем факторов риска, составило соответственно 11 и 3% для пациентов с ССЗ, а для пациентов без ССЗ – 34 и 7%. Эти данные подтверждают, что (1) у пациентов с СД2 и без ССЗ не обеспечен адекватный контроль факторов риска СС-осложнений; (2) плохой контроль факторов риска для пациентов без ССЗ оказывает крайне негативное влияние на СС-события и смерть.
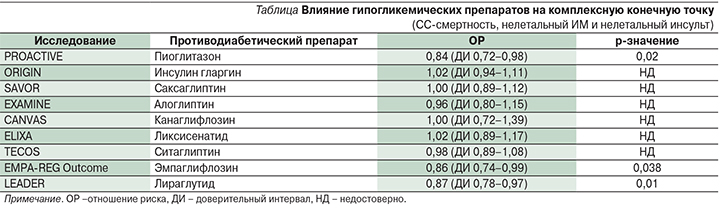
Ввиду тесной связи ССЗ с СД2 и неопределенности по поводу СС-безопасности гипогликемических препаратов Управление по контролю качества пищевых продуктов и лекарственных препаратов США в 2008 г. выпустило директиву о проверке СС-безопасности новых противодиабетических препаратов [14]. Предполагается, что к 2020 г. все имеющиеся исследования по СС-безопасности будут включать около 180 тыс. наблюдаемых пациентов с СД2 и ССЗ, получающих новый диабетический препарат или плацебо в дополнение к стандартному лечению. В настоящее время мы располагаем результатами исследований большинства новых гипогликемических препаратов: пиоглитазона – PROactive [15], инсулина гларгина – ORIGIN [16], саксаглиптина – SAVOR [17], алоглиптина – EXAMINE [18], ситаглиптина – TECOS [19] и ликсисенатида – ELIXA [20]. Дизайн этих исследований почти не позволяет демонстрировать пользу каких-либо новых препаратов. У всех пациентов был высокий СС-риск и продолжительный декомпенсированный СД2 в течение 8–10 лет. Виды лечения, которые могли бы быть эффективными для первичной профилактики ССЗ, способные приносить потенциальную пользу в отношении СС-событий при раннем вмешательстве, могут быть неэффективными для пациентов с длительным стажем СД2. Кроме того, большинство больных получали стандартные виды лечения ССЗ (антитромбоцитарные средства, в т.ч. аспирин – 75–97%; статины – 78–90%; бета-блокаторы – 62–85%; ингибитор ангиотензин-превращающего фермента/блокатор ангиотензинового рецептора – 79–85%) для снижения вероятности дополнительного потенциального риска ССЗ или вторичной профилактики ССЗ при использовании нового противодиабетического препарата. Согласно опубликованным результатам, большинство средств, за исключением пиоглитазона, эмпаглифлозина и лираглутида, не снижают и не повышают возникновение значимых СС-событий (СС-смерть, нелетальный ИМ, нелетальный инсульт) по сравнению с плацебо (см. таблицу).
Исследование PROactive
PROactive [15] было масштабным проспективным рандомизированным двойным слепым исследованием вторичной профилактики, в котором изучалось влияние пиоглитазона (45 мг/сут) на СС-исходы для 5238 пациентов с СД2 и перенесенным ССЗ: ~50% с перенесенным ИМ, 25% с перенесенным инсультом, 25% с болезнью периферических артерий. Лечение пиоглитазоном или плацебо применялось в дополнение к оптимизированному стандартному лечению, включившему гипогликемические, антигипертензивные, гиполипидемические и антитромботические препараты. В отношении первичной комбинированной конечной точки, которая включала общую смертность, нелетальный ИМ (в т.ч. бессимптомный ИМ), острый коронарный синдром, инсульт, большую ампутацию ноги (выше лодыжки), коронарную реваскуляризацию или реваскуляризацию ноги, было продемонстрировано лишь незначительное снижение (на 10%) в группе пиоглитазона. Наблюдалось значительное снижение комбинированной конечной точки, представленной СС-смертностью, нелетальным ИМ и нелетальным инсультом (ОР – 0,82 [95% ДИ – 0,70–0,97]) в ходе трехлетнего периода последующего наблюдения [15]. Кроме того, у пациентов, ранее перенесших ИМ, пиоглитазон существенно снижал риск последующего ИМ на 28% и ОКС на 38% [22]. У пациентов с ранее перенесенным инсультом пиоглитазон снижал вероятность второго инсульта на 48% [23], в то время как у пациентов с болезнью периферических артерий не наблюдалось положительного воздействия пиоглитазона [24]. Хорошо известно, что пациенты с СД2 и хронической болезнью почек (ХБП) особо подвержены высокому риску ССЗ. В дополнительном анализе исследования PROactive было определено влияние пиоглитазона по сравнению с плацебо на пациентов с ХБП [25]. Пациенты, получавшие лечение пиоглитазоном, с меньшей степенью вероятности достигали совокупной (смертность по всем причинам, ИМ или инсульт) конечной точки (ОР – 0,66 [95% ДИ – 0,45–0,98]) по сравнению с больными, получавшими плацебо. Кроме того, в двух рандомизированных прямых сравнительных исследованиях было продемонстрировано, что пиоглитазон значительно снижает уровень толщины комплекса интима-медиа сонной артерии, суррогатного маркера коронарного атеросклероза [26] и замедляет прогрессирование коронарного атеросклероза, изучаемого с помощью внутрисосудистого ультразвукового исследования [27], противоатерогенное действие пиоглитазона может способствовать снижению многих факторов СС-риска [28, 29], таких как повышение уровня ХС ЛПНП, снижение уровня триглицеридов и свободных жирных кислот, преобразование небольших частиц ЛПНП в более крупные, обладающие более высокой плавучестью и меньшей атерогенностью; уменьшение эндотелиальной дисфункции, повышение адипонектина и снижение PAI-1, CRP, TNFα, снижение резистентности к инсулину и содержания внутреннего жира. Клиническое применение пиоглитазона ограничено риском нежелательных явлений, в т.ч. увеличением массы тела, удержанием жидкости, хронической сердечной недостаточностью (ХСН) и переломами костей [30]. В исследовании PROactive [15] 5,7 и 4,1% пациентов, принимавших соответственно пиоглитазон и плацебо, были госпитализированы [31]; однако уровень смертности по причине ХСН был у них сходным (0,96 против 0,84 %; p=0,639). Интересно, что у пациентов с ХСН в группе пиоглитазона частота комбинированной конечной точки (СС-смертность, ИМ, инсульт) была реже по сравнению с плацебо (34,9 против 47,2%; р=0,025). Поскольку ХСН является неблагоприятным фактором при СД2 с пятилетней смертностью ~50%, маловероятно, что у этих пациентов она действительно была. Более вероятным видится наличие у них задержки жидкости и отека вследствие воздействия пиоглитазона на задержку натрия в почках. Опасения по поводу рака мочевого пузыря в связи с пиоглитазоном противоречат результатам 10-летнего проспективного исследования Kaiser-Permanente Northern-California [32]. В рамках этого исследования безопасности с участием 193 099 пациентов с СД2 не было выявлено связи между риском рака мочевого пузыря и применением пиоглитазона, включая продолжительность применения пиоглитазона, возрастающую дозу пиоглитазона и промежуток времени от начала его применения. По результатам следующего исследования [33] с участием 1,01 млн пациентов с СД2 при свыше 5,9 млн пациенто-лет в шести популяциях не было сообщений о повышенном риске рака мочевого пузыря со стороны как пиоглитазона (ОР = 1,01), так и росиглитазона (ОР=1,00).
Исследование EMPA-REG Outcome
Недавно представленное исследование EMPA-REG Outcome [21] является международным проспективным плацебо-контролируемым клиническим исследованием СС-безопасности эмпаглифлозина, ингибитора натриево-глюкозных транспортеров 2-го типа (SGLT2) у пациентов с СД2 и установленным ССЗ. Это первое исследование, в котором было задокументировано, что гипогликемический препарат может уменьшать количество СС-событий у пациентов с СД2. У 7020 пациентов с СД2 и перенесенным ССЗ эмпаглифлозин снижал после 3,1 года первичную точку MACE (СС-смерть, нелетальный ИМ, нелетальный инсульт) на 14% (ОР=0,86, p=0,04) и на 35% количество случаев госпитализаций по причине СН (ОР=0,65; p=0,002). Между тремя основными конечными точками MACE наблюдались внушительные различия: (a) для СС-смерти ОР (0,62) понизился на 38% (p<0,0001); (б) для нелетального ИМ (0,87) понизился на 13% (p=0,22); (в) для инсульта (1,24) повысился на 24% (p=0,22). На рис. 2 показано впечатляющее влияние эмпаглифлозина на абсолютное снижение риска СС-событий в исследовании исходов EMPA-REG. Снижение смертности проявилось на очень раннем этапе (<3 месяцев) и наблюдалось во всех подгруппах без какой-либо явной гетерогенности. Представляется, что данное снижение смертности нельзя полностью объяснить незначительным сопутствующим снижением таких показателей, как HbA1c, масса тела, объем талии, артериальное давление, уровень мочевой кислоты в сыворотке, в группах эмпаглифлозина по сравнению с группой плацебо. Стремительное снижение смертности среди пациентов, получающих лечение эмпаглифлозином, предполагает наличие гемодинамического механизма действия. Исходный уровень АД (135,5/76,7 мм рт.ст.) через 4 месяца значительно понизился на ~5/2,5 мм рт.ст. и по времени коррелировал со снижением смертности от СС-патологии и уменьшением количества госпитализаций по причине СН.
Недавнее исследование [34] продемонстрировало, что эмпаглифлозин не только понижал АД, но и оказывал благотворное воздействие на маркеры артериальной ригидности и сосудистого сопротивления. Наблюдение влияния эмпаглифлозина на сосудистую систему без повышения частоты сердечных сокращений представляет интерес в СС-аспекте и может быть интерпретировано как относительное снижение тонуса симпатической нервной системы. Вероятно, что благотворное воздействие эмпаглифлозина на снижение СС-риска и СН имеет отношение к гемодинамическому/СС-действию препарата для снижения АД и внутрисосудистого объема, в результате чего происходит сочетание снижения пост- и преднагрузки.
Кроме того, наблюдалась выраженная нефропротекция [35], хотя у 26% пациентов с ССЗ также была ХБП (СКФ<60), и обычно они не получают ингибиторы SGLT2. Возникновение или ухудшение болезни почек сократилось на 39%, возникновение новых случаев макроальбуминурии – на 38%, удвоение сывороточного креатинина – на 44%, а случаи конечной стадии болезни почек – на 55%. Важно отметить, что у большинства пациентов на исходном уровне наблюдалась ХБП стадии 3а (68%), тогда как стадия 3б наблюдалась у 32%. Кроме того, все пациенты с ХБП на стадиях 4 и 5 были исключены из исследования EMPA-REG Outcome.
Исследованием EMPA-REG Outcome был также подтвержден отличный профиль безопасности класса ингибиторов SGLT2. Эмпаглифлозин значительно снижает уровень HbA1c, массу тела, объем талии и артериальное давление, не вызывая увеличения частоты сердечных сокращений. Отсутствовал рост случаев гипогликемии, несмотря на то что половина пациентов получили предварительное лечение инсулином. Кроме того, частота случаев гипер- или нормогликемического кетоацидоза была очень низкой и не была выше у пациентов, получавших эмпаглифлозин (0,035%), по сравнению с плацебо (0,020%). Количество случаев серьезных нежелательных явлений и нежелательных явлений, приводивших к отмене препарата, было небольшим, но незначительно более низким, чем в группе эмпаглифлозина. Как и ожидалось, количество случаев генитальных инфекций в группе эмпаглифлозина было выше (6,4%) по сравнению с плацебо (1,8%).
Исследование LEADER
В двойное слепое международное проспективное плацебо-контролируемое клиническое исследование LEADER [55] СС-безопасности лираглутида (агониста рецепторов глюкагоноподобного пептида-1 – аГПП-1) были включены пациенты с СД2 и высоким риском СС-событий. В целом 9340 пациентов из 410 центров 32 стран были рандомизированы в соотношении 1:1 для инъекций активного исследуемого препарата или плацебо. Первичная комбинированная конечная точка включила случаи СС-смерти, ИМ без смертельного исхода и инсульта без смертельного исхода. У 9340 пациентов с СД2 и высоким риском СС-событий после 3,8 года лечения лираглутид снижал первичную точку MACE (СС-смерть, нелетальный ИМ, нелетальный инсульт) на 13% (ОР=0,87; p=0,01). Между тремя основными конечными точками MACE наблюдались различия: (a) для СС-смертности снижение ОР составило 22% (ОР=078, р=0007); (б) для нелетального ИМ (0,88) снижение было на 12% (p=0,11); (в) для инсульта незначительно понизилось на 11% (0,89) (p=0,30). Госпитализация по поводу сердечной недостаточности не была значительно ниже в группе лираглутида (ОР=0,87; р=0,14), по сравнению с группой плацебо. Лираглутид продемонстрировал нефропротективнный эффект, в частности, в отношении снижения прогрессирования макроальбуминурии (ОР=0,74, p<0,05). Нежелательными явлениями, приводящими к прекращению применения лираглутида, чаще всего были желудочно-кишечные события. Частота панкреатита была ниже в группе лираглутида, чем в группе плацебо. Механизмы влияния лираглутида на снижение СС-риска активно обсуждаются и складываются из совокупности различных гипотез: влияние на вес, артериальное давление, HbA1c, макроальбуминурию.
Индивидуальный подход к противодиабетической терапии с учетом стадии заболевания и сопутствующей патологии
Заявление о консенсусе ADA-EASD, опубликованное в 2009 г. [36], поддерживало начальное лечение метформином в качестве монотерапии и изменение образа жизни, за которыми следует добавление сульфонилмочевины или базального инсулина, если цели не достигнуты (рекомендации категории 1). Все другие гипогликемические виды терапии были переведены во вторичный статус (категория 2) и рекомендовались лишь для определенных клинических условий.
Подход, при котором у всех пациентов должен быть одинаковый целевой уровень HbA1c (<7,0%) и при котором пациенты должны соблюдать одинаковый алгоритм лечения, был подвергнут серьезной критике со стороны международной группы экспертов [37]. Руководство по лечению СД нуждалось в пересмотре определения минимального значения HbA1c для пациентов с длительным стажем СД или установленным ССЗ. В заявление о консенсусе ADA-EASD от 2012 г. [38] и 2015 г. [39] были внесены изменения.
Пациенты с отсутствием сосудистых осложнений должны осуществлять нормогликемический контроль наряду со строгим контролем фактора риска ССЗ, как изложено в недавно опубликованном исследовании шведской популяции [12]. В частности, для молодых пациентов с плохим долгосрочным прогнозом риска необходим целевой уровень HbA1c <6,5%, достичь которого можно с помощью выбора определенных гипогликемических препаратов, не предусматривающих гипогликемии или увеличения массы тела. Метформин остается оптимальным препаратом для монотерапии. Его низкая стоимость, доказанная безопасность, способность или нейтральность к снижению массы тела и возможные преимущества для СС-показателей служат основанием считать этот препарат лучшей начальной альтернативой при выборе лекарственного средства [40–42]. В качестве терапии второй линии широко применяются ингибиторы ДПП-4, поскольку эти препараты хорошо переносятся большинством пациентов, включая пожилых пациентов и больных с нарушенной функцией почек [43–46]. Ингибиторы ДПП-4 имеют эффективность, сходную с таковой сульфонилмочевины, но обычно не провоцируют гипогликемию или увеличение массы тела. Они имеют хороший профиль безопасности и не повышают СС-риск. Ввиду наличия этих факторов ингибиторы ДПП-4 стали распространенным видом лечения СД2 и все шире применяются на ранних этапах терапии [39].
Из производных сульфонилмочевины предпочтительнее использовать гликлазид ввиду низкого риска гипогликемии и лучшего профиля СС-безопасности [47–50]. При уровне HbA1c около 8% [51] большинство противодиабетических препаратов обладают очень сходной способностью к снижению уровня глюкозы. Однако если уровень HbA1c выше, то инсулин, антагонисты рецептора ГПП1 или ингибиторы SGLT2 обладают большей эффективностью по сравнению с ингибиторами ДПП-4 и производными сульфонилмочевины [52–54].
Пациентам с СД2 при наличии ССЗ в принципе можно применять все препараты с подтвержденной безопасностью [16–20]. Однако для снижения количества СС-событий и смертей следует отдавать предпочтение препаратам с подтвержденными СС-преимуществами. В недавно опубликованных клинических рекомендациях Канадской ассоциации диабета [56] для снижения риска СС-смертности и смертности от всех причин у пациентов с СД2 и подтвержденными ССЗ было предложено использовать для достижения гликемического контроля класс ингибиторов натрийзависимого переносчика глюкозы 2-го типа, а именно эмпаглифлозин, доказавший свои преимущества в исследовании EMPA-REG Outcome (уровень доказательности IА).



