Введение
Нейроэндокринные опухоли (НЭО) желудка составляют 3–6% от всех НЭО и около 2% среди всех опухолей желудка. НЭО желудка чаще встречаются у женщин (64%) [1]. Преобла-дают высокодифференцированные НЭО I типа (см. классификацию). Низкодифференцированные нейроэндокринные карциномы занимают в структуре НЭО желудка не более 6%, однако их истинная распространенность может быть недооценена из-за сложностей морфологической диагностики [2]. Длительное время НЭО желудка относили к крайне редким заболеваниям, однако в последние годы отмечена устойчивая тенденция к росту заболеваемости ими. Так, по данным National Cancer Institute, за период с 1950 по 1999 г. было зарегистрировано всего 562 случая НЭО желудка, а с 2000 по 2004 г. – уже 1043, что составило 11,7% от общего числа гастроэнтеропанкреатических НЭО [3, 4] Причины столь стремительного роста заболеваемости неизвестны. Отчасти рост числа первичных больных может быть следствием широкого внедрения эндоскопического обследования верхних отделов желудочно-кишечного тракта (ЖКТ) и иммуногистохимического исследования биопсийного материала [5]. Также высказывается мнение о роли использования ингибиторов протонной помпы в развитии карциноидов желудка I типа. Длительное (годы) применение препаратов этой группы и вызываемая ими ахлоргидрия сопровождаются выраженным повышением уровня гастрина-17, что является одним из ключевых патогенетических механизмов развития карциноидов желудка [6–8].
НЭО желудка – неоднородная группа, включающая как высокодифференцированные новоообразования, подлежащие эндоскопическому лечению и характеризующиеся благоприятным прогнозом, так и высокозлокачественные низкодифференцированные опухоли, обладающие высоким метастатическим потенциалом, характеризующиеся крайне агрессивным течением и неблагоприятным прогнозом, при которых проводят хирургическое и комбинированное лечение, как при аденокарциномах желудка. Низкая информированность врачей общей практики и онкологов общей лечебной сети о данной проблеме нередко приводит к ошибочному выбору лечебной тактики, в частности к необоснованным операциям у пациентов с карциноидами желудка I–II типов.
Классификация НЭО желудка
Впервые понятие «карциноид» было введено Обердорфером в 1907 г. для описания опухолей ЖКТ, обладающих специфической морфологической структурой, отличной от таковой у эпителиальных новообразований [9]. В 2007 г. Европейское сообщество по нейроэндокринным опухолям (European Neuroendocrine Tumor Society – ENETS) впервые предложило классификацию НЭО, в которой была использована система определения степени дифференциро-вки опухоли, аналогичная таковой для всех злокачественных новообразований ЖКТ [10, 11]. В рекомендациях 2010 г. Американский объединенный онкологический комитет (American Joint Committee on Cancer – AJCC), предложил разделить все НЭО ЖКТ по степени дифференцировки (G) в зависимости от митотического индекса и процента клеток, экспрессирующих антиген Ki-67 [12]. Именно этот подход и стал основанием для создания актуальной на сегодняшний день классификации ВОЗ для НЕО ЖКТ, в соответствии с которой выделяют НЕО G1, G2, нейроэндокринные карциномы G3 (мелко- и крупноклеточные), а также смешанные аденонейроэндокринные карциномы и гиперпластические или предопухолевые изменения [13].
В 1993 г. итальянский патологоанатом G. Rindi предложил классификацию, подразделяющую карциноиды желудка на три основных типа. Карциноиды I типа (до 70–80% от общего числа) [14, 15] развиваются на фоне атрофического аутоиммунного гастрита, в т.ч. при пернициозной анемии [16]. При наличии данного заболевания в качестве ответа на ахлоргидрию происходит значительное повышение уровня гастрина, что в свою очередь приводит к гиперплазии нейроэндокринных клеток желудка и появлению мультифокальных карциноидных опухолей (рис. 1). В пользу данной теории свидетельствуют опыты на животных, в ходе которых было выявлено значительное повышение частоты развития НЭО желудка на фоне высоких доз ингибиторов протонной помпы [8]. По своему клеточному происхождению карциноиды I типа являются ECL-омами, т.е. опухолями из энтерохромофинноподобных (ECL) клеток. Они характеризуются множественностью зачатков, полиповидной формой роста и низким метастатическим потенциалом. Как правило, карциноиды I типа имеют высокую степень дифференцировки G1 (размеры до 1 см) и локализуются в пределах слизисто-подслизистого слоя желудка (рис. 2)
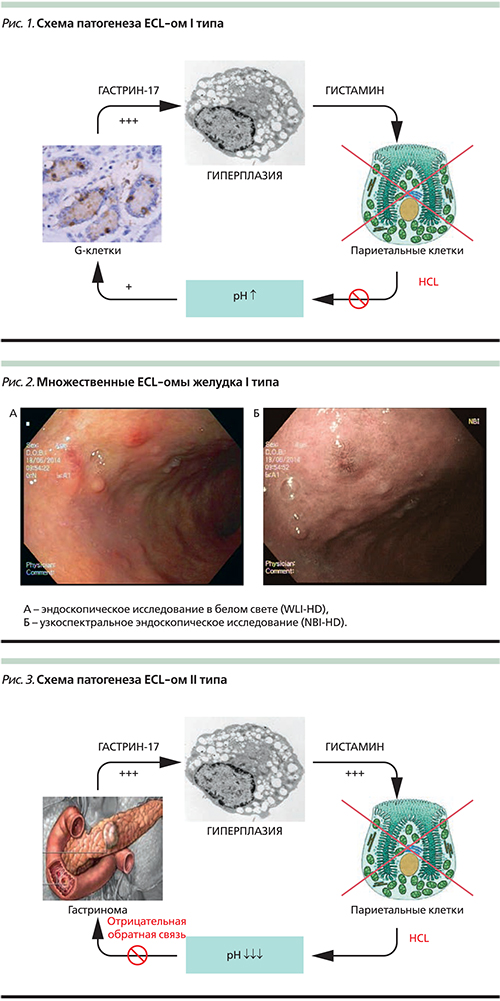
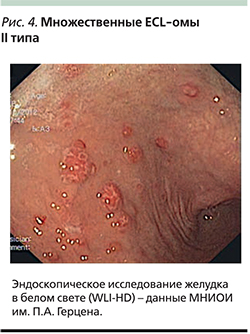
Карциноиды II типа (около 5%) также являются ECL-омами и возникают вследствие повышения уровня гастрина, но в отличие от I типа причиной гипергастринемии является функционирующая НЕО – гастринома (синдром Золингера–Элисона; рис. 3). Гастринома может возникать спорадически (до 70%) или развиваться в рамках синдрома множественной эндокринной неоплазии I типа (MEN-I) [17]. В патогенезе таких опухолей имеет значение не только гипергастринемия, но и инактивация гена MEN1. Им также свойственны множественность зачатков, полиповидная форма роста и поверхностная локализация, однако эти опухоли чаще имеют умеренную дифференцировку G2 и обладают более высоким метастатическим потенциалом (до 10%; рис. 4).
 Для НЭО III типа, составляющих до 20% среди всех карциноидов желудка, характерно спорадическое возникновение в отсутствие гипергастринемии и атрофического гастрита (рис. 5). Эти опухоли, как правило, одиночные размером более 2 см, склонны к инвазивному росту и отличаются более агрессивным течением с высоким потенциалом к регионарному и отдаленному метастазированию [18]. По степени дифференцировки они всегда G2.
Для НЭО III типа, составляющих до 20% среди всех карциноидов желудка, характерно спорадическое возникновение в отсутствие гипергастринемии и атрофического гастрита (рис. 5). Эти опухоли, как правило, одиночные размером более 2 см, склонны к инвазивному росту и отличаются более агрессивным течением с высоким потенциалом к регионарному и отдаленному метастазированию [18]. По степени дифференцировки они всегда G2.
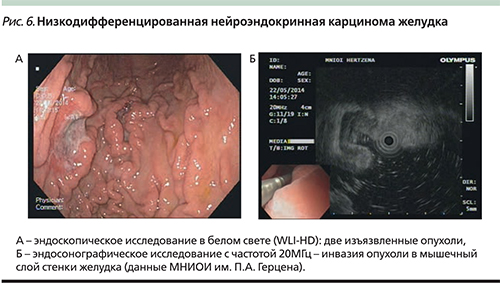
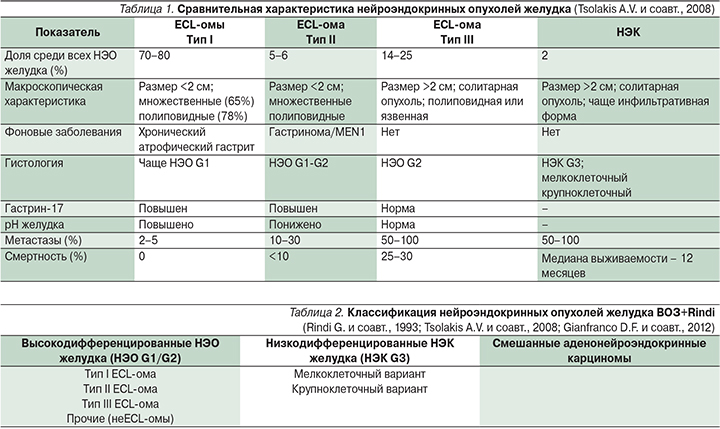
Отдельным типом НЕО желудка являются низкодифференцированные нейроэндокринные карциномы (НЭК), некоторые авторы обозначают их как 4-й тип по Rindi (рис. 6). Эта группа включает только опухоли с низкой степенью дифференцировки (G3), высоким Ki-67, не имеет связи с фоновыми состояниями и характеризуется крайне неблагоприятным прогнозом (медиана выживаемости около 12 месяцев). Различают мелкоклеточный и крупноклеточный варианты. Особые трудности возникают при попытке классифицировать опухоли с дифференцированной морфологией, но высоким митотическим индексом и Ki-67 >20%, но <50%. По классификации ВОЗ, эти опухоли должны быть отнесены к НЭК желудка G3 (4-й тип), однако по своей биологии, клиническому течению и ответу на химиотерапию они более соответствуют карциноидам желудка III типа. Единого мнения на этот счет в настоящее время нет. В ближайшие годы предполагается пересмотр классификации ВОЗ с выделением дифференцированных НЭК в отдельную группу. Сравнительные характеристики представленных групп НЭО приведены в табл. 1.
Классификации ВОЗ и G. Rindi не противоречат друг другу и могут быть совмещены в одной таблице (табл. 2).
Диагностика
Мультимодальная эзофагогастродуоденоскопия
Наибольшее значение в диагностике НЭО желудка имеет эндоскопический метод исследования, однако эндоскопия в белом свете (WLI) зачастую не позволяет дифференцировать НЭО и доброкачественные полиповидные образования желудка. В настоящее время для уточняющей диагностики НЭО желудка применяется мультимодальное эндоскопическое исследование, включающее осмотр слизистой оболочки в белом свете с высоким разрешением (WLI-HD), узкоспектральную эндоскопию (NBI), в т.ч. с близким фокусом (NBI-CF) и оптическим увеличением изображения (NBI-ME) [19–22]. Обязательным методом обследования при НЭО желудка является эндоскопическая ультрасонография (EUS), выполняемая с целью оценки глубины инвазии опухоли в стенку желудка и выявления возможного метастатического поражения регионарных лимфатических узлов [23, 24].
Нередко НЭО желудка ошибочно принимают за гиперпластические полипы, полипы фундальных желез, хронические эрозии и даже подслизистые новообразования [25], однако к настоящему времени разработаны патогномоничные эндоскопические критерии для дифференциальной диагностики НЭО желудка всех типов. Так, при эндоскопическом исследовании в белом свете НЭО желудка I типа в подавляющем большинстве наблюдений визуализируются как множественные ярко-гиперемированные плоские образования размером от 0,2 до 0,5 см, локализующиеся в теле и проксимальных отделах желудка. На этом фоне четко определяется выраженная атрофия слизистой оболочки, характеризующаяся истончением слизистой оболочки и ее белесостью, обусловленной фиброзными изменениями (рис. 2А) [21, 22, 26]. Реже при I типе НЭО наблюдается полиповидная форма роста, однако в отличие от гиперпластических полипов НЭО I типа не имеют «ножек» и аналогично плоским вариантам характеризуются выраженной гиперемией, что обусловлено значительной их неоваскуляризацией. При использовании NBI НЭО I типа характеризуются точечной или извитой архитектоникой ямок, а также патологической извитостью, расширением и избыточным количеством собирательных венул слизистой оболочки (рис. 2B) [19–22]. В подавляющем большинстве случаев НЭО I типа локализуются в пределах слизистой оболочки и при EUS визуализируются как гипоэхогенные образования, исходящие из глубоких ее отделов [21]. Сходная эндоскопическая картина отмечается и при карциноидах желудка II типа (рис. 4).
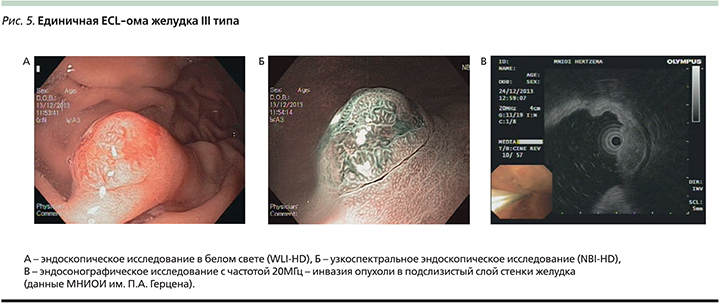
НЭО III типа чаще всего ошибочно принимаются за гиперпластические полипы, т.к. всегда имеют полипо- или бляшковидную форму и широкие основания (рис. 5А) [27]. При узкоспектральном эндоскопическом исследовании NBI НЭО III типа характеризуются извитой или нерегулярной архитектоникой ямок и, как и НЭО I типа, – патологически извитыми расширенными собирательными венулами слизистой оболочки (рис. 5B) [27]. В отличие от НЭО I–II типов карциноиды желудка III типа часто прорастают в подслизистый слой, что можно отчетливо определить при EUS (рис. 5C) [23, 24].
При низкодифференцированных НЭК эндоскопическая картина в целом аналогична раку желудка диффузного типа. Дифференциальный диагноз проводится на основании результатов биопсии и иммуногистохимического исследования (рис. 6).
Таким образом, комплексное мультимодальное эндоскопическое исследование, включающее WLI-HD, NBI и эндосонографию (EUS) [21, 22], позволяют с высокой точностью определить тип НЭО желудка.
Лучевые методы визуализации
Ультразвуковое исследование, компьютерная (КТ) и магнитно-резонансная томография (МРТ) применяются для определения локализации, распространенности и глубины инвазии первичной опухоли (карциноиды III типа и НЭК), а также для выявления регионарных и отдаленных метастазов. Стандартным объемом исследования для НЭО желудка является спиральная КТ с внутривенным контрастированием. Наилучшей визуализации при внутривенном контрастировании удается добиться в раннюю артериальную фазу [28, 29]. Альтернативным методом служит МРТ, который позволяет визуализировать опухоль без контрастирования. Ряд исследований продемонстрировал более высокую эффективность МРТ для выявления метастатического поражения печени при НЭО по сравнению со сцинтиграфией с мечеными аналогами соматостатина и стандартной спиральной КТ [30]. Именно по этой причине МРТ в соответствии с рекомендациями ENETS является предпочтительной методикой для обнаружения и контроля метастазов НЭО в печени [31]. При низкодифференцированных НЭК G3 для оценки распространенности процесса рекомендуется выполнение спиральной КТ трех зон: грудной клетки, брюшной полости и малого таза [31].
Октреотид, 111In
Сцинтиграфия с меченым (111In) аналогом соматостатина применяют для диагностики распространенных форм высокодифференцированных НЭО желудка, главным образом III типа (G2). Поскольку при карциноидах I–II типов частота регионарных и отдаленных метастазов крайне низкая, показаний к выполнению радиоизотопной сцинтиграфии, как правило, не возникает [32–34]. При низкодифференцированных НЭК данный метод неэффективен и не должен рутинно применяться для диагностики.
Рентгенография желудка в условиях двойного контрастирования
Рентгенографическое исследование с двойным контрастированием является рутинным методом обследования для пациентов со злокачественными опухолями желудка, позволяющим определить локализацию, протяженность и характер роста образования. Какие-либо патогномоничные признаки НЭО отсутствуют, а рентгенографическая картина зависит исключительно от типа роста опухоли и аналогична таковой, наблюдаемой при других эпителиальных новообразованиях. При плоских НЭО I–II типов рентгенография желудка с двойным контрастированием не позволяет визуализировать даже множественные опухоли и рутинно не применяется.
Биохимические маркеры
Измерение концентрации гастрина в сыворотке крови натощак является ключевым методом дифференциальной диагностики при НЭО I, II и III типов. Как было отмечено ранее, повышение уровня гастрина является главным патогенетическим фактором развития карциноидов желудка I–II типов и их патогномоничным признаком [16]. Нормальным считается показатель <40 iii="" 2-="" 2="" 35="" p="">
Хромогранин А (ХгА) – универсальный маркер НЭО. Измерение концентрации ХгА в сыворотке крови является чувствительным, но низкоспецифичным методом диагностики и мониторинга при НЭО, в т.ч. гормонально неактивных [36, 37]. При НЭО желудка I–II типов ХгА всегда повышен, но причиной этого является не появление карциноидов, а хроническая гипергастринемия с гиперплазией нейроэндокринного аппарата желудка. Поэтому данный маркер имеет клиническое значение только при карциноидах желудка III типа. Также на корректность измерения ХгА влияет прием блокаторов протонной помпы и наличие почечной или печеночной недостаточности. В первом случае для получения корректного результата следует прекратить прием препарата перед забором крови или заменить его на блокатор Н2-гистаминовых рецепторов [38]. Мониторинг ХгА неэффективен и не должен применяться при НЭК G3 желудка.
Классический или атипичный (обусловлен гиперпродукцией гистамина) карциноидный синдром крайне редко наблюдается при НЭО желудка, главным образом при опухоли III типа [39]. В этом случае определяют суточное количество 5-ГИУК (5-гидроксииндолуксусная кислота) в моче, обладающей высокой специфичностью для диагностики и мониторинга серотонин-продуцирующих НЭО. Нормальным считается показатель 2–8 мг/сут. Клиническая значимость данного теста ограничивается возможностью ложноположительных результатов. Повышение уровня 5-ГИУК до 30 мг/сут может быть следствием синдрома мальабсорбции, употребления пищи, богатой триптофаном и серотонином, или приема ряда лекарственных препаратов (например, ацетаминофена, барбитуратов, эфедрина, никотина, кофеина и др.) [40].
Лечение
Локализованные НЭО
Выбор метода лечения НЭО зависит от их типа и степени дифференцировки. «Золотым» стандартом лечения пациентов с НЭО I и III типов является внутрипросветное эндоскопическое лечение [16, 41]. Поскольку большинство НЭО I типа имеют инвазию в пределах слизистой оболочки, наиболее часто для лечения таких больных применяются методы эндоскопической резекции слизистой оболочки или аргоноплазменной коагуляции. При полиповидных НЭО I типа оптимальным методом лечения является резекция слизистой оболочки (ЭРС) [21]. Первым этапом осуществляют формирование гидравлической подушки под опухолью с целью отделения последней от подслизистого слоя. Затем производят отсечение фрагмента слизистой оболочки с НЭО в пределах здоровых тканей с применением электрохирургического блока и диатермической петли [42]. Критерием радикальности подобного эндоскопического вмешательства является отсутствие опухолевых клеток в краях удаленного фрагмента слизистой оболочки [42]. ЭРС обеспечивает высокую степень радикализма и безрецидивное течение заболевания [22]. При множественных плоских НЭО I типа наиболее эффективным методом лечения признается эндоскопическая аргоноплазменная коагуляция с применением специализированных электрохирургических блоков и катетеров подачи аргона, вводимых в инструментальный канал эндоскопа. Такой подход обеспечивает глубокий, вплоть до собственной пластинки, сухой некроз слизистой оболочки в зоне опухоли, что позволяет достигать высокой степени радикальности вмешательства [22, 43].
При невозможности выполнения радикального эндоскопического лечения или достижения адекватного безрецидивного периода на фоне проводимого лечения рядом авторов предлагается выполнять антрумэктомию. Данное вмешательство приводит к значительному уменьшению числа гастрин-продуцирующих клеток, расположенных в антральном отделе желудка, и как следствие – снижению уровня гастрина с последующим регрессом опухолевой ткани [14, 16, 44, 45]. Показанием к применению более агрессивных методов хирургического лечения являются инвазия мышечного слоя стенки желудка [46]; размер опухоли >2 см, что значительно повышает риск регионарного метастазирования [17]; невозможность выполнения радикального эндоскопического лечения [35]; а также желудочно-кишечное кровотечение при условии невозможности выполнения адекватного эндоскопического гемостаза [47]. Вопрос о применении консервативных методов лечения при НЭО I типа, таких как прием разбавленной соляной кислоты или применение аналогов соматостатина, остается дискуссионным. Поэтому данные подходы могут быть рекомендованы только в случаях, когда проведение эндоскопического или хирургического лечения невозможно [45, 48–50].
При НЭО II типа, как и при I типе, применяют эндоскопические методы лечения, а также аналоги соматостатина, однако прогноз для таких больных в значительной степени определяется успехом лечения основного заболевания, т.е. гастриномы [16, 39, 51].
Основной метод лечения НЭО желудка III типа и низкодифференцированных НЭК G3 – это хирургическое вмешательство в объеме гастрэктомии или резекции желудка с регионарной лимфаденэктомией [48, 52, 53]. При инвазии высокодифференцированной опухоли III типа в пределах слизистой оболочки или подслизистого слоя возможно выполнение и внутрипросветного эндоскопического лечения в объеме эндоскопической резекции слизистой оболочки с диссекцией в подслизистом слое [54].
При мелкоклеточном раке желудка возможно проведение самостоятельной консервативной терапии (химиотерапия, химиолучевая терапия), поскольку результаты хирургического лечения неудовлетворительны и мало отличаются от таковых при консервативном лечении [55, 56].
Метастатические НЭО
Высокодифференцированные НЭО.
В случае метастатических НЭО желудка хирургическое вмешательство в отношении первичного очага и отдаленных метастазов, в частности в печени, оправданно при наличии атипичного карциноидного синдрома или в случае возможности выполнения циторедукции в объеме R0 [57–59]. Более того, выполнение полной циторедукции значительно улучшает показатели общей выживаемости [57–64]. Во всех остальных случаях оптимальным методом остается консервативное лечение.
По данным исследований PROMID и CLARINET, применение аналогов соматостатина при метастатических нерезектабельных НЭО оказывает антипролиферативный эффект, увеличивая время до прогрессирования и показатели общей выживаемости независимо от гормональной активности опухоли [31, 65, 66]. На основании полученных данных терапия высокими дозами аналогов соматостатина (октреотид от 30 мг каждые 28 дней, ланреотид 120 мг каждые 28 дней) является стандартом лечения метастатических форм высокодифференцированных НЭО желудка, главным образом при III типе. В качестве второй линии терапии возможно применение таргетной терапии (эверолимус) и химиотерапии, однако эффективность подобного лечения для НЭО желудка не подтверждена серьезными исследованиями.
Низкодифференцированные НЭО.
В случае генерализованных НЭО G3 схемой терапии первой линии является комбинация цисплатина и этапозида [67], в то время как терапия второй линии в данный момент отсутствует [31]. В проведенном недавно ретроспективном исследовании применение темозоломида и капецитабина данной группой больных позволило добиться частичного ответа от 33% участников, что требует дальнейшего изучения этой комбинации препаратов [68]. Также довольно оптимистичные предварительные результаты были получены при использовании фторурацила или капецитабина в сочетании с оксалиплатином или иринотеканом [69, 70]. В отношении применения лекарственной терапии в адъювантном режиме проведено лишь одно небольшое (n=52) исследование в группе пациентов после резекции печени, которые получали комбинацию фторурацила и стрептозотоцина. Не было отмечено никаких статистически значимых различий в показателях выживаемости между основной и контрольной группами, а также группой исторического контроля [71].
Выводы
НЭО желудка представляют собой неоднородную группу заболеваний, различающихся по клиническому течению, подходам к терапии и прогнозу. В основе правильного выбора лечебной тактики лежит определение нейроэндокринной природы опухоли и ее типа по существующим классификациям. Лечение пациентов с НЭО желудка может варьироваться от малоинвазивных эндоскопических методик (карциноиды I, II типов) до агрессивных программ комбинированного и комплексного лечения (НЭК G3), потому информированность о различиях между разными типами НЭО желудка служит ключевым фактором при выборе лечебной тактики.



