Современные подходы к лекарственной терапии местнораспространенного и метастатического немелкоклеточного рака легкого
Рак легкого является наиболее часто диагностируемым злокачественным новообразованием в мире [1]. В 2012 г. этот диагноз был установлен 1,8 млн больных и составил 12,9% в структуре всех впервые выявленных злокачественных опухолей. Кроме того, рак легкого занимает лидирующую позицию среди причин онкологической смертности в мире, обусловливая пятилетнюю выживаемость, не превышающую 15% [2].
Немелкоклеточный рак легкого (НМРЛ) представляет собой наиболее частый его морфологический тип, частота которого достигает 85–90%. Благодаря достижениям молекулярной онкологии представление о НМРЛ в последние годы претерпело существенные изменения. В настоящее время НМРЛ рассматривается как совокупность различных опухолевых вариантов, идентифицируемых с помощью гистологического субтипирования или молекулярно-генетического анализа [3, 4]. Несмотря на многообразие НМРЛ, принципиальным этапом для выбора оптимальной лечебной тактики является определение его принадлежности к одному из двух патоморфологических типов – плоскоклеточному или неплоскоклеточному раку [5].
Большинство больных НМРЛ нуждаются в проведении лекарственной терапии как на этапе первичной диагностики местнораспространенной или метастатической формы заболевания, так и в случае прогрессирования опухолевого процесса после проведенного ранее радикального лечения [6].
Стандартом современной лекарственной терапии распространенного НМРЛ, не имеющего драйверных онкогенных мутаций, является назначение от четырех до шести циклов платиносодержащих комбинаций цитостатиков [7]. Однако у подавляющего большинства больных в течение полугода развивается прогрессирование злокачественного процесса, а у каждого четвертого пациента какой-либо эффект химиотерапии полностью отсутствует [8].
За последние десятилетия было проведено более 15 рандомизированных клинических исследований, посвященных второй линии лекарственной терапии НМРЛ [9]. Однако практически ни в одном из них не было продемонстрировано значимого улучшения общей выживаемости (ОВ) как в общей популяции пациентов, так и в подгруппах основных гистологических типов: аденокарциномы или плоскоклеточного рака. Исключение составляют исследования BR.21 (сравнение эрлотиниба, ингибитора тирозинкиназы EGFR [Epidermal Growth Factor Receptor], с плацебо) и TAX317 (сравнение доцетаксела с наилучшей симптоматической терапией) [10]. Таким образом, к препаратам, рекомендуемым в настоящее время в качестве второй линии терапии НМРЛ, относятся цитостатики доцетаксел и пеметрексед (последний – для пациентов с неплоскоклеточным раком) и эрлотиниб [11, 12]. Поскольку пеметрексед – один из препаратов выбора в терапии первой линии больных неплоскоклеточным НМРЛ, доцетакселу принадлежит ведущая роль в последующем лекарственном лечении [13]. Клиническая эффективность лекарственной терапии второй линии представляется абсолютно недостаточной: частота объективного ответа не превышает 10%, медианы выживаемости без прогрессирования (ВБП) и ОВ – 3–4 и 7–9 месяцев соответственно [12].
Антиангиогенные препараты в лекарственной терапии местнораспространенного и метастатического НМРЛ
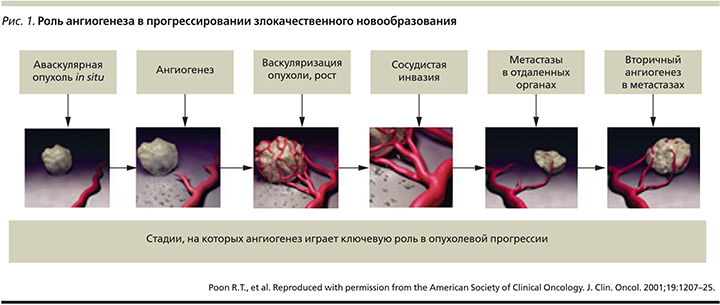
Неудовлетворенная потребность в эффективном и безопасном лекарственном лечении больных распространенным НМРЛ диктует необходимость создания новых препаратов, способных контролировать конкретные молекулярные мишени, ответственные за основные механизмы патологической жизнедеятельности. Одними из важнейших и, как оказалось, эффективных с точки зрения возможностей терапевтического воздействия мишеней являются проангиогенные сигнальные пути, необходимые для роста, развития и метастазирования злокачественной опухоли [14]. Патологический ангиогенез представляет собой процесс образования новых капиллярных кровеносных сосудов опухоли из уже существующей сосудистой сети (рис. 1).
В этом сложном механизме взаимодействует масса различных факторов опухолевых клеток и клеток микроокружения, включая таковые эндотелия и гладкой мускулатуры, перициты и фибробласты. Ключевым фактором ангиогенеза является гипоксия, т.н. включатель ангиогенеза, приводящий к дисбалансу между про- и антиангиогенными факторами. Наиболее хорошо изученным путем, участвующим в опухолевом ангиогенезе, является сигнальный путь VEGF (Vascular Endothelial Growth Factor), включающий 6 факторов роста эндотелия сосудов (от VEGF-A до VEGF-D) и 3 рецептора (VEGFR-1, -2 и -3). Большинство применяемых в настоящее время антиангиогенных препаратов направлены в первую очередь на сигнальный путь VEGF и представляют собой либо моноклональные антитела, либо низкомолекулярные пероральные ингибиторы тирозинкиназ [15, 16].

Роль бевацизумаба в первой линии лекарственной терапии местнораспространенного и метастатического НМРЛ
Первым агентом, одобренным в 2003 г. в комбинации с паклитакселом и карбоплатином для больных распространенным неплоскоклеточным НМРЛ, ранее не подвергавшихся химиотерапии, является бевацизумаб [17]. Препарат представляет собой рекомбинантные гуманизированные моноклональные IgG1-антитела, обладающие способностью селективно связываться с VEGF и ингибировать его биологическую активность, что приводит к подавлению патологического ангиогенеза и улучшению доставки цитостатиков в ткань опухоли. Результаты рандомизированного клинического исследования ECOG-4599 подтверждают, что добавление бевацизумаба к стандартной химиотерапии способствует улучшению ОВ (12,3 против 10,3 месяца, отношение рисков [ОР] – 0,79; p=0,003) и ВБП наряду с увеличением частоты объективных ответов (рис. 2). Следует отметить, что именно применение бевацизумаба впервые в истории лекарственной терапии распространенного НМРЛ обеспечило для 50% больных возможность преодолеть одногодичный рубеж выживаемости [17].
Несмотря на доказанную эффективность бевацизумаба, более чем 10-летний опыт его широкого применения больными НМРЛ позволяет выделить некоторые серьезные недостатки препарата и сформулировать ряд пока еще нерешенных вопросов, затрагивающих всю антиангиогенную стратегию лечения злокачественных солидных опухолей.
Так, бевацизумаб демонстрирует определенную избирательность, реализуя свой терапевтический потенциал только в сочетании с паклитакселом и карбоплатином. Добавление препарата к стандартной комбинации гемцитабина и цисплатина не обеспечивает увеличения выживаемости больных. Кроме того, существуют биологически обоснованные опасения в отношении высокого риска повторной активации опухолевого ангиогенеза при завершении или отмене приема бевацизумаба.
Одной из важнейших характеристик бевацизумаба является специфический профиль его токсичности. Безусловное клиническое значение имеют такие серьезные осложнения препарата, как развитие артериальной гипертензии и тромбоэмболии, высокий риск кровотечений и перфорации полых органов желудочно-кишечного тракта. Побочные эффекты бевацизумаба обусловливают невозможность его применения больными плоскоклеточным НМРЛ, который, как правило, характеризуется центральной локализацией опухоли вблизи магистральных сосудов и крупных дыхательных путей и зачастую сопровождается кровохарканием [18].
Нерешенной до настоящего времени задачей противоопухолевой антиангиогенной терапии остается отсутствие валидированных предиктивных биомаркеров, выявляемых исключительно среди целевой когорты больных НМРЛ [19]. Проведенные исследования циркулирующих в плазме VEGF и VEGFR, плацентарного и инсулиноподобного факторов роста, Е-селектина, ряда генетических маркеров; оценка плотности микрососудов с помощью позитронно-эмиссионной томографии и т.п. не позволили выявить каких-либо значимых корреляций с ожидаемой эффективностью антиангиогенного препарата [20]. Единственная зависимость прослежена между низким исходным уровнем VEGF-A и повышением показателей выживаемости при назначении бевацизумаба.
Механизмы формирования резистентности к антиангиогенным препаратам
Безусловно актуальной проблемой является и развитие резистентности к антиангиогенной терапии вследствие активации альтернативных компенсаторных проангиогенных сигнальных путей. Существованием дублирующих сигнальных путей, по-видимому, объясняется и весьма умеренная эффективность бевацизумаба в комбинации с цитостатиками. Действительно, помимо проангиогенного сигнального пути VEGF в клетках опухоли присутствует множество других, включая сигнальные пути факторов роста фибробластов (FGF) и тромбоцитов (PDGF). Сигнальная система FGF включает 22 полипептидных лиганда и 4 рецептора (FGFR-1-4), которые координируют взаимоотношения между внеклеточным матриксом и сосудистой системой путем регуляции секреции протеаз, интегринов и кадгеринов. Так, сверхэкспрессия FGF-2, мощного стимулятора ангиогенеза, в опухолевых клетках является фактором неблагоприятного прогноза для больных НМРЛ. Лиганды PDGF высвобождаются из тромбоцитов в ответ на повреждение сосудов и связываются с двумя рецепторами (PDGFR-α и -β), которые экспрессируются в перицитах и клетках сосудов гладкой мускулатуры. Это приводит к активации внутриклеточного сигнального пути, способствующего сохранению целостности сосудов и их дальнейшему развитию. К настоящему времени существуют не только экспериментальные, но и клинические данные, подтверждающие способность опухолевых клеток адаптироваться к ингибированию VEGF путем компенсаторной активации PDGF и FGF. Так, в клиническом исследовании с участием больных распространенным колоректальным раком, получавших комбинацию FOLFIRI (иринотекан, фторурацил, кальция фолинат) в сочетании с бевацизумабом, прогрессированию заболевания предшествовало повышение уровня ряда проангиогенных факторов в плазме, в т.ч. FGF и PDGF [19].
Таким образом, целесообразность создания антиангиогенных препаратов, способных ингибировать одновременно несколько сигнальных путей, преодолевая адаптивный механизм резистентности и таким образом обеспечивая более выраженную и длительную эффективность по сравнению с анти-VEGF-направленными агентами, не вызывает сомнений.
Успехи современной фармакологии позволили значительно пополнить арсенал противоопухолевой антиангиогенной терапии как специфическими препаратами, направленными исключительно на сигнальный путь VEGF, так и мультитаргетными ингибиторами тирозинкиназ (рис. 3). В контексте НМРЛ основные исследования эффективности новых блокаторов ангиогенеза в основном проводятся с участием больных, прогрессировавших после первой линии лекарственного лечения [16].
Новые блокаторы ангиогенеза в современной лекарственной терапии местнораспространенного и метастатического НМРЛ
Говоря об эффективности антиангиогенных препаратов во второй линии терапии распространенного НМРЛ, необходимо остановиться на рамуцирумабе, который представляет собой гуманизированные моноклональные IgG1-антитела, обладающие способностью селективно блокировать экстрацеллюлярный домен VEGFR-2, препятствуя таким образом его активации лигандами. В клиническом исследовании II фазы добавление рамуцирумаба к комбинации паклитаксела и карбоплатина в первой линии лекарственной терапии НМРЛ обеспечило достижение медианы ОВ больными, равной 17,9 месяца. Частота объективного ответа составила 55% [20].
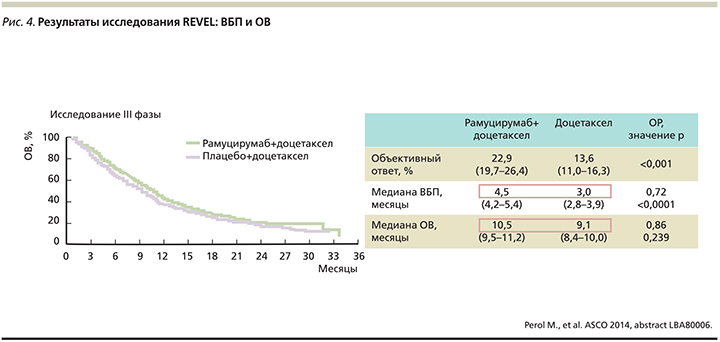
Особого внимания заслуживает крупное плацебо-контролируемое рандомизированное клиническое исследование III фазы REVEL, в котором оценивалась эффективность и безопасность комбинации рамуцирумаба и доцетаксела по сравнению с доцетакселом для 1253 больных распространенным НМРЛ (в т.ч. плоскоклеточным), прогрессировавшим после первой линии платиносодержащей химиотерапии [21]. Это исследование достигло своей первичной цели, продемонстрировав увеличение медианы ОВ больных, получавших доцетаксел в сочетании с рамуцирумабом (10,5 против 9,1 месяца, ОР – 0,86; p=0,023). Также было зарегистрировано увеличение медианы ВБП (4,5 против 3,0 месяца, ОР – 0,76; p<0,0001) и частоты объективных ответов (23 против 14%, p<0,0001; рис. 4).
Необходимо отметить, что улучшение показателей выживаемости было отмечено в большинстве подгрупп пациентов, включая больных плоскоклеточным НМРЛ (9,5 против 8,2 месяца, ОР – 0,88). Спектр осложнений 3/4 степени тяжести в исследуемой и контрольной группах был представлен нейтропенией (49 против 40% больных), фебрильной нейтропенией (16 против 10%), слабостью (14 против 10%) и артериальной гипертензией (6 против 2%). Частота токсических летальных исходов (5 против 6%) и эпизодов легочного кровотечения 3/4 степени (по 1%) практически не различалась между группами. Приемлемый и управляемый профиль токсичности сочетался с удовлетворительными показателями качества жизни пациентов, что имеет принципиальное значение при проведении паллиативных режимов лекарственной терапии [22]. Эффективность рамуцирумаба в комбинации с доцетакселом при всех гистологических вариантах НМРЛ наряду с отсутствием риска возникновения легочного кровотечения делают препарат объектом повышенного интереса именно для больных плоскоклеточным гистотипом опухоли.
В то же время нельзя не отметить ряд спорных моментов в отношении данного клинического исследования. Критерии исключения для больных распространенным НМРЛ: статус ECOG PS 2 и расположение опухоли вблизи крупных сосудов с возможным их вовлечением. Кроме того, возраст более 60% участников исследования не превышал 65 лет. Очевидно, что подобные характеристики не отражают реального распределения больных НМРЛ по их общему состоянию, локализации опухоли и возрасту в условиях рутинной клинической практики.

С учетом достоверного, но клинически малозначимого выигрыша в медиане ОВ пациентов (не более 5 недель) роль рамуцирумаба в общей стратегии лекарственной терапии НМРЛ представляется недостаточно убедительной. По-видимому, необходимо продолжение поиска и идентификации надежных предиктивных маркеров с целью формирования целевых когорт больных НМРЛ.
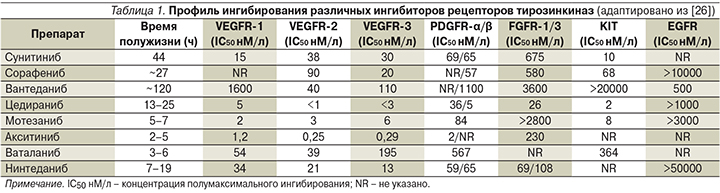
В настоящее время активно изучается значительный терапевтический потенциал в отношении НМРЛ принципиально другой группы блокаторов ангиогенеза, представленной мультитаргетными ингибиторами тирозинкиназ [16]. Как следует из табл. 1, все эти препараты в той или иной степени способны подавлять киназную активность большинства проангиогенных рецепторов. Проведенные клинические испытания II–III фаз таких агентов, как сунитиниб, вандетаниб, цедираниб, мотезаниб и др., как в качестве монотерапии, так и в комбинациях с цитостатиками или эрлотинибом в первой или второй линиях лекарственного лечения НМРЛ продемонстрировали их вклад в увеличение частоты объективных ответов и ВБП [23, 24].
К сожалению, положительного влияния на общую выживаемость больных ни в одном из исследований выявить не удалось, что еще раз подтверждает крайнюю необходимость поиска специфических предиктивных маркеров [25].
Нинтеданиб: от фармакокинетики до результатов клинических исследований II фазы
Особое место среди мультитаргетных тирозинкиназных ингибиторов занимает нинтеданиб (BIBF 1120, Boehringer Ingelheim Pharma), мощный и специфический тройной блокатор всех рецепторов VEGF (-1, -2, -3), FGF (-1, -2, -3) и PDGF (-α, -β). Доклинические исследования нинтеданиба, синтезированного в 1998 г., позволили установить, что препарат реализует свой эффект в фармакологически приемлемых концентрациях. Концентрация полумаксимального ингибирования (IC50) в отношении таргетных киназ VEGFR 1–3-го типов составила от 13 до 34 нмоль/л, FGFR 1–3-го типов – 69, 37 и 108 нмоль/л, PDGFR-α и -β – 59 и 65 нмоль/л соответственно [27].
В отличие от других тирозинкиназных ингибиторов ангиогенеза нинтеданиб обладает более широким спектром действия. Такие агенты, как сорафениб, акситиниб, сунитиниб, цедираниб, ваталаниб, проявляют активность в отношении тирозинкиназ VEGFR и частично – PDGFR. Уникальным же свойством нинтеданиба является блокирование ангиогенного потенциала стромальных клеток, включая перициты. Способность препарата подавлять активность основных стимуляторов васкулогенеза приводит к одновременному и глубокому угнетению большинства альтернативных сигнальных путей, что в свою очередь обеспечивает возможность преодоления резистентности к анти-VEGF-направленной терапии и повышения ее эффективности.
Одним из бесспорных преимуществ нинтеданиба является его уникальный фармакокинетический профиль, характеризующийся значительной продолжительностью ингибирующего действия. Благодаря особенностям фармакокинетики препарата его плазменная концентрация достигает пика уже через 1,3–3,0 часа после перорального приема, а период полувыведения составляет от 7 до 19 часов (в среднем 13,7 часа) [27].
Нинтеданиб продемонстрировал выраженную противоопухолевую активность на ксенографтных моделях различных опухолей, включая НМРЛ, рак яичника и предстательной железы. Большое клиническое значение имеет его способность потенцировать эффект ряда цитостатиков, включая таксаны, путем подавления функции АТФ-связующих кассетных транспортеров, обеспечивающих развитие множественной лекарственной устойчивости [28].
Метаболизм нинтеданиба происходит в печени, причем большая его часть реализуется без участия цитохрома-P450 [29]. Эта особенность фармакокинетики препарата расширяет возможности его комбинирования с различными цитостатиками, метаболизирующимися с помощью ферментов Р450, в т.ч. с доцетакселом. Дальнейшие клинические исследования I фазы подтвердили, что между нинтеданибом и цитостатиками не возникает клинически значимого фармакокинетического взаимодействия и, следовательно, отсутствует необходимость редуцирования дозы препаратов в комбинации [30].
На основании результатов нескольких исследований I фазы для клинического применения была определена доза нинтеданиба, равная 400 мг/сут, разделенная на 2 приема с интервалом 12 часов. Основные проявления токсичности, в т.ч. дозолимитирующей: повышение концентрации ферментов печени (АЛТ, АСТ, γ-ГТП), тошнота, рвота, боли в животе, диарея и кожная сыпь [31].
Безопасность и эффективность монотерапии нинтеданибом (в дозе 150 или 250 мг 2 раза в сутки) для больных распространенным НМРЛ, нуждающихся в лекарственной терапии второй или третьей линии, были оценены в ходе рандомизированного двойного слепого клинического исследования II фазы [32]. Медиана ВБП для 73 пациентов составила 6,9 недели, медиана ОВ – 21,9 недели, существенных различий между группами выявлено не было. В то же время исследователи зарегистрировали значительное увеличение медианы ВБП и ОВ (до 11,6 и 37,7 недели соответственно) у больных, имевших удовлетворительный функциональный статус (ECOG PS 0-1). У 35 (48%) больных была достигнута стабилизация заболевания, у одного пациента, принимавшего нинтеданиб в дозе 500 мг/сут, – частичный регресс. При оценке профиля токсичности обращала на себя внимание низкая частота осложнений, характерных для других антиангиогенных препаратов, таких как артериальная гипертензия, тромбоэмболии, кровотечения [32].
Нинтеданиб в комбинации с доцетакселом в качестве второй линии лекарственной терапии местнораспространенного и метастатического НМРЛ (клиническое исследование LUME-Lung 1)
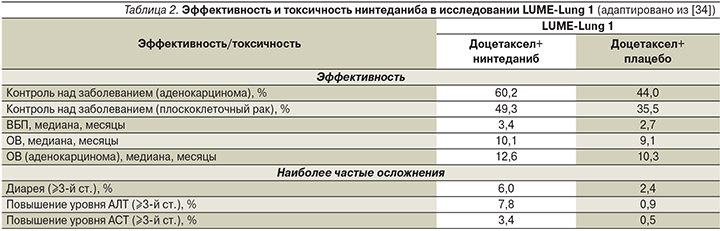
Основные данные о терапевтических возможностях нинтеданиба для больных НМРЛ, нуждающихся в проведении второй линии лекарственной терапии, были получены из двух крупных многоцентровых рандомизированных исследований III фазы [33]. В рандомизированном двойном слепом плацебо-контролируемом исследовании LUME-Lung 1 проводилась оценка эффективности и безопасности нинтеданиба и доцетаксела в качестве препаратов второй линии для 1314 пациентов с распространенным или метастатическим НМРЛ любого гистологического типа. В результате проведенной рандомизации 665 пациентов получали комбинацию доцетаксела (по 75 мг/м2 внутривенно в 1-й день цикла каждые 3 недели) и нинтеданиба (по 200 мг 2 раза в сутки внутрь со 2-го по 21-й день цикла). В контрольной группе, состоявшей из 659 больных, проводилась лекарственная терапия доцетакселом в аналогичной дозе в сочетании с плацебо. Первичной конечной точкой стала ВБП, вторичной – ОВ, оцениваемая в определенной последовательности: сначала для пациентов с аденокарциномой легкого, прогрессировавшей в ближайшие 9 месяцев после начала лекарственной терапии первой линии, затем для всех больных аденокарциномой и в завершение – для всей популяции в целом. Лечение осуществлялось до прогрессирования заболевания или возникновения неприемлемых побочных реакций [33, 34].
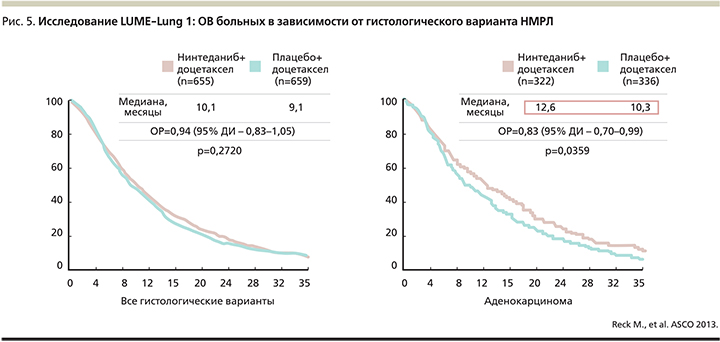
По окончании периода наблюдения, медиана которого составила 31,7 месяца, ОВ была значительно выше в группе больных, получавших комбинацию доцетаксела и нинтеданиба, имевших гистологический подтип аденокарциномы (медиана ОВ – 12,6 против 10,3 месяца, ОР – 0,83 [95% ДИ – 0,70–0,99]; p=0,0359). Медиана ОВ также была выше у пациентов исследуемой группы, имевшей железистый НМРЛ, прогрессировавший в течение 9 месяцев от начала лекарственной терапии первой линии, по сравнению с больными контрольной группы (10,9 против 7,9 месяца, ОР – 0,75 [95% ДИ – 0,60–0,92]; p=0,0073; рис. 5).
В общей популяции пациентов (вне зависимости от гистологического типа НМРЛ) различия между обеими группами больных в отношении ОВ отсутствовали (10,1 против 9,1 месяца, ОР – 0,94 [95% ДИ – 0,83–1,05]; p = 0,2720). Также не было выявлено статистически значимых преимуществ в ОВ у пациентов, имевших плоскоклеточный гистологический вариант НМРЛ.
Добавление нинтеданиба к доцетакселу позволило добиться повышения частоты контроля заболевания по сравнению с комбинацией доцетаксела и плацебо у всех больных исследуемой группы (54 против 41,3%; ОР – 1,68 [95% ДИ – 1,35–2,09], p <0,0001). Следует отметить, что аналогичные результаты были отмечены и у больных плоскоклеточным НМРЛ, получавших комбинацию доцетаксела и нинтеданиба (49,3 против 35,5%; ОР – 1,78 [95% ДИ – 1,26–2,51], p <0,0001; табл. 2). Различия между группами в частоте объективных ответов в пользу комбинации с нинтеданибом были зарегистрированы в популяции больных аденокарциномой, особенно – аденокарциномой, прогрессировавшей в течение 9 месяцев от начала первой линии лекарственной терапии (4,9 против 1,5%; ОР – 3,54 [95% ДИ – 1,06–6,03], p=0,0393; рис. 6) [33, 34].
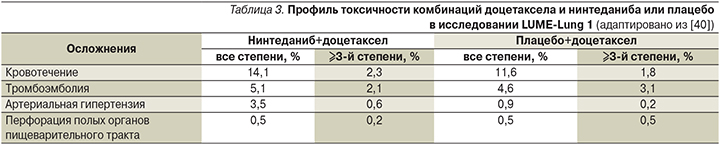
Наиболее частые проявления токсичности ¾-й степени, наблюдавшиеся при назначении комбинации доцетаксела и нинтеданиба, были представлены диареей (6,0 против 2,4%) и обратимым повышением концентрации АЛТ (7,8 против 0,9%) и АСТ (3,4 против 0,5%). Большинство осложнений поддавались коррекции с помощью сопроводительной терапии или редуцирования дозы препаратов. Частота нежелательных явлений, сопровождавших применение других антиангиогенных препаратов, таких как артериальная гипертензия, кровотечения, перфорации органов желудочно-кишечного тракта, тромбоэмболии, была сопоставимой в обеих группах [33, 34, 40] (табл. 3).
Следует подчеркнуть, что улучшение ОВ пациентов, имевших железистый гистотип НМРЛ и получавших комбинацию доцетаксела и нинтеданиба, было достигнуто без ухудшения показателей качества жизни [35].
Нинтеданиб в комбинации с пеметрекседом в качестве второй линии лекарственной терапии местнораспространенного и метастатического НМРЛ (клиническое исследование LUME-Lung 2)
В рамках рандомизированного двойного слепого исследования III фазы LUME-Lung 2 изучалась безопасность и эффективность комбинации нинтеданиба и пеметрекседа в качестве второй линии лекарственной терапии больных распространенной аденокарциномой легкого [36]. Из 713 рандомизированных пациентов 353 получали пеметрексед в дозе 500 мг/м2 однократно каждые 3 недели в сочетании с нинтеданибом в дозе 400 мг/сут и 360 – пеметрексед в идентичной дозе в комбинации с плацебо до прогрессирования заболевания или развития неприемлемых явлений токсичности. Медиана ВБП, являвшаяся основной конечной точкой данного исследования, была несколько выше в группе нинтеданиба (4,4 против 3,6 месяца; ОР – 0,83 [95% ДИ – 0,7–0,99], p=0,04). Однако различий в общей выживаемости больных между двумя группами достичь не удалось (12 против 12,7 месяца; ОР – 1,01 [95% ДИ – 0,85–1,21], p=0,8940). Принимая во внимание тот факт, что в исследовании LUME-Lung 2 не участвовали пациенты, имевшие плоскоклеточный гистологический вариант НМРЛ, причина отсутствия преимуществ комбинации пеметрекседа и нинтеданиба остается неясной [36]. Следует отметить, что в данном исследовании назначение нинтеданиба также не сопровождалось увеличением частоты осложнений, характерных для большинства антиангиогенных препаратов, таких как артериальная гипертензия, тромбоэмболии, кровотечения и перфорации полых органов желудочно-кишечного тракта.
Выводы и перспективы
Бесспорные достижения современной молекулярной онкологии позволяют предположить, что число генетических нарушений, обнаруживаемых в онкогенных сигнальных путях НМРЛ, будет неуклонно возрастать. Однако клиническая значимость выявляемых дефектов и возможность терапевтического воздействия на них могут быть определены значительно позднее. Таким образом, на протяжении ближайших лет по-прежнему будет существовать значительная группа больных распространенным НМРЛ, не являющихся кандидатами для таргетной терапии, но нуждающихся в системном лекарственном лечении. Применение антиангиогенных препаратов данной когорты пациентов позволяет направленно и эффективно воздействовать на множественные сигнальные пути, лежащие в основе прогрессирования опухолевого процесса.
Как указано выше, нинтеданиб является первым антиангиогенным препаратом, применение которого обеспечивает увеличение ВБП и ОВ у больных неплоскоклеточным НМРЛ в случае отсутствия или исчерпания эффекта стандартной лекарственной терапии первой линии, в т.ч. с включением бевацизумаба [37]. Тем не менее для определения пределов терапевтического потенциала нинтеданиба необходимо проведение более глубокого коррелятивного анализа биологических механизмов, лежащих в основе его эффективности в определенных субпопуляциях пациентов [39]. В настоящее время продолжается активный поиск специфических маркеров эффективности антиангиогенных препаратов, в первую очередь направленный на выявление различных генетических дефектов стимуляторов неоангиогенеза. В то же время большинство исследователей признают, что с учетом высокой динамичности процессов ангиогенеза идентификация клинически значимых биомаркеров в плазме и ткани опухоли представляет собой весьма труднодостижимую задачу.
Большой интерес представляет выявление такого клинического предиктора эффективности нинтеданиба, как прогрессирование НМРЛ в течение 9 месяцев от начала первой линии лекарственной терапии. Молекулярно-генетические исследования в этой области позволяют выдвинуть следующую гипотезу: высокая экспрессия генов, ответственных за пролиферацию, указывает на то, что значительная фракция опухолевых клеток нуждается в повышенном обеспечении кислородом и питательными веществами для поддержания биосинтетических процессов и, следовательно, в высоком уровне патологической васкуляризации. Интенсивно пролиферирующие опухоли содержат наиболее высокий процент незрелых сосудов, зависимых от стимулирующих сигналов различных факторов роста. Осуществляя тройную блокаду патологического ангиогенеза, нинтеданиб в комбинации с доцетакселом обеспечивает клинически значимую эффективность для пациентов с быстропрогрессирующей аденокарциномой легкого [38].
Несомненно, требуется проведение дальнейших клинических исследований, направленных на изучение терапевтических возможностей нинтеданиба как в монотерапии, так и в комбинации с другими противоопухолевыми агентами, в отношении определенных групп больных НМРЛ с теми или иными молекулярно-генетическими особенностями опухоли. Представляется, что результаты подобных исследований позволят в будущем выделять когорты пациентов, обладающих специфическими характеристиками заболевания и, следовательно, наиболее восприимчивых к антиангиогенной противоопухолевой терапии. Успешным завершением клинических исследований в этом направлении безусловно будет разработка стандартов индивидуализированной терапии НМРЛ с учетом надежных предиктивных биомаркеров.
В завершение следует подчеркнуть, что результаты рандомизированных клинических исследований комбинации нинтеданиба и доцетаксела свидетельствуют о ее эффективности для больных распространенной аденокарциномой легкого в качестве второй линии лекарственной терапии [40]. Приемлемый и управляемый профиль токсичности, отсутствие негативного влияния на качество жизни пациентов подтверждают большой терапевтический потенциал данной схемы и позволяют ей занять одну из основных позиций в арсенале противоопухолевого лечения прогрессирующего неплоскоклеточного НМРЛ [37].



