Одной из основных проблем как дерматовенерологии, так гинекологии и урологии является лечение инфекций половых путей. Неспецифические и специфические инфекции половых органов занимают ведущее место в структуре заболеваемости этих специальностей и являются одной из основных причин нарушения репродуктивной функции.
Несмотря на широкое внедрение антибактериальных лекарственных средств, инфекции половых органов остаются широко распространенными. Кроме отдельных инфекций, передаваемых половым путем (ИППП), серьезную проблему представляют сочетанные, или коинфекции. С учетом общности путей передачи пациент может инфицироваться одновременно несколькими возбудителями ИППП (например, бактерии+вирусы+простейшие и др.), т.е. развивается коинфекция.
Следует признать, что в настоящее время наблюдается неуклонная тенденция к ассоциации возбудителей ИППП, возникновению сочетанных инфекций, что, несомненно, существенно ухудшает течение и прогноз заболевания. Наиболее вероятной причиной формирования коинфекций служит неэффективность антибактериальной терапии. Неправильный выбор препарата, его дозы, несоблюдение больным режима приема, как правило, приводят лишь к стиханию острых симптомов и развитию хронического процесса [1]. Кроме этого вероятны снижение чувствительности возбудителей к химиотерапии, мутации с формированием резистентных штаммов, устаревшие, малоинформативные методы диагностики [2], в т.ч. у полового партнера и т.д.
По данным многих авторов, хламидии, вирусы, уреа- и микоплазмы практически не встречаются в качестве моновозбудителей воспалительных заболеваний гениталий, а, как правило, входят в состав сложных микробных ассоциаций. Так, в Москве микст-формы выявлены в 52% случаев, из них более трети (34,3%) имели сочетание трех и более возбудителей. Общая распространенность урогенитального хламидиоза среди популяции больных воспалительными заболеваниями гениталий составила 23,1%, уреа- и (или) микоплазмоза – 11,5%, вирусных поражений – 3,2%, кандидоз половых органов отмечен в 33,1% случаев [3].
Для сравнения: в недавнем исследовании в Южной Корее среди женщин, обратившихся с жалобами, мультиплексный ПЦР (полимеразная цепная реакция)-анализ выявил, что 91,7% с Trichomonas vaginalis были инфицированы двумя и более патогенами; Mycoplasma hominis была на 1-м месте, за ней следовали Ureaplasma urealyticum и Chlamydia trachomatis [4].
В США при популяционном скрининге женщин у инфицированных T. vaginalis коинфекция с Chlamydia trachomatis и Neisseria gonorrhoeae отмечена в 7,8 и 2,7% соответственно [5].
Таким образом, анализ существующих тенденций, причем в разных регионах мира (!), свидетельствует, что значительная часть инфекционной патологии урогенитального тракта сочетанна. Поэтому в случаях предполагаемого наличия коинфекции диагностика и лечение должны носить комплексный характер.
В настоящее время к возбудителям ИППП относятся более 30 различных бактерий, вирусов, грибков, простейших и других паразитов. Кроме негативного влияния на здоровье человека и снижение качества жизни ИППП оказывают выраженное воздействие на репродуктивную функцию человека.
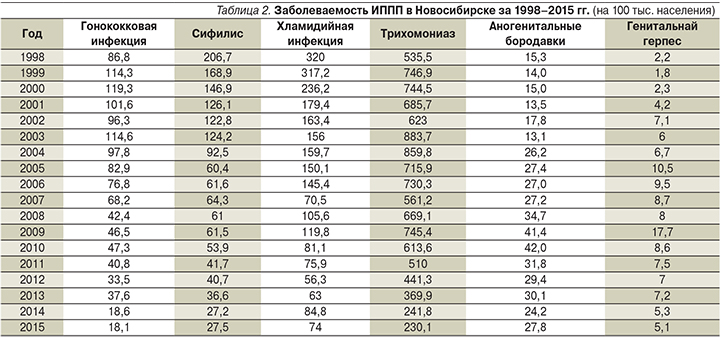
По данным официальной статистики, заболеваемость трихомонадной инфекцией в Российской Федерации (РФ) лидирует среди ИППП за последние десятилетия. При этом отмечены региональные различия: так, в Новосибирске за последние годы уровень заболеваемости трихомониазом превышал общероссийские показатели более чем в 3 раза (в 2015 г. в 3,8 раза) (табл. 1). Сходная, но менее неблагоприятная ситуация отмечается в отношении хламидийной инфекции (превышение в 1,8 раза).
Отмечаются отчетливые половые различия среди зарегистрированных больных трихомониазом: женщины инфицированы значительно чаще, чем мужчины (в 1,8 раза). Наиболее высокий уровень заболеваемости ИППП закономерен в возрастной группе 18–29 лет.
Как видно из табл. 2, заболеваемость всеми ИППП за последние два десятилетия снижалась, однако трихомониаз остается наиболее частой инфекцией, по числу выявленных случаев сопоставимой со всеми другими вместе взятыми (60%).
Наибольший пик заболеваемости генитальным герпесом и аногенитальными бородавками зарегистрирован в 2009 г. (в 2 раза выше, чем в предыдущие и последующие годы). Подобный же рост заболеваемости в 2009 г. был отмечен и в отношении невирусных ИППП: урогенитального трихомониаза и хламидиоза. При этом обращает на себя внимание крайне низкий показатель заболеваемости генитальным герпесом (5,1 случая на 100 тыс. населения в 2015 г. и 2,2 – в 1998-м).
Согласно официальной статистике, этот факт может свидетельствовать о неполной регистрации выявленных случаев генитального герпеса, т.к. регистрация случаев проводится только в системе кожно-венерологических диспансеров. По всей видимости, регистрация и диагностика ИППП не всегда оптимальны.
Таким образом, указанные урогенитальные инфекции могут иметь самые различные сочетания среди как абсолютных бактериальных и вирусных патогонов (трихомонадная, хламидийная, гонококковая, герпесвирусная, папилломавирусная инфекции), так и условно-патогенных микроорганизмов (бактериальный вагиноз, кандидоз, уреаплазмоз и др.), что значительно усложняет и лабораторную диагностику, и терапию сочетанных ИППП.
Лабораторная диагностика ИППП
Лабораторная диагностика – один из ключевых факторов контроля распространения ИППП на территории РФ. Установление точного этиологического диагноза и назначение адекватного лечения без лабораторного подтверждения не представляются возможными.
Современная лабораторная база располагает обширным арсеналом общеизвестных и инновационных технологий, которые могут быть с успехом использованы для диагностики ИППП. Из перечня проводимых диагностических исследований ИППП необходимо исключить рутинные, малоинформативные и не соответствующие современным требованиям методы, включать современные высокотехнологичные методы, обладающие высокой чувствительностью и специ-фичностью.
Залогом высокого качества выполнения лабораторных исследований служит наличие в лабораториях высококвалифицированных, профессионально компетентных специалистов, владеющих современными диагностическими технологиями. Всемирная организация здравоохранения (ВОЗ) рекомендует выделять три типа лабораторий: периферийные, обеспечивающие медицинскую помощь в первичном звене здравоохранения, имеющие минимальное лабораторное оборудование, использующие для диагностики ИППП быстрые тесты; лаборатории промежуточного уровня, оказывающие медицинскую помощь в первичном звене здравоохранения, в районных клиниках и госпиталях; центральные, обеспечивающие работу учреждений высокого уровня, в т.ч. специализированных клиник для больных ИППП.
В настоящее время в диагностике ИППП приоритетны прямые методы исследования. Выявление возбудителя или его генетического материала служит абсолютным подтверждением окончательного диагноза.
Для выявления N. gonorrhoeae, T. vaginalis используются культуральная диагностика и метод ПЦР, включенные в Федеральные клинические рекомендации Российского общества дерматовенерологов и косметологов (РОДВК) по ведению больных ИППП. Метод микроскопии используется только в отношении определенных категорий больных: например, для выявления гонококковой инфекции у мужчин с клинически выраженными симптомами или трихомонадной инфекции у женщин с клинически выраженными симптомами (в последнем случае предпочтение отдается методу влажного мазка) [10].

Для идентификации C. trachomatis, Mycoplasma genitalium, Herpes simplex virus 1, 2, Human papillomavirus используются только методы амплификации нуклеиновых кислот (МАНК), прежде всего ПЦР [10].
При проведении ПЦР у ряда возбудителей (вирус герпеса, вирус папилломы человека) выявляется еще и генотип, что может иметь решающее значение при выборе тактики ведения больных и определении прогноза жизни человека
Существуют и другие методы прямой детекции возбудителей ИППП: прямая иммунофлюоресценция (ПИФ) и иммуноферментный анализ (ИФА) для определения антигенов возбудителей, но они существенно уступают МАНК в чувствительности и специфичности и не рекомендованы к использованию [10].
Определение антител к возбудителям ИППП методом ИФА служит для установления предполагаемого диагноза ИППП и может быть рекомендовано только для установления диагноза сифилиса – системной хронической инфекции со сложной иммунологической перестройкой и частым скрытым течением [10].
Для верификации диагноза гонореи, трихомониаза, урогенитального хламидиоза, микоплазменной, папилломавирусной инфекций определение содержания антител к возбудителю методом ИФА не рекомендуется, т.к. при этом не выявляется период «серологического окна», когда иммунный ответ на внедрение возбудителя еще не развился. При этом выявляемые антитела могут быть свидетелем ранее перенесенной, а не активной инфекции, а применяемые тест-системы ИФА нередко не обладают высокими чувствительностью и специфичностью, что не позволяет избегать ложноотрицательных и ложноположительных результатов. Выявление антител к возбудителям при ИППП может быть рекомендовано только для проведения эпидемиологических исследований и при установлении этиологии воспалительных заболеваний органов малого таза (ВЗОМТ).
Таким образом, крайне важно использовать только достоверные и регламентирующие методы лабораторной диагностики для выявления ИППП. Предпочтение в диагностике ИППП отдается современным прямым методам исследования.
Рациональная этиотропная терапия ИППП
В настоящее время для лечения многих ИППП установлены определенные классы антибиотиков. Внутри них уже определены наиболее оптимальные представители, которые являются рекомендуемыми средствами в лечении этих инфекций c позиции принципов доказательной медицины. Как известно, в основе доказательной медицины («Evidence-based medicine», или «Медицина, основанная на доказательствах») лежит технология поиска, анализа, обобщения и применения медицинской информации, позволяющая принимать оптимальные клинические решения в реальной медицинской практике. Информация, которую врач получает из наиболее научно обоснованных публикаций (рандомизированные плацебо-контролируемые многоцентровые исследования, мета-анализы, систематические обзоры и т.д.), на сегодняшний день наиболее достоверна [6].
Так, например, в последние десятилетия к основным антибактериальным препаратам в лечении гонореи относятся цефалоспорины, среди которых первое место занимает цефтриаксон. Существует ряд консенсусов (ВОЗ, Руководство по лечению ИППП США по контролю и профилактике заболеваний [СDC – Centers for Disease Control and Prevention], Европейское руководство по лечению ИППП, Федеральные клинические рекомендации РОДВК по ведению больных ИППП), настоятельно регламентирующие использование цефтриаксона в качестве основного препарата в лечении гонококковой инфекции [7–11]. Поскольку в мире проведены рандомизированные контролируемые исследования, в результате которых доказана 99–100%-ная микробиологическая и клиническая эффективность цефтриаксона в отношении гонококковой инфекции и практически не выявлено штаммов N. gonorrhoeae, резистентных к цефтриаксону, в случае неосложненной гонореи теоретически можно не проводить лабораторного контроля излеченности. Лишь крайне малое число пациентов возвращаются с сохраняющимися жалобами после лечения, что можно объяснить как реинфекцией, так и наличием сопутствующих ИППП.
Таким образом, рациональным подходом в терапии гонококковой инфекции является использование лекарственного средства (цефтриаксона), которое имеет убедительное обоснование с позиции принципов доказательной антимикробной терапии.
В современных рекомендациях CDC (2015) по лечению ИППП в терапии трихомонадной инфекции метронидазол и тинидазол являются препаратами, одобренными для перорального и парентерального применения [8].
В Российских клинических рекомендациях (РОДВК, 2012; РОУ – Российское общество урологов, 2015) кроме вышеуказанных препаратов также рекомендуется использование орнидазола.
В качестве первой линии указано курсовое применение препаратов, однократное введение рекомендуется как альтернативная терапия [10, 11].
Клинические исследования, проведенные в РФ и на Украине, выявили лучшие показатели использования орнидазола по сравнению с метронидазолом. В Новосибирске терапия этими препаратами проведедена мужчинам с урогенитальным трихомониазом в виде моноинфекции. Клиническая эффективность метронидазола составила 57,6%, орнидазола – 94,5% (p<0,001), микробиологическая – 77,1 и 98,2% соответственно (p<0,001) [12]. В Уфе микробиологическая эффективность метронидазола и орнидазола составила 78,9 и 97,4%, а клиническая эффективность – 63,2 и 94,9% [13]. Сходные результаты получены на Украине: терапевтический эффект при лечении трихомониаза у мужчин составил 67,8% при приеме метронидазола и 92,3% для орнидазола [14].
Только у 10,5% больных трихомониаз протекает как моноинфекция, в 89,5% наблюдений выявляют смешанные мочеполовые инфекции в различных ассоциациях. Наиболее часто отмечается ассоциация T. vaginalis с микоплазмами (47,3%), гонококками (29,1%), гарднереллами (31,4%), уреаплазмами (20,9%), хламидиями (18,2%) и грибами (15,7%) [15].
Отечественные исследователи также отмечают высокий процент излеченности орнидазолом хронической трихомонадной инвазии у больных микстхламидийной мочеполовой инфекцией (клинической в 88,9% и бактериологической в 83,3% случаев при наблюдении в течение двух недель после окончания лечения соответственно) [15].
Таким образом, для эффективной элиминации инфекционного агента, в частности T. vaginalis, было бы этиологически оправданным использование лекарственных препаратов, влияющих и на другие сопутствующие возбудители при сочетанной урогенитальной инфекции.
М.А. Гомберг и соавт. полагают, что выбор антибактериальной терапии должен проводиться на основании результатов микробиологических исследований. Если же такой возможности нет, может применяться эмпирический подход, при котором предпочтительным выглядит назначение комбинации производных нитроимидазолов (орнидазол) с фторхинолонами (офлоксацин) [16].
Таким комбинированным препаратом является Комбифлокс, содержащий два активных компонента – орнидазол и офлоксацин, каждый из которых рекомендован РОДВК и РОУ 2015 г. при инфекциях мочевых путей и хроническом бактериальном простатите [10, 11].
Офлоксацин высокоэффективен в отношении всех уропатогенов, часто или редко встречающихся, а также в отношении полирезистентных микроорганизмов любой локализации. Офлоксацин особенно показан при воспалительных заболеваниях органов малого таза, т.к. он высокоактивен в отношении хламидий, а в отношении микоплазм и уреаплазм его эффективность сопоставима с другими фторхинолонами и доксициклином. В дополнение к нему следует назначать лишь орнидазол, с которым он совместим, чтобы охватить анаэробные микроорганизмы. Офлоксацин с 1993 г. рекомендован CDC для применения при амбулаторном лечении острых гинекологических инфекций (400 мг офлоксацина 2 раза в сутки в течение 14 дней) [8]. Офлоксацин не уничтожает защитных комменсалов, например лактобацилл во влагалище, которые препятствуют колонизации другими микроорганизмами. Поэтому риск суперинфекции становится крайне малым.
Установлено, что офлоксацин эффективен при неосложненнных и осложненных, острых и хронических, повторных и рецидивирующих урогенитальных инфекциях с частотой положительных результатов от 90 до 100% [16].
Показания к применению орнидазола и офлоксацина: смешанные бактериальные инфекции, вызванные чувствительными грамположительными и грамотрицательными микроорганизмами в ассоциации с анаэробными микроорганизмами и/или простейшими, а именно: патология почек (пиелонефрит), нижних мочевыводящих путей (цистит, уретрит), половых органов и органов малого таза (эндометрит, сальпингит, оофорит, цервицит, параметрит, простатит, кольпит, орхит, эпидидимит).
Таким образом, уникальная комбинация в одной таблетке Комбифлокса двух активных молекул – орнидазола и офлоксацина – позволяет избегать излишней полипрогмазии во врачебных назначениях, тем самым минимизировать и максимально упрощать для пациентов курс лечения осложненных и рецидивирующих ИППП.
Для профилактики полипрогмазии, существенно влияющей не столько на покупательную способность пациента (учитывая необходимость приобретения дорогостоящих импортных препаратов), сколько на пропорциональное увеличение количества побочных эффектов и самое главное – непредсказуемое взаимодействие медикаментов различных химических групп, необходим поиск препаратов, влияющих одновременно на различные патогены, а также разные звенья патогенеза и патофизиологии заболевания. Реальной иллюстрацией этого тезиса служит новый подход к урогенитальной патологии, вызванной сочетанной хламидийной и микоплазменной инфекциями.
В 2015 г. европейские стандарты по лечению ИППП включили рекомендации по лечению воспалительных заболеваний, обусловленных М. genitalium. Впервые наличие признаков данной инфекции приравнивается к патогенным возбудителям ИППП. При этом только азитромицин рекомендован к лечению М. genitalium: 1 г однократно или по 500 мг в первый день и по 250 мг в последующие 4 суток. При неосложненной урогенитальной хламидийной инфекции также используется азитромицин 1 г однократно [9, 17, 18].
Таким образом, азитромицин – единственный препарат, рекомендованный европейским руководством по лечению ИППП для эрадикации сочетанной урогенитальной инфекции, вызванной C. trachomatis и M. genitalium.
Иммуномодулирующая терапия ИППП
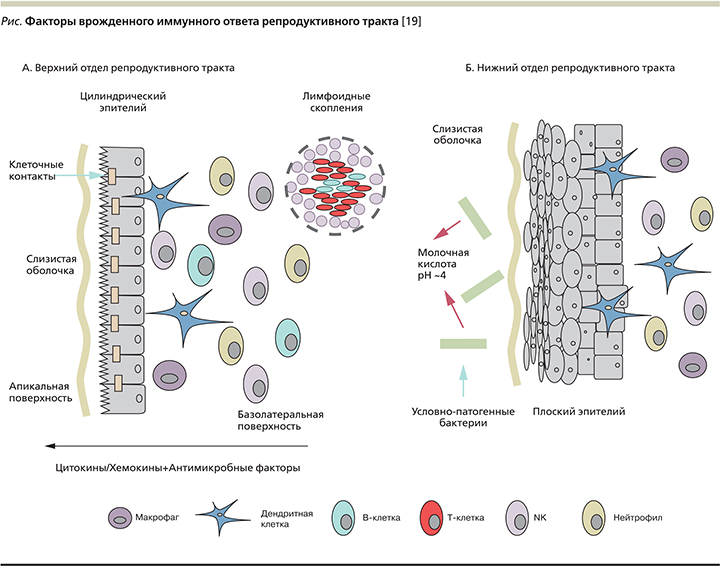
Как известно, воспаление – это основная эффекторная функция иммунной системы. Если иммунная система не справляется с чужеродными агентами из-за недостаточности ее функционирования, тогда воспаление развивается атипично (хронизация процесса). Токсические факторы инфекционных агентов подавляют фагоцитарную активность лейкоцитов. Как правило, незавершенный фагоцитоз приводит к хронизации воспалительного процесса и формированию вторичного иммунодефицита. На рисунке указаны факторы врожденного иммунного ответа верхнего и нижнего отделов репродуктивного тракта [19].
Таким образом, в основе хронического воспаления лежит неспособность иммунной системы завершать патологический процесс, что связано уже не столько с чужеродным агентом, сколько с нарушениями в самой иммунной системе. В связи с этим иммунотропная терапия – это активное воздействие на иммунную систему с целью нормализации ее функционального состояния.
Следует изначально отметить, что если подходы к этиотропной терапии ИППП достаточно хорошо разработаны и внедрены в практику на уровне стандартизованных протоколов, то иммуномодулирующая терапия ИППП до сих пор остается поводом для многочисленных дискуссий. Однако, несмотря на отсутствие согласованных принципов иммуномодулирующей терапии ИППП, многие специалисты связывают надежды по оптимизации результатов именно с данным видом лечения.
В настоящее время можно выделить несколько основных групп лекарственных препаратов, обладающих иммуномодулирующими свойствами: экзогенные препараты (микробные, растительные, нуклеиновые кислоты и др.); химически чистые синтетические (низкомолекулярные, высокомолекулярные) и эндогенные препараты (цитокины: интерфероны [ИФН], фактор некроза опухоли [ФНО], колониестимулирующий фактор, интерлейкины, индукторы ИФН, другие иммунорегуляторные пептиды: тимические, костно-мозговые).
Современные принципы лечения ИППП предусматривают назначение помимо препаратов с этиотропным действием еще и средств, воздействующих на иммунную систему. Однако иммуностимуляторы старого поколения обладают большим числом побочных эффектов и нередко плохо переносятся больными. Поэтому особенно актуальной стала задача разработки новых препаратов, сочетающих высокую эффективность и безопасность.
Препарат нового поколения глюкозаминилмурамилдипептид (ГМДП, Ликопид) отвечает этим требованиям. ГМДП является иммуномодулятором, т.е. обладает способностью стимулировать ослабленный иммунитет и подавлять избыточную активность иммунной системы. ГМДП – это природный регулятор иммунитета, он является универсальным минимальным фрагментом бактериальной стенки, отвечающим за иммуномодулирующее действие целых бактерий. При хорошем иммунитете происходит переваривание макрофагами бактерий нормальной микрофлоры, при этом освобождается ГМДП, что приводит к активации фагоцитов, продукции медиаторов иммунитета – цитокинов, и запуску звеньев клеточного и гуморального иммунитета. Этот механизм обеспечивает естественную стимуляцию иммунной системы человека в течение всей его жизни.
ГМДП – это современный высокотехнологичный препарат, разработанный в результате длительной работы учеными из Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова Российской академии наук. Ликопид прошел доклинические и клинические испытания в России и Великобритании и показал высокую эффективность в лечении и профилактике многих заболеваний, обусловленных снижением иммунитета, в т.ч. бактериальной, вирусной и цитомегаловирусной инфекций. Ликопид не только эффективен, но и безопасен, т.к. при использовании его по медицинским показаниям в рекомендуемых дозах не отмечено побочных эффектов.
Таким образом, ГМДП обеспечивает повышение антиинфекционной и общей резистентности организма. При включении Ликопида в комплексную терапию инфекций клетки моноцитарно-макрофагального звена иммунной системы приобретают способность более эффективно распознавать и уничтожать бактерии и клетки, инфицированные вирусами, что значительно повышает эффективность антибактериальной и противовирусной терапии.
Активное внедрение в клиническую практику иммуномодулирующей терапии в первую очередь было связано с получением многочисленных данных об изменениях иммунологического статуса пациентов, страдающих ИППП, и сделанных на этом основании предположениях о целесообразности их медикаментозной коррекции. Для ИППП выделен ряд типичных и патогенетически обоснованных изменений иммунологического статуса. Так, у пациентов с ИППП (например, при урогенитальной хламидийной инфекции) часто регистрируется достоверное, но не выходящее за рамки нормативных значений снижение фагоцитарной активности моноцитов и гранулоцитов периферической крови. Способность макрофагов к поглощению чужеродных агентов при данной патологии хотя и имеет тенденцию к снижению, но всегда остается удовлетворительной. Феномен перехода во внутриклеточную фазу рассматривается как один из важнейших защитных механизмов изучаемых микроорганизмов. Обладая рядом механизмов, позволяющих избегать завершенного фагоцитоза, патогены создают себе благоприятную среду для персистенции и размножения, а также активной диссеминации в органы и ткани макроорганизма, резко снижают свою иммуногенность.
В настоящее время можно выделить несколько патогенетических механизмов «ускользания» патогена от адекватного бактерицидного взаимодействия с фагоцитами:
Во-первых, большинство внутриклеточных патогенов обладает способностью к избирательному поражению клеток «хозяина». Такими клетками-мишенями могут быть «непрофессиональные» фагоциты: эпителиальные, эндотелиальные и другие клетки, обладающие несовершенной противомикробной защитой, а также макрофаги, утратившие в процессе дифференцировки пероксидазную систему.
Во-вторых, многие возбудители ИППП обладают способностью путем активной модификации исчезать из эндоцитов вскоре после поглощения макрофагом. Использование этого пути поддерживает патогенетический механизм, позволяющий патогенам не быть растворенными и переваренными в лизосомах [20].
В-третьих, процесс активации макрофагов в условиях доминирующего Th2-ответа, сопровождающегося продукцией ряда цитокинов (трансформирующий фактор роста β – TФР-β; интерлейкин-4 – ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10), приводит к снижению продукции оксида азота, ФНО-α, перекиси водорода, необходимых для эффективной бактерицидной активности клеток [20].
Излишняя продукция TФР-β приводит к резкому снижению уровней ИФН и ИФН-зависимого пути элиминации патогена. Как известно, высокие дозы ИФН-γ полностью ингибируют рост C. trachomatis, а низкие, наоборот, индуцируют развитие морфологических аберрантных включений. Функциями ИФН-γ при инфицировании C. trachomatis являются, во-первых, усиление экспрессии антигенов клеточных мембран, включая антигены главного комплекса гистосовместимости I и II классов. Эти эффекты приводят к активации не только макрофагов, но и фибробластов эпителиальных клеток, что ведет к возрастанию адгезивной способности мембран клеток; во-вторых, происходит стимуляция выработки ИЛ-1B и -2; в-третьих, усиливается активация и стимуляция выработки иммуноглобулинов В-лимфоцитами.
В настоящее время препараты на основе ИФН-γ производятся всего в трех странах: США, Германии и России. Отечественный инновационный препарат на основе рекомбинантного человеческого ИФН-γ зарегистрирован под торговым названием «Ингарон». Главным преимуществом рекомбинантных ИФН в отличие от лейкоцитарных, в которых используется донорская кровь, является высокая безопасность в отношении возможности передачи вирусов человека при их использовании. На данный момент Ингарон является единственным препаратом на основе ИФН-γ в РФ и выпускается в двух лекарственных формах: интраназальной и инъекционной [21].
ИФН-γ успешно применяется в лечении вирусных инфекций (герпесвирусной и ВПЧ-ассоциированных заболеваниях) как в монотерапии, так и в комбинированном режиме [22–26].
В 2015 г. ИФН-γ включен в Федеральные клинические рекомендации РОДВК по ведению больных аногенитальными бородавками и генитальным герпесом. При рецидивирующем течении этих заболеваний рекомендовано применение ИФН системного действия – ИФН-γ по 500 тыс. МЕ 1 раз в сутки подкожно через день на курс 5 инъекций [10].
Таким образом, с точки зрения доказательной медицины имеется возможность назначения ИФН-γ при различных вирусных заболеваниях, включая папилломавирусную и герпесвирусную инфекции.
Важно помнить, что при назначении иммуномодуляторов в клинической практике должны соблюдаться следующие общие принципы:
- Иммуномодуляторы назначают в комплексной терапии одновременно с антибиотиками, противогрибковыми или противовирусными средствами.
- Иммуномодуляторы как монотерапия в остром периоде заболевания не применяются!
- При наличии вторичной иммунологической недостаточности основанием для назначения иммуномодулятора является клиническая картина.
- Применение иммуномодуляторов целесообразно проводить под контролем оценки иммунного статуса.
- Иммуномодуляторы применяются в виде монотерапии при проведении иммунореабилитационных мероприятий.
- Изменение какого-либо параметра иммунитета у практически здорового человека не является основанием к назначению иммуномодулирующей терапии.
Заключение
Лекарственный препарат, назначенный в качестве этиотропной или иммуномодулирующей терапии ИППП, должен соответствовать следующим требованиям:
- Клиническая эффективность и безопасность препарата должны быть доказаны контролируемыми клиническими исследованиями, желательно многоцентровыми (включая как проведенные на территории отдельной страны, так и межпопуляционные), результаты которых должны быть опубликованы в рецензируемых источниках, доступных в Интернете.
- Иметь четкие показания к применению, включая дозировку, кратность и длительность приема, с учетом побочных эффектов и взаимодействия с различными группами медикаментов.
- Протоколы лечения должны быть одобрены профессиональными сообществами (консенсусы, заключения рабочих групп экспертов, протоколы) и на основе этих документов далее – официальными органами здравоохранения, исходя из объективной и научно-обоснованной оценки их эффективности.



