Цефиксим является полусинтетическим цефалоспорином III поколения для перорального применения. Препарат был разработан в конце 1980-х гг. японской фармацевтической компанией Fujisawa, которая после слияния с компанией Yamanouchi была преобразована в Астеллас Фарма.
Цефиксим обладает высокой активностью в отношении грамотрицательных бактерий, таких как Haemophilus influenzae, Moraxella catarrhalis, представителей семейства Enterobacteriaceae (включая Escherichia coli, Klebsiella spp. и Proteus spp.), Neisseria gonorrhoeae [1]. Следует отметить, что в отношении грамотрицательной флоры активность цефиксима несколько выше, чем в отношении грамположительных микроорганизмов. Тем не менее препарат проявляет высокую активность в отношении β-гемолитических стрептококков группы А и В и пневмококков, чувствительных к пенициллину [2]. Цефиксим применяется для лечения широкого круга заболеваний, включающих инфекции верхних и нижних дыхательных путей, инфекции мочевых путей; неосложненную гонорею.
Следует отметить, что на фармацевтическом рынке России доля генериков является очень высокой и составляет от 78 до 95% [3]. При этом данные ряда исследований, проведенных в последнее время в России и за рубежом, ставят под сомнение качество воспроизведенных препаратов (генериков), зарегистрированных в Российской Федерации [4, 5].
Представляют интерес результаты исследования П.А. Ламберт и соавт. (2004), в котором изучалась фармацевтическая эквивалентность оригинального (референтного) цефтриаксона (Роцефин®) и 34 генериков [4]. Были выявлены существенные различия между оригинальным препаратом и генериками. Так, в 18 случаях были выявлены нарушения Европейской и Американской фармакопеи. Наиболее частыми отклонениями были нарушение прозрачности раствора и наличие примесей тиотриазина (продукт разрушения цефтриаксона), при этом 4 генерических препарата не были стерильными [4].
Значимые различия в эффективности оригинальных антибиотиков и генериков при лечении тяжелой внебольничной пневмонии были выявлены в ретроспективном исследовании Н.Ю. Векслера (2012) [6]. Пациенты первой группы получали оригинальные препараты (комбинацию оригинального препарата цефтриаксона с кларитромицином) или левофлоксацин в рекомендованных дозах. Больные второй группы – генерик цефтриаксона плюс кларитромицин либо воспроизведенный левофлоксацин в тех же дозировках. Оказалось, что у пациентов, получавших оригинальные препараты, длительность пребывания в отделении реанимации и интенсивной терапии (ОРИТ) составляла в среднем 6,4±0,2 дня, при этом пациенты, получавшие воспроизведенные препараты, находились в ОРИТ значительно дольше – 20,16±0,8 суток (p≤0,01). Следует также отметить, что среди пациентов, получавших генерики, летальность была выше и составляла 27,5%, у тех же, кто получал оригинальные препараты, величина данного показателя составляла 18,5%. Таким образом, несмотря на ограничения данного исследования, оно продемонстрировало недостаточную эффективность генериков по сравнению с оригинальными препаратами у госпитализированных пациентов с тяжелой внебольничной пневмонией. Наряду с этим, по мнению автора работы, массовое использование воспроизведенных препаратов будет способствовать селекции антибиотикорезистентности возбудителей инфекций [6].
В связи с вышеперечисленными данными особую актуальность приобретают исследования, целью которых является изучение различных генериков лекарственных средств, присутствующих на фармацевтическом рынке Российской Федерации.
Одним из методов оценки качества твердых лекарственных форм препаратов является сравнительный тест кинетики растворения, который позволяет оценивать скорость и степень высвобождения in vitro активного компонента и является одним из важнейших критериев оценки качества. Фактически его использование при анализе лекарственного препарата и есть испытание, которое наряду с оценкой фармацевтической эквивалентности позволяло бы проводить предварительную оценку биоэквивалентности воспроизведенного лекарственного средства [7].

Целью работы было проведение теста сравнительной кинетики растворения двух препаратов – цефиксима Супракс Солютаб® (таблетки диспергируемые 400 мг, «Астеллас Фарма Юроп Б.В.», Нидерланды) и препарата Панцеф® (таблетки, покрытые пленочной оболочкой, 400 мг, «АЛКАЛОИД АО» Республика Македония).
Материал и методы
Все исследования были выполнены в испытательной лаборатории ООО «Национальное агентство клинической фармакологии и фармации». Исследование кинетики растворения вышеперечисленных лекарственных препаратов цефиксима проводили при различных значениях рН среды: 1,2 (имитирует кислотность в желудке натощак); 4,5 (имитирует значение pH в верхнем отделе тонкой кишки); 6,8 (имитирует pH в среднем отделе тонкой кишки) и 7,2 (требования нормативной документации). Растворение таблеток осуществлено в соответствии с основной методикой и требованиями Государственной фармакопеи XI (выпуск 2, с. 158) на лопастной мешалке со скоростью вращения 100 оборотов в минуту при температуре 37±0,5°С, объем среды растворения составил 900 мл. Определение проводили в соответствии с Общей фармакопейной статьей 42-0003-00 на тестере растворения фирмы «Varian» модели VK 7025.
Образцы объемом по 10 мл отбирали через заданные промежутки времени: 5, 10, 15, 30, 45 и 60 минут. Определение количества растворившегося цефиксима проводили спектрофотометрическим методом на УВИ-спектрофотометре модели Cary 100 фирмы «Varian».
Для количественной оценки эквивалентности кинетики растворения лекарственных препаратов Супракс Солютаб® и Панцеф® использовали Руководство по экспертизе лекарственных средств (том III, 2014) [8]. В соответствии с этими указаниями если высвобождение вещества происходит в течение 15 минут, то вещества эквивалентны. Количественно эквивалентность кинетики растворения лекарственного средства оценивают из фактора сходимости v (для веществ со временем высвобождения более 15 минут). Кинетика растворения считается эквивалентной, если значение параметра f2 лежит в пределах от 50 до 100.
Результаты исследования
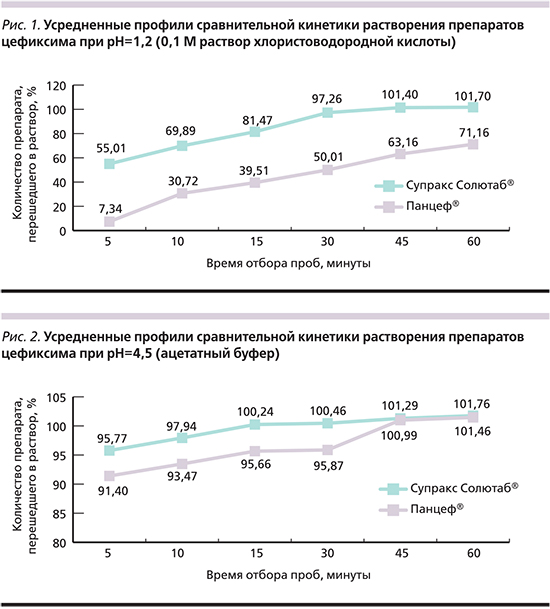
На основании полученных данных были построены графики кинетики растворения препаратов Супракс Солютаб® и Панцеф® (рис. 1–4).
Следует отметить значительную вариабельность кинетики растворения препарата Панцеф®, зависящую от кислотности среды высвобождения. Так, при рН среды, равном 1,2, уже в течение первых 15 минут более 80% цефиксима из препарата Супракс Солютаб® переходит в раствор, в то же время количество действующего вещества, перешедшего в раствор из препарата Панцеф®, оказалось в 2 раза меньше и не превышало 40% (рис. 1). Через 1 час 101,7% активного вещества из препарата Супракс Солютаб® перешло в раствор, при этом величина данного показателя у генерика составила 71,16%. Таким образом, более 28% действующего вещества препарата Панцеф® не перешло в раствор, что в условиях in vivo может сопровождаться снижением биодоступности препарата и приводить к созданию субтерапевтических концентраций в очаге инфекции.

Было установлено, что при рН=4,5 кинетика растворения обоих изученных препаратов была сопоставимой. Так, в течение первых 15 минут теста более 95% цефиксима из препарата Панцеф® перешло в раствор, при этом доля препарата, перешедшего в раствор из препарата Супракс Солютаб®, составила 100,46%. Следует отметить, что через 1 час более 100% цефиксима из обоих изучаемых препаратов перешли в раствор (рис. 2).
Проведение теста растворения при значениях рН=6,8 и 7,2 продемонстрировало значительные различия между препаратами Супракс Солютаб® и Панцеф®. Через 1 час после начала теста при заданных значениях рН количество цефиксима, перешедшего в раствор, у препарата Супракс Солютаб® превышало аналогичные показатели у Панцеф® на 20% (рис. 3–4).
На основании полученных результатов также был рассчитан фактор сходимости (см. таблицу).
Из значений фактора подобия, приведенных в таблице, следует, что кинетика растворения исследуемого препарата Супракс Солютаб® (таблетки диспергируемые 400 мг, «Астеллас Фарма Юроп Б.В.», Нидерланды) в трех средах (фосфатного буфера при pH=7,2 – среда НД, средах 0,1 М хлористоводородной кислоты – рН=1,2, фосфатного буфера – pH=6,8) не эквивалентна кинетике растворения препарата сравнения Панцеф® – таблетки, покрытые пленочной оболочкой, 400 мг («АЛКАЛОИД АО», Республика Македония). При этом следует обратить внимание на то, что количество растворенного цефиксима через 1 час при исследовании кинетики растворения препарата Панцеф® было на 20–30% меньше, чем при изучении препарата Супракс Солютаб®. Несоответствие кинетики растворения может быть «прогностическим признаком» недостаточной биодоступности генерика и как следствие – недостаточной клинической эффективности препарата.
Обсуждение результатов
Результаты нашего исследования показали значительные различия кинетики растворения между протестированными препаратами диспергируемыми таблетками Супракс Солютаб® и препаратом сравнения – таблетками, покрытыми оболочкой, Панцеф®. Было установлено, что препараты Супракс Солютаб® и Панцеф® не эквивалентны по кинетике растворения в трех средах. Наряду с этим высвобождение активного компонента цефиксима в препарате Супракс Солютаб® до 80% за 15 минут происходит во всех исследуемых средах (среда НД, среда 0,1 М хлористоводородной кислоты рН=1,2, фосфатного буфера pH=6,8, ацетатный буфер рН=4,5), в то же время высвобождение 80% действующего вещества за 15 минут у препарата Панцеф® происходит лишь при рН среды, равном 4,5. Таким образом, было установлено, что препарат Супракс Солютаб® обладает более стабильной по сравнению с генериком Панцеф® кинетикой растворения с меньшей зависимостью от кислотности среды.
Выявленные in vitro различия между тестируемыми препаратами имеют большое значение в клинике. В настоящее время доказано, что высокую эффективность антимикробной терапии при использовании β-лактамов можно ожидать в ситуации, когда концентрация антибиотика в очаге инфекции превышает величину его минимальной подавляющей концентрации (МПК) в отношении возбудителя в течение 40–50% времени от интервала между введениями препарата (T>МПК) [9]. Учитывая выявленную зависимость кинетики растворения препарата Панцеф® от рН среды можно предположить, что in vivo возможна ситуация, в которой до 30% активного вещества не перей-дет в раствор и, соответственно, не поступит в системный кровоток. Все это будет сопровождаться уменьшением концентрации антибиотика в очаге инфекции, что в конечном итоге может приводить к неэффективности антимикробной терапии и селекции резистентных штаммов микроорганизмов [10].
Таким образом, полученные нами данные свидетельствуют о том, что кинетика растворения препарата Панцеф® не эквивалентна таковой препарата Супракс Солютаб® при значениях рН среды 1,2; 6,8 и 7,2. В связи с этим использование генерика в определенных ситуациях может сопровождаться увеличением риска клинических неудач и ростом антибиотикорезистентности.



