Остеопороз – «болезнь цивилизации»
В Российской Федерации 14 млн человек (10% населения страны) страдают остеопорозом (ОП), еще 20 млн имеют остеопению. С возрастом увеличивается и количество осложнений ОП – переломов при незначительной травме. В среднем после 50 лет происходит один остеопоротический перелом у одной из трех женщин и одного из восьми мужчин [1].
В норме структура кости постоянно ремоделируется путем координирования взаимодействий между остеокластами (клетки, занимающиеся в основном резорбцией костной ткани) и остеобластами (клетки, обеспечивающие формирование костной ткани и минерализацию). Дисбаланс их функционирования, по сути, и является ОП, когда процессы резорбции кости преобладают, ухудшается ее микроархитектоника и уменьшается плотность [2]. Это увеличивает риск переломов, в частности бедра и позвоночника, которые причиняют пациентам боль и страдания, приводя к инвалидности и даже смерти [3].
Известно благоприятное воздействие кальция и витамина D на массу костной ткани в любом возрасте. Они поддерживают минеральную плотность кости и являются основными компонентами в большинстве превентивных стратегий. Однако ОП – многофакторное заболевание и для здоровья костей необходимо участие других микроэлементов и биологически активных веществ. На формирование костной ткани также влияют фтор и стронций, но при их избыточном количестве эффект становится обратным – прочность кости уменьшается. Магний поддерживает прочность, сохранность и ремоделирование костей. Бор особенно эффективен в случае дефицита витамина D, магния и калия. Витамин К необходим для активации остеокальцина. Витамин С является важным стимулом для остеобластов [4]. Адекватное потребление фитоэстрогенов, флавоноидов, витаминов А, В, С, Е, К, фолиевой кислоты, минеральных веществ, таких как калий, медь, цинк, селен, железо фтор, бор, магний, может приводить к значительному сокращению или даже предотвращению потери костной массы, особенно у женщин в постменопаузе и у лиц пожилого возраста [4].
Влияние магния на структуру и плотность кости
Исследования роли магния (Mg) в гомеостазе кости ведутся более 70 лет [5]. Около 60% от общего содержания Mg в организме находится в костях – это главное депо Mg в организме. Поэтому при дефиците микроэлемента его переход из кости в кровь приводит к уменьшению количества и толщины трабекул, а также нарушению процессов образования и усилению резорбции. В итоге уменьшаются объем губчатой кости, выдерживаемая максимальная нагрузка и модуль упругости [6].
Установлено также, что:
- Mg определяет активность Н+/К+-АТФазы в клетках надкостницы, в эндосте и рН внеклеточной костной жидкости, которая при дефиците Mg снижается (ацидоз), что приводит к деминерализации [7];
- образование 1,25-гигидроксивитамина D происходит под контролем магнийзависимой гидроксилазы. При дефиците Mg концентрация 1,25-дигидроксивитамина D в сыворотке значительно снижена [7];
- Mg изменяет активность фермента синтетазы оксида азота (iNOS) и участвует в выведении захваченного клеткой оксида азота (NO), тем самым снижая уровень внутриклеточного NO и повышая активность остеобластов, что предотвращает ОП (но только в условиях нормального уровня Mg) [8].
Дефицит Mg и ОП
К настоящему времени установлено несколько прямых и косвенных механизмов негативного воздействия низкого уровня Mg на плотность костной ткани, развитие и поддержание ОП (см. рисунок):
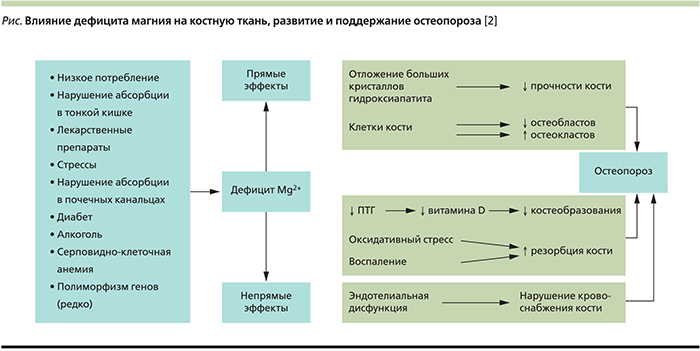
- изменяется кристаллическая структура кости, снижается функция остеобластов, повышается число и активность остеокластов, что приводит к повышенной хрупкости костей [9]. Низкий уровень внеклеточного Mg ингибирует рост остеобластов путем увеличения высвобождения NO через повышенную регуляцию индуцируемой iNOS [8], в то же время увеличивается число остеокластов, генерируемых костным мозгом [10];
- нарушается гомеостаз паратиреоидного гормона (ПТГ) и 1,25 (OH)2-витамина D, что приводит к гипокальциемии. С одной стороны, при дефиците Mg нарушается секреция ПТГ, который влияет на органы-мишени через увеличение цАМФ и активацию аденилатциклазы. При этом Mg выступает в качестве кофактора. Формируется резистентность клеток ПТГ [11]. Снижение секреции ПТГ или нарушение периферического клеточного ответа на гормон приводит к низкой концентрации в сыворотке 1,25 (OH)2-витамина D [12]. С другой стороны, Mg необходим для активности 1,25-гидроксихолекальциферола-1-гидроксилазы и, следовательно, дефицит микроэлемента снижает активность данного фермента, что влечет снижение уровня 1,25 (OH)2-витамина D [12–13]. При дотации Mg у постменопаузальных женщин с недостатком витамина D, низким уровнем ПТГ и дефицитом Mg биохимические показатели приходят в норму. Дотация Mg у детей, больных сахарным диабетом, способствует нормализации уровня 1,25 (OH)2-витамина D [2];
- усиливается выработка воспалительных цитокинов (фактора некроза опухоли, интерлейкина-1 – ИЛ-1 и ИЛ-6 – как в сыворотке крови, так и в микроокружении кости), что повышает активность остеокластов, ингибирует функцию остеобластов, тем самым стимулируется ремоделирование кости и остеопения [14–15];
- усиленно высвобождается субстанция Р, что в дополнение к повышению секреции цитокинов еще больше стимулирует активность остеокластов. Это важно еще и потому, что снижение Mg способствует оксидативному стрессу – частично как вследствие воспаления, частично из-за угнетения защитных антиоксидантных механизмов. Увеличение количества свободных радикалов потенцирует активность остеокластов и тем самым подавляет остеобласты [16];
- развивается эндотелиальная дисфункция, которая приводит к нарушению адекватного кровоснабжения кости, таким образом способствуя снижению костной массы [17–18];
- усиливается метаболический ацидоз вследствие неправильного питания (западная «цивилизованная» диета), который еще усугубляется и при старении. Метаболический ацидоз приводит к потере кальция из кости, ингибирует функцию остеобластов и стимулирует активность остеокластов, ухудшает минерализацию костей.
Причины дефицита Mg
Человек получает магний исключительно с пищей. Поэтому наиболее распространен его алиментарный дефицит. Мониторинг питания показал, что в современном «образе питания» жителей Европы и США преобладают рафинированная и соленая пища, полуфабрикаты, трансгенные жиры, фосфорная кислота (сода), кофе, что не обеспечивает организм должным количеством Mg. Доля потребления кальция и натрия растет, Mg резко снижается. Самые низкие уровни заболеваемости ОП фиксируются в культурах, где соотношение потребления кальция и Mg составляет 1:1 либо 2:3. В странах с высоким уровнем развития ОП соотношение потребляемого с пищей и пищевыми добавками общего кальция и Mg в лучшем случае составляет 2:1, а обычно более 3:1. Для сравнения: соотношение в Южной Африке – 2 частей кальция к 3 частям Mg, при минимальном рейтинговом уровне ОП – 7, в США это соотношение составляет 4:1 и отражает высокий рейтинг ОП – 144, в Швейцарии – 5,5:1,0 и высочайший рейтинг ОП – 188 [19].
Высокий уровень потребления Mg ассоциируется с более высокой плотностью костной ткани у пожилых мужчин и женщин, в то же время различные виды диетического ограничения Mg способствуют развитию ОП [12]. При Mg-дефицитной диете заметно уменьшается толщина кортикального слоя кости, появляются микротрещины трабекул [10].
В среднем женщины западных стран потребляют только 68% Mg от суточной нормы, что свидетельствует о существенном диетическом дефиците у большей части населения [12].
В России также имеет место недостаточное среднесуточное потребление микроэлементов (кальция потребляется всего 22–31,1% от нормы, Mg – 57,4–117,5%), что приводит к их дисбалансу между собой, а также с фосфором [20].
Дефицит Mg очень часто встречается у пожилых людей и лиц, злоупотребляющих алкоголем [21–22].
Тем не менее диета не единственный определяющий фактор. Дефицит Mg имеет место при обильном потоотделении, длительном стрессе, чрезмерной менструации и вагинальном кровотечении, при некоторых инвазиях паразитов (острицы) [23–24]. Дефицит микроэлемента усугубляется при сахарном диабете, серповидно-клеточной анемии, терапии некоторыми классами диуретиков, антибиотиками, противоопухолевыми препаратами [25–26]. Поскольку гомеостаз Mg регулируется с помощью сложной сети транспортеров в кишечнике и почках, не удивительно, что дефицит Mg связан с хроническими заболеваниями желудочно-кишечного тракта и почек [27].
За последнее десятилетие редкие случаи гипомагниемии были выявлены при наследственных генных мутациях: установлен полиморфизм генов, связанный с низким уровнем сывороточного Mg (TRPM6, TRPM7) [27–28].
Другие физиологические влияния Mg на организм
Данные более 80 тыс. клинических, биохимических, клеточно-молекулярных исследований, опубликованные за последние 30 лет, показывают, что внутриклеточный Mg помимо структурной роли в костях обеспечивает нормальную жизнедеятельность организма, а поддержание физиологического уровня Mg в тканях организма – фундаментальный параметр здоровья человека [29].
И прежде всего Mg – основополагающий элемент синтеза АТФ (основного источника энергии в клетках) и кофактор нескольких сотен ферментов, участвующих в обмене липидов, белков, нейромедиаторных молекул и синтеза нуклеиновых кислот.
Ион Mg – природный антагонист иона кальция: стабилизирует клеточные мембраны, регулирует проницаемость клеточных мембран и сосудистый тонус, повышает чувствительность клеток к инсулину, стабилизирует NMDA-рецепторы, участвует в синтезе коллагена [9]. Mg, изменяя активность фермента iNOS, регулирует уровень внутриклеточного NO и снижает синтез пероксинитрита, что защищает клетки от повреждающего действия последних [8, 30].
Клеточный дефицит Mg вызывает патологические процессы, приводящие к функциональным и структурным повреждениям, лежащим в основе патогенеза различных заболеваний. По данным эпидемиологических исследований, низкое потребление Mg приводит к нарушению отношения Ca2+/Mg2+, что определяет высокий риск развития сахарного диабета 2 типа, метаболического синдрома, атеросклероза, ишемической болезни сердца, цереброваскулярных заболеваний, повышения уровня С-реактивного белка, артериальной гипертензии, стресс-связанных, тревожных и депрессивных расстройств, болезни Альцгеймера и других когнитивных нарушений, рассеянного склероза, внезапной сердечной смерти, мигрени, предменструального синдрома, бронхиальной астмы, рака толстой кишки, а также ОП [24, 31–32].
Особое значение приобретает дефицит Mg с позиции нарушений синтеза РНК и ДНК, концевые участки которых (теломеры) необходимы как для поддержания целостности генома, так и для сдерживания клеточного старения [33]. Активность фермента теломеразы (добавляющей фрагменты ДНК) Mg-зависима. В условиях дефицита Mg репликация, транскрипция и трансляция ДНК становятся ошибочными, что приводит к укорочению теломер, нарушению синтеза белка и функции митохондрий, как следствие – старению и смерти клетки [34].
Таким образом, присутствие достаточного количества Mg в организме является критическим фактором для нормального клеточного гомеостаза и определяет связь дефицита Mg, возраста, старения и риска развития соматических заболеваний, в т.ч. и ОП.
Диагностика дефицита Mg
Дефицит Mg легко обнаружить по биохимическим показателям, например низкое содержание Mg в сыворотке крови (0,8–1,26 ммоль/л) или эритроцитах (1,65–2,65 ммоль/л). Сохраняющиеся с 1930-х гг. в некоторых странах, в т.ч. и в России, нижние границы нормы Mg в плазме крови (0,7 ммоль/л и тем более 0,65 ммоль/л) безнадежно устарели. На основе анализа результатов ряда крупномасштабных скринингов уровней Mg, проведенных в различных странах Европы, рекомендовано значение 0,85 ммоль/л принять как нижнюю границу нормы содержания Mg в плазме. Близкие этим данные были получены в ходе российского крупномасштабного скринингового исследования. Оказалось, что более низкие, чем 0,81–0,82 ммоль/л, значения содержания Mg в плазме крови соответствуют повышению риска многочисленных хронических заболеваний, в т.ч. ОП [5, 29].
Также дефицит Mg можно выявить по содержанию в волосах (соотношение кальций/магний волос является важным показателем плотности костной массы [35–36]) и по клиническим симптомам, хотя они и неспецифичны (например, подергивание мышц, мышечные судороги, повышенное артериальное давление, нерегулярное сердцебиение) [2].
Устранение дефицита Mg – успех профилактики и лечения ОП
Эпидемиологически установлена положительная корреляция между потреблением человеком Mg и минеральной плотности его костной ткани. На животных моделях показано, что при пищевой дотации Mg улучшается остеогенез, уменьшается резорбция кости, повышается ее прочность у особей с удаленными яичниками [37].
Алиментарный дефицит Mg приводит к ОП [12], и, наоборот, содержание Mg в трабекулярной кости, а также в эритроцитах и сыворотке крови значительно ниже у пациентов с ОП. Пищевая дотация Mg увеличивает плотность костной ткани, тем самым предотвращает потерю костной массы у 80% лиц с ОП [7].
Поскольку Mg человек получает исключительно с пищей, его адекватное потребление важно для активности костных клеток и способствует профилактике ОП [8]. Но к сожалению, большинство пожилых людей не получают рекомендаций по потреблению Mg в должных дозах. В то же время женщинам в постменопаузе рекомендуют потреблять не менее 1000 мг кальция в сутки, что отражает пищевое соотношение кальций/магний как 4:1, хотя необходимо поддерживать соотношение 2:1. Преобладание в пище кальция над Mg способствует нарушению абсорбции последнего в желудочно-кишечном тракте [7].
Дотация Mg необходима пожилым людям с неправильным рационом питания, лицам с кишечными заболеваниями (например, синдромом мальабсорбции) злоупотребляющим алкоголем, или лицам, находящимся на лечении диуретиками или химиотерапии, которая истощает запасы Mg. Кроме того, препараты кальция иногда приводят к запорам, поэтому дотация Mg будет оказывать положительное влияние на регулярное опорожнение кишечника [6, 38].
С учетом факта низкого поступления Mg с пищей у современных людей очень важно обеспечить их оптимальным количеством микроэлемента. Рекомендуемое в России минимальное потребление Mg с пищей для здоровых взрослых мужчин составляет 420 мг/сут, для женщин – 320 мг/сут. Mg присутствует в большинстве пищевых продуктов, особенно им богаты бобовые, овощи, орехи (особенно нового урожая, обладающие максимальной концентрацией и активностью Mg), семечки, фрукты, злаки, рыба и молочные продукты. Отличным источником Mg является хлорофилл, содержащийся во всех свежих зеленых овощах, фруктах и зелени. При заготовке продуктов для хранения (сушка, вяление, консервирование и т.д.) концентрация Mg снижается незначительно, но его биодоступность резко падает.
Следует уделять большое внимание составу потребляемой воды. Применяемые методы очистки питьевой воды во многих городах России неблагоприятно влияют на баланс эссенциальных микроэлементов. В то же время в природе существуют богатые Mg минеральные воды: Баталинская; воды Донат; Пятигорск, Лысогорская скважина; воды курорта Кука, скважина № 27; крымский и кисловодские нарзаны [36].
Для профилактики, а также терапии для длительного применения при ОП рекомендован цитрат Mg с его хорошей биодоступностью, высокой растворимостью и слабощелочной реакцией. Цитрат Mg нормализует метаболизм кости, восстанавливает активность ПТГ и витамина D, улучшает микроархитектонику кости и повышает минеральную плотность костной ткани [39], а также способствует нормализации баланса водной и минеральной фракции мочи, уменьшению в ней кристаллообразования, нормализует кислотно-щелочное равновесие, тем самым предотвращая камнеообразование в почках, желчевыводящих протоках, слюнных железах и т.д. В отличие от неорганических солей цитрат Mg не вызывает поражения слизистой оболочки желудочно-кишечного тракта и характеризуется гораздо лучшей переносимостью. Использование именно цитрата Mg также приводит к лучшему усвоению Mg при пониженной кислотности желудка по сравнению с лактатом и другими органическими формами Mg [5]. Биодоступность цитрата Mg значительно увеличивается в комплексе с пиридоксином (витамин В6) и составляет 40–50%. Пиридоксин является основным природным магнезиофиксатором в организме человека – приводит к повышению Mg2+ в плазме и эритроцитах и сокращает магнезиурию [36].
Заключение
Эффективная профилактика и лечение ОП – сложный процесс, для реализации которого требуется многоплановый подход, в котором Mg играет важную роль. Увеличение потребления Mg с пищей, что возможно лишь в условиях здорового питания с большим содержанием фруктов и овощей [38, 41], и включение препаратов Mg в комплексное лечение ОП позволят повысить эффективность и приверженность пациента терапии.
На гомеостаз Mg влияет очень много факторов, недостаточно просто назначать магнийсодержащие лекарственные препараты. Необходимо увеличить поступление Mg с пищей, поскольку игнорирование данного факта приводит к разочарованию от недостаточной эффективности лекарственной терапии [23]. Результаты проспективного исследования 73 684 женщин в постменопаузе, опубликованные в 2014 г., показали, что физическая активность и базовая минеральная плотность кости выше у женщин, которые потребляли более 422,5 мг Mg в сутки по сравнению с теми, кто потреблял менее 206,5 мг/сут [42].
И несмотря на доказательства того, что Mg увеличивает прочность скелета, результаты The Women’s Health Initiative Study, опубликованные в 2009 г., показали, что женщины в постменопаузе с высоким уровнем потребления Mg имеют самый высокий уровень переломов запястья. Была попытка объяснить эти результаты с помощью исследований in vitro: с учетом антагонизма с кальцием высокий уровень Mg в костях нарушает баланс кальций/магний, что, возможно, приводит к изменению структуры кости и функции костных клеток, так же как и костная дистрофия при хронической почечной недостаточности и при длительной вынужденной адинамии (концентрация Mg в сыворотке у этих пациентов часто увеличена и коррелирует с деминерализацией костей) [43]. Однако более детальное изучение результатов данного исследования, а также последующие клинические исследования показали, что высокие уровни потребления Mg хоть и связаны с повышенным риском перелома запястья, но только по той причине, что эти люди ведут более активный образ жизни с высокой вероятностью падений на руки [44].
До начала терапии ОП и через 3 месяца рекомендуется исследование в динамике маркеров костной резорбции (например, продукты деградации коллагена I типа – N-телопептид – NTX в моче или С-телопептид – CTX в сыворотке крови). Снижение их уровня на 30% свидетельствует об эффективности проводимого лечения.
С целью мониторирования эффективности лечения ОП рекомендуется проведение оценки минеральной плотности костной ткани с интервалом 1–2 года. При этом прирост минеральной плотности или даже отсутствие отрицательной динамики трактуется, так же как эффективное лечение.



