Миома матки является доброкачественной опухолью и встречается не менее чем у 20–25% женщин [1]. По данным патологоанатомических исследований, истинная частота миомы гораздо выше и может достигать 70–80% [2]. За последние годы отмечается рост числа больных данной патологией среди молодых женщин [3, 4]. В зависимости от размеров и локализации узлов миома может вызывать различные клинические проявления, включая дисменорею, аномальные маточные кровотечения, железодефицитную анемию, бесплодие, тазовую боль или симптомы сдавления смежных органов [5, 6].
Мнение исследователей о влиянии миомы на фертильность неоднозначно. Однако большинство из них все же считают, что у таких пациенток вероятность бесплодия выше. Среди женщин, страдающих миомой, частота бесплодия колеблется в пределах 18–25%, в т.ч. первичного – 24,4%, и вторичного – 18,1% [7, 8]. Известно, что удаление миоматозных узлов у женщин, не имеющих других причин бесплодия, приводит к наступлению беременности у каждой второй пациентки [9]. Однако механизмы, способствующие увеличению частоты наступления беременности, недостаточно изучены. При наличии обширных клинических наблюдений специалисты имеют довольно ограниченное представление о клеточно-молекулярных изменениях в мио- и эндометрии до и после проведенного хирургического лечения.
В нашей работе мы оценили влияние миомэктомии на рецепторные свойства эндометрия у пациенток, страдающих первичным и вторичным бесплодием. Маркерами рецептивности были выбраны рецепторы к прогестерону (рПР) и эстрогенам (рЭР), лейкемия-ингибирующий фактор (ЛИФ), гены НОХА-10 и bcl-2, количество пиноподий в эндометрии. В исследование вошли пациентки в возрасте 25–40 лет с множественной миомой матки, общим увеличением 250–400 см3, которым планировалось выполнение миомэктомии. В исследование не включены пациентки, получавшие гормональную терапию в течение 6 месяцев до исследования; с наличием гиперпластических процессов эндометрия; предраковых поражений шейки матки, онкологических заболеваний любой локализации в настоящее время или в анамнезе. Не вошли в исследование и женщины, ранее перенесшие эмболизацию маточных артерий или аблацию фокусированным ультразвуком; эндокринные заболевания в стадии декомпенсации; воспалительные заболевания органов малого таза.
При обследовании пациенток помимо традиционной оценки антропометрических параметров, сбора общего и гинекологического анамнеза и истории заболевания, проведенных трансвагинального и трансабдоминального ультразвуковых исследований органов малого таза, клинического и биохимического исследований крови, исследования свертывающей системы крови проведено иммуногистохимическое исследование аспиратов слизистой оболочки тела матки до и после операции. Оценка маркеров рецептивности эндометрия осуществлена до операции и через 6 месяцев после нее – в период «имплантационного окна». Биопсия эндометрия выполнена под ультразвуковым контролем из области дна матки на 6–8-й день после овуляции с помощью аспирационной кюретки.
В морфологическое исследование рецептивности эндометрия вошло 120 биоптатов эндометрия от 60 пациенток. Образцы тканей фиксировались в 10%-ном нейтральном формалине с фосфатным буфером, обрабатывались в аппарате гистологической проводки тканей и заливались в парафин. Затем готовились серийные парафиновые срезы толщиной 4–5 мкм. Срезы фиксировали на предметные полилизиновые стекла и инкубировали в термостате при 37°С в течение 12 часов. Далее срезы депарафинировали, регидратировали и окрашивали гематоксилином и эозином. Проведен подсчет среднего значения процента зрелых пиноподий в 5 полях зрения при увеличении в 40 раз на поверхностном эпителии эндометрия. Иммуногистохимические реакции осуществлены на депарафинированных срезах толщиной 4–5 мкм, расположенных на стеклах, покрытых полилизиновым слоем. Неокрашенные срезы от каждого случая обрабатывали с помощью стандартного метода иммуногистохимии с термической демаскировкой антигенов. По окончании обработки наносили первичные антитела (антитела к рЭР (клон 1D5, RTU, DAKO, США, 1:35); антитела к рПР (клон 636, RTU, DAKO, США, 1:50); антитела к ЛИФ (polyclonal rabbit Ab, Sigma, 1:1000); антитела к HOXA-10 (polyclonal rabbit Ab, GeneTex, 1:100), антитела к протоонкогену bcl-2 (клон 124, Cell Marque, 1:100).
После завершения инкубации срезы тщательно отмывали в фосфатном буфере (рН – 7,0–7,6) от первичных антител, не связавшихся с эпитопами, затем наносили вторичные антитела, которые после инкубации метились авидин-биотиновым комплексом (АВК KIT, DAKO). Проведена полуколичественная и количественная оценка результатов реакций. Результаты иммуногистохимической реакции оценены полуколичественным методом в баллах по количеству позитивно окрашенных клеток. Оценка интенсивности реакции проведена по 6-балльной системе: 2 балла – до 20% окрашенных клеток; 4 – от 20 до 40% окрашенных клеток; 6 баллов – более 40% окрашенных клеток. Экспрессия рПР и рЭР оценена по системе HISTO SCORE по сумме (% интенсивно окрашенных клеток ×3)+(% умеренно окрашенных клеток ×2)+(% слабо окрашенных клеток ×1).
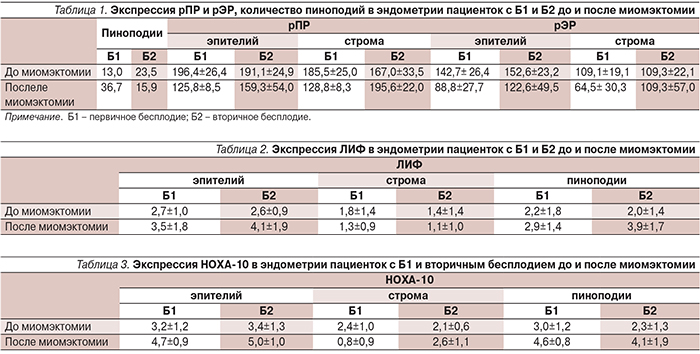
После взятия первичных биоптатов все пациентки были оперированы в объеме лапароскопической миомэктомии с временной окклюзией маточных артерий [10]. По прошествии 6 меся-цев повторно брались образцы эндометрия в соответствующий день менструального цикла. Результаты нашего исследования подробно отражены в табл. 1–4. Их анализ показал, что после миомэктомии изменения в эндометрии значительно отличались у пациенток с первичным и вторичным бесплодием. После миомэктомии число пиноподий у пациенток с первичным бесплодием увеличилось с 13 до 36,7, в то время как у пациенток с вторичным бесплодием отмечалась противоположная динамика и их количество уменьшилось с 23,5 до 15,9.

При оценке экспрессии рецепторов к половым гормонам после миомэктомии среди пациенток с первичным бесплодием имело место снижение количества как рПР, так и рЭР и в стромальных и в эпителиальных клетках. У пациенток, имевших в анамнезе беременности, достоверно снизилась лишь концентрация рПР в эпителиальных клетках, в то время как в стромальных она даже увеличилась с 167,0±33,5 до 195,6±22,0. Количество рЭР в этой группе не претерпели значительных изменений (табл. 1).
Через полгода после миомэктомии среди женщин с первичным и вторичным бесплодием соотношение рПР:рЭР увеличилось с 1,8 до 4,6 и с 1,6 до 2,7 соответственно. Таким образом, после миомэктомии преимущественно благоприятные результаты были получены среди пациенток с первичным бесплодием, т.к. именно у них увеличилось и число пиноподий и индекс PGR/ER. При вторичном бесплодие результаты были разнонаправленными, т.к. на фоне роста индекса PGR/ER, число пиноподий уменьшилось.
Колебания концентрации ЛИФ не выявили значительных различий между пациентками групп Б1 и Б2. Наиболее значимое повышение экспрессии данного фактора произошло в пиноподиях пациенток с вторичным бесплодием (табл. 2).
Экспрессия НОХА-10 стала более выраженной после операции стала более выраженной в эпителии и пиноподиях пациенток обеих групп. Однако положительной ответ со стороны стромальных клеток был получен только в группе Б2 (табл. 3). Экспрессия bcl-2 после миомэктомии снизилась у пациенток всех групп и в строме, и в эпителии, но ярче это было выражено у таковых с первичным бесплодием (табл. 4).
Полученные нами данные позволяют несколько иначе взглянуть на проблему рецептивности эндометрия у пациенток с первичным и вторичным бесплодием в присутствии миомы матки. Ожидаемое улучшение показателей рецептивности после удаления крупных миоматозных узлов, которое подтвердило бы клинические наблюдения, не только не оправдалось, но и продемонстрировало своеобразную мозаичность изменений.
Из приведенных данных следует сделать вывод о том, что наиболее репрезентативным маркером рецептивности эндометрия у пациенток с миомой матки после миомэктомии стал фактор LIF. Интересно, что наибольшее повышение его экспрессии отмечалось в группе пациенток со вторичным бесплодием, тогда как количество пиноподий и соотношение рПР:рЭР после операции было лучше в подгруппе пациенток с первичным бесплодием. Полагаем, что более детальное изучение эндометрия таких женщин позволит выявить новые механизмы, мешающие успешной имплантации эмбрионов и снизить частоту репродуктивных потерь.


