Введение
Согласно рекомендациям Евро-пейской ассоциации урологов 2015 г. [1], оптимальным кандидатом для проведения сальважной радикальной простатэктомии (РПЭ) является пациент без тяжелых сопутствующих заболеваний с ожидаемой продолжительностью жизни не менее 10 лет, локализованным раком предстательной железы (РПЖ) с клинической стадией≤T2, суммой баллов по Глисону≤7 и дооперационным уровнем ПСА≤10 нг/мл. В отношении пациентов, имеющих противопоказания к проведению сальважной РПЭ, могут быть применены альтернативные методы сальважного лечения – дистанционная лучевая терапия, криоаблация и брахитерапия. Сальважная HIFU-терапия также может быть рекомендована как альтернативный метод лечения, однако период наблюдения после HIFU-терапии непродолжителен.
Клинический случай
В клинике урологии МГМСУ впервые проведена сальважная робот-ассистированная РПЭ простатэктомия (РАРПЭ) двум пациентам, перенесшим первичную фокальную криоаблацию (ФКА) простаты по поводу РПЖ (табл. 1).

В обоих случаях до первичного лечения была установлена клиническая стадия Т1с. После оперативного лечения отмечен постепенный рост ПСА, составивший 3,36 нг/мл и 5,3 нг/мл соответственно. По результатам контрольной биопсии ПЖ, выполненной спустя год после перенесенной ФКА простаты, в обоих случаях диагностирован рост аденокарциномы в непролеченных долях; степень дифференцировки по системе градации Глисона составила 7 (3+4) и 6 (3+3) баллов, опухоль занимала 30 и 10% ткани биоптатов соответственно. В долях ПЖ, подвергшихся ФКА при патогистологическом исследовании, определены фиброз и склероз ткани простаты.
По данным УЗИ органов мочевыделительной системы, объем простаты составил 30 и 47 см3, максимальная скорость мочеиспускания – 14 и 18 мл/с соответственно. Cумма баллов по шкале IPSS – 5 и 7, по шкале IIEF – 10 и 18 баллов соответственно. С пациентами проведена беседа относительно характера имеющегося заболевания и существующих методов лечения; после проведенной беседы принято решение выполнить сальважную РАРПЭ.
Анализ ультразвуковой картины, полученной при гистосканировании [2], показал, что у обоих пациентов контуры ПЖ были нечеткие, неровные; участки замещения ткани простаты фиброзной и соединительной тканью были представлены гиперэхогенными включениями (рис. 1). Объем суспициозных участков составил 5,7 и 4,3 см3 соответственно. Данные магнитно-резонансной томографии представлены на рис. 2.
По номограмме Партина риск поражения лимфатических узлов и семенных пузырьков не превышал 7%. По шкале D'Amico пациенты отнесены к группам среднего и низкого риска соответственно. СAPRA Score у обоих пациентов составил 2 балла.
Интраоперационно выделение ПЖ сопровождалось выраженными техническими трудностями, обусловленными, по всей видимости, распространением «ледяного» шара в ходе ФКА за границу простаты. Время операции в среднем составило 135 минут. Всем пациентам по завершении операции мочевой пузырь был дренирован по уретре специально разработанным катетером, предусматривающим возможность контролируемого наполнения дополнительного баллона, располагающегося в области сформированного уретрошеечного анастомоза [20]. Интраоперационных осложнений отмечено не было. Макроскопическая картина удаленной ПЖ представлена на рис. 3.
Течение послеоперационного периода было благоприятным в обоих случаях: страховая дренажная трубка удалена на 1-е, уретральный катетер – на 7-е сутки после контрольной цистографии. Восстановлено самостоятельное мочеиспускание; пациенты полностью удерживали мочу. При контрольном УЗИ объем остаточной мочи ни в одном из случаев не превышал 20 мл. За время наблюдения проведен курс инфузионной, антибактериальной, противовоспалительной терапии с положительным эффектом. Уровень общего ПСА сыворотки крови спустя 3 месяца после операции составил 0,004 и 0,05 нг/мл соответственно.
При патогистологическом исследовании у обоих пациентов рост аденокарциномы был определен в непролеченной доле. Степень дифференцировки по системе градации Глисона у обоих составила 7 (4+3) баллов. Экстрапростатическая инвазия и инвазия в семенные пузырьки не определялась. Края резекции отрицательные. Определилась периневральная инвазия. В пролеченной доле имели место выраженные склеротические изменения. Время операции составило 180 минут, периоперационный период – 8 дней.

Обсуждение
В мировой литературе известно сравнительно малое количество работ, посвященных сальважной простатэктомии у пациентов, перенесших криоаблацию простаты. Большинство найденных нами источников оценивает выполнение сальважной простатэктомии после проведенной ранее лучевой терапии. Литературные источники, описывающие опыт выполнения сальважной РАРПЭ после криотерапии и HIFU, представляют собой небольшие ретроспективные исследования с коротким периодом наблюдения [3, 4].
Rodriguez E. и соавт. [5] сообщили о первом опыте выполнения сальважной РАРПЭ с тазовой лимфаденэктомией после криоаблации ПЖ. Периоперационных осложнений отмечено не было, кровопотеря составила 50 мл, время операции – 210 минут, а период пребывания в стационаре – 24 часа. На 7-е сутки у пациента удален уретральный катетер и уже спустя 4 недели больной полностью удерживал мочу. По данным патогистологического заключения поставлена клиническая стадия pT3bN0 (сумма баллов по Глисону 5+3, наличие положительного хирургического края). На фоне приема гормональных препаратов уровень ПСА крови у пациента через 10 месяцев составил <0,1 нг/мл.
Сальважная РПЭ характеризется массой интра- и послеоперационных осложнений, таких как недержание мочи и повреждение прямой кишки. Однако именно сальважная РПЭ позволяет значительно увеличить безрецидивную выживаемость [4]. К подобным выводам пришли B.T. Chen и D.P. Jr. Wood [7] в своей работе, оценивающей возможность выполнения сальважной РПЭ у пациентов, перенесших лучевую терапию и криоаблацию предстательной железы в качестве первичного лечения.
В 1995 г. S.A. Grampsas и соавт. [8] впервые сообщили о выполнении сальважной простатэктомии после криоаблации ПЖ. Целью данного исследования, включившего 6 пациентов с клинической стадией РПЖ Т3, стала корреляция ультразвуковой картины, полученной во время криоаблации с данными патогистологического заключения после сальважной простатэктомии. При медиане наблюдения до 12 месяцев ни у одного из пациентов не было данных за рецидив заболевания.
G.D. Grossfeld и соавт. [9] в обзоре данных из реестра Cancer of the Prostate Strategic Urologic Research Endeavor (CaPSURE) представили результаты лечения 2336 пациентов с РПЖ. Авторами было показано, что в отсутствие сальважного лечения среднее время от биохимического рецидива до развития клинического прогрессирования у таких пациентов составляет примерно 3 года. Возможными вариантами лечения данной категории больных являются гормональная терапия или спасительная РПЭ, крио- и брахитерапия.
Y. Ahallal и соавт. [10] представили данные ретроспективного исследования 15 пациентов, перенесших сальважную РПЭ после брахитерапии (n=8), дистанционной лучевой (n=8) и криотерапии (n=1). Лапароскопическая РПЭ выполнена 11 пациентам, 4 пациентам – РАРПЭ. Во всех случаях выполнялась двусторонняя тазовая лимфодиссекция. Средняя продолжительность операции составила 235 минут. Интраоперационная травма прямой кишки была у 1 пациента; при контрольной цистографии экстравазация контрастного вещества выявлена у 1 пациента. При патогистологическом заключении клиническая стадии pT2, pT3 и pT4 выявлена у 6, 7 и 2 пациентов соответственно; у 2 пациентов выявлены метастазы в лимфатические узлы. В течение 8-месячного периода наблюдения у 11 пациентов отсутствовали признаки прогрессирования заболевания. Через 21 месяц у 7 пациентов выявлен биохимический рецидив. При медиане наблюдения 8,4 месяца 7 пациентов полностью удерживали мочу, 7 пациентов использовали 1–2 прокладки в день (при медиане наблюдения 12,6 месяца). У 14 пациентов после операции отмечена эректильная дисфункция.
Данные периоперационных, онкологических и функциональных результатов сальважной РАРПЭ представили A.S. Bates и соавт. [11]. У данной группы пациентов (n=53) частота лимфоваскулярной инвазии была выше по сравнению с категорией больных, перенесших нервосберегающую РАРПЭ (р=0,032); наличие экстравазации контрастного препарата при цистографии и время удаления уретрального катетера также оказались выше (р<0,010). При стратификации рисков по шкале D'Amico пациенты, перенесшие сальважную РАРПЭ, относились к группе высокого риска (р=0,010).
B. Yuh и соавт. [12], проанализировав результаты лечения 51 пациента, перенесшего сальважную РАРПЭ, показали, что при среднем периоде наблюдения 36 месяцев 3-летняя безрецидивная выживаемость (БРВ) составляет 57%, частота осложнений – 35–47% (Clavien III–V). В 45% случаев пациенты контролировали удержание мочи, в 23% отмечено восстановление эректильной функции. Высокий уровень ПСА и наличие эктракапсулярной инвазии были ассоциированы с данными БРВ и прогрессированием (р<0,01).
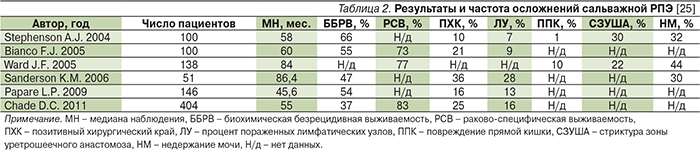
По данным B.T. Chen и D.P. Wood, десятилетняя раково-специфическая выживаемость, общая выживаемость и безрецидивная выживаемость в группе больных, перенесших сальважную простатэктомию по поводу рецидива РПЖ после лучевой терапии или криоаблации, составляет 70–75, 60–66 и 44–45% соответственно [19]. Результаты наиболее крупных исследований представлены в табл. 2 [13–18].
Выводы
В настоящее время в клинике урологии МГМСУ им. А.И. Евдокимова имеется наибольший опыт выполнения РАРПЭ. Появление роботической техники позволило активно предлагать данный метод лечения больным рецидивом РПЖ как после брахитерапии, так и после криоаблации и HIFU-терапии. Преимущества роботической техники позволяют чаще предлагать сальважную РПЭ данным пациентам, поскольку при сохранении всей радикальности лечения наблюдается меньшее количество осложнений.
Работа выполнена при поддержке РНФ, соглашение № 16-15-00233


