Ахалазия кардии (АК) — это первичное хроническое нейромышечное заболевание гладкой мускулатуры пищевода, характеризующееся нарушением функции нижнего эзофагеального сфинктера (НЭС) и проявляющееся дисфагией и регургитацией, обусловленное отсутствием рефлекторного раскрытия кардии при глотании, нарушением перистальтики и ослаблением тонуса грудного отдела пищевода.
Впервые данную болезнь описал Т. Willis в 1679 г. и пробужировал спазмированную часть пищевода китовым усом с намотанной губкой. Впоследствии J. Miculicz (1882) предложил для этой патологии термин «кардиоспазм». Термин «ахалазия» ввел в клиническую практику А. Hurst в 1914 г. В литературе встречаются также такие названия, как «идиопатическое расширение пищевода», «кардиостеноз», «мегаэзофагус», «френоспазм», «хитоспазм» и др.
На долю АК приходится от 3,1 до 20,0% всех поражений пищевода [13, 18, 11] (Моргенштерн А.З., 1968; Гребенев А.Л., 1969). В настоящее время в качестве причины дисфагии АК занимает третье место (5–8%) после рака пищевода и рубцовых стриктур на почве ожогов [7, 14, 18] (Василенко В.Х., Гребенев А.Л., Сальман М.М., 1971; Palmer E.D., 1952). Так, Ю.Е. Березов и М.С. Григорьев (1965) ставят АК на второе место после карциномы пищевода. По данным J.F. Mayberry, M. Atkinson (1985), E.B. Da Silveira, A.I. Rogers (2002), на 100 тыс. населения регистрируется примерно 0,51–1,0 случай заболевания. Наиболее часто (22,4%) АК встречается в возрасте 41–50 лет [5].
Этиология АК до настоящего времени остается невыясненной, хотя было выдвинуто несколько гипотез, согласно которым в основе развития заболевания могут лежать генетическая предрасположенность, вирусная инфекция, аутоиммунное поражение, психогенный фактор, нейродегенеративный процесс или их комбинация [23, 25–26]. Согласно каждой из этих теорий, этиологический фактор ведет к гипоганглиозу или даже аганглиозу межмышечных сплетений пищевода. Отсутствие раскрытия НЭС при АК и дало название болезни (лат. «а» — отсутствие, «chalasia» — расслабление). Транзит пищи в желудок происходит лишь при дополнительном наполнении пищевода жидкостью, когда вес ее столба оказывает механическое воздействие на кардиальный сфинктер [9].
Гистологические исследования при АК проведены довольно тщательно. Результаты показали отсутствие или дефицит ганглионарных клеток в нервных сплетениях пищевода, причем различают два вида ганглионарных клеток в зависимости от их способности импрегнироваться серебряной краской: аргирофильные и аргирофобные клетки. При ахалазии выявлено отсутствие ганлионарных аргирофильных клеток, число аргирофобных клеток может быть в норме или уменьшено [1]. Изменения при АК касаются не только интрамуральных нервных сплетений, но и мышечного слоя. Эти изменения заключаются в разрастании коллагеновых волокон между пучками гладкомышечной ткани [6].
В определении стадии АК у нашей пациентки мы пользовались описанием эндоскопической картины Ю.И. Галлингера и Э.А. Годжелло (1999), сделанным ими на основании классификации Б.В. Петровского, О.Д. Федоровой (1962) [4, 7]. При I стадии АК не отмечается эндоскопических изменений ширины просвета пищевода, его перистальтики, состояния слизистой оболочки, положения кардии и степени ее раскрытия, непроходимость кардии носит спастический характер. При II стадии заболевания эндоскопически определяется незначительное (до 3–4 см) расширение просвета пищевода и отсутствие в нем остатков пищи, жидкости или слизи. Складки слизистой оболочки расположены продольно; слизистая оболочка гладкая, ровная, блестящая. Кардия расположена по центру, обычно сомкнута, но достаточно легко раскрывается при небольшой инсуффляции воздуха. При ретроградном осмотре складки в области пищеводно-желудочного перехода плотно охватывают эндоскоп, слизистая оболочка мягкая и эластичная. Для III стадии заболевания характерно расширение пищевода до 5–7 см и наличие в его просвете остатков жидкой и плотной пищи, обилие слизи.
В дистальном отделе пищевода отмечается начинающаяся S-образная деформация, за счет чего кардия расположена эксцентрично и, как правило, сомкнута. Слизистая оболочка пищевода несколько утолщена за счет задержки пищи, может быть гиперемирована в дистальном отделе. При IV стадии АК просвет пищевода резко расширен (часто более 7–10 см) и извит, содержит массу жидкости и остатков пищи, слизистая оболочка утолщена, рыхлая, местами имеет крупноячеистый вид, отмечается поперечная складчатость слизистой оболочки пищевода за счет его удлинения и растяжения. Очень часто пищевод заканчивается «слепым мешком», заполненным остатками пищи, а кардия резко стенозирована, смещена в сторону и, как правило, находится выше дна этого мешка. Эта классификация в полной мере отражает эволюцию заболевания, включая его осложнения.
Современное лечение АК направлено на устранение функционального барьера в виде спазмированного НЭС, на расширение кардии и снижение тонуса НЭС. В настоящее время в лечении АК общеприняты медикаментозный, хирургический и эндоскопический методы. Длительное время основным методом лечения АК был оперативный. Предложено более 60 способов хирургического лечения, что говорит о сложности данной проблемы. Развитие эндоскопии привело к появлению альтернативного метода лечения (бескровное расширение кардии). Из предложенных видов лечения АК на сегодняшний день наибольшее признание получили баллонная кардиодилатация, эндоскопическое интрамуральное введение ботулинического токсина, кардимиотомия по Геллеру в различных модификациях (POEM-personal endoscopic myotomy) [2, 4, 10, 12, 17]. Не вызывает сомнений и тот факт, что, прежде чем решать вопрос о необходимости хирургического вмешательства, первично в отношении всех больных АК должны быть использованы неоперативные методы лечения (Гнилитский Л.А., 1981; Черноусов А.Ф., Чернявский А.А., 1986) [5].
За последние годы за рубежом и в нашей стране (впервые в 2002 г. в Казани) в клиническую практику был внедрен эндоскопический метод лечения АК путем интрамурального введения в область НЭС ботулинического токсина типа А, разработанный впервые в 1994 г. P. Pasricha. Клиническое действие ботулотоксина А проявляется обратимым параличом мышц в месте инъекции, что снижает тонус НЭС. Инъекцию токсина применяют и в тех случаях, когда ранее выполненная кардиодилатация или оперативное лечение оказывались неэффективными. Эта инъекция, как правило, серьезными осложнениями не сопровождается. При таком лечении существенное уменьшение или ликвидация симптомов дисфагии и регургитации отмечается у 65–95% больных (в среднем у 70%). Многочисленные исследования показали, что непосредственный эффект от введения ботулотоксина сопоставим с таковым при кардиодилатации, а безопасность самой процедуры значительно выше. Однако через 3–6 месяцев почти у 70% больных наблюдается рецидив АК, что требует повторного лечения [25, 26].
Преимущества данного метода:
- короткий койко-день;
- низкий риск осложнений;
- безболезненность вмешательства и как следствие – отсутствие необходимости в анестезиологическом пособии;
- однократное введение препарата за одну госпитализацию [6].
К недостаткам данного метода относятся высокая стоимость препарата и необходимость гарантированного транспорта препарата в мышцу.
Показания к лечению АК ботулотоксином А:
- терапия первой линии при лечении АК;
- АК IV стадии при отказе больного от радикального оперативного лечения;
- рецидив дисфагии после предшествующей операции или кардиодилатации;
- возраст пациента выше 70–80 лет.
Противопоказаниями к лечению ботулотоксином А являются:
- миастения и миастеноподобные синдромы;
- беременность и лактация;
- повышенная чувствительность
- к компонентам препарата;
- прием препаратов, влияющих на нервно-мышечную передачу (аминогликозиды, эритромицин, тетрациклин, полимиксин, миорелаксанты).
Наблюдаются следующие побочные и, как правило, преходящие эффекты при введении ботулотоксина А:
- тахикардия;
- нечеткость зрения;
- боль в эпигастрии;
- аллергические реакции;
- развитие эрозивного эзофагита в месте инъекции [6].
Ниже приводим описание клинического случая лечения АК путем интрасфинктерного введения ботулинического токсина типа А (ранее не описанного в России) под контролем эндоскопической ультрасонографии (ЭУС).
Клинический случай
Больная Г.О.Н. 54 лет поступила в хирургическое торакальное отделение ГБУЗ АО «Архангельская областная клиническая больница» 01.06.15 по экстренным показаниям без направления с жалобами на затруднение глотания твердой пищей.
Из анамнеза известно, что больная страдает дисфагией на протяжении 6 месяцев. Хронические заболевания: хронический гастрит, хронический холецистит. Аллергии нет.
При поступлении в стационар: состояние больной средней степени тяжести, температура тела 36,8°С, кожные покровы чистые, влажные, обычной окраски, артериальное давление 130/75 мм рт.ст., пульс – 74 удара в минуту. Тоны сердца ясные, ритмичные, шумов нет. Дыхание везикулярное, хрипов нет, частота дыхания – 16 дыхательных движений в минуту. При пальпации живот мягкий, безболезненный, симптомы раздражения брюшины отсутствуют, перистальтика ослаблена. Физиологические отправления в норме.
Среди дополнительных методов обследования были проведены общий анализ крови+сахар (дважды), общий анализ мочи+микроскопия осадка, биохимическое исследование крови, коагулограмма, определение группы крови и резус-фактора, анализ крови на RW (реакция Вассермана) и ВИЧ (вирус иммунодефицита человека), маркеры гепатита, электрокардиография (ЭКГ), эзофагогастродуоденоскопия (ЭГДС), обзорная рентгенография органов грудной клетки.
По результатам проведенных лабораторных методов исследования больной установлено, что клинический анализ крови, коагулограмма, биохимия и сахар крови от 02.06.15 в пределах нормы. В микроскопии осадка мочи определено небольшое количество плоского эпителия, лейкоцитов, эритроцитов и фосфатных солей.
Была проведена ЭГДС (02.06.15), по заключению которой было определено наличие кардиоспазма 2–3-й степеней. Хронический гастрит, умеренное обострение. Единичная эрозия антрального отдела желудка.
При обзорной рентгенографии органов грудной клетки от 05.06.15 в легких без очагово-инфильтративных изменений, корни легких не расширены, структурны, синусы свободны, отмечено расширение срединной тени в нижних отделах, расположенной на фоне тени сердца, аорты.
Таким образом, на основании жалоб больной, эволюции признаков болезни, на основании данных, полученных при непосредственном обследовании больного и результатов специальных методов исследования, поставлен следующий клинический диагноз: основное заболевание: ахалазия кардии, III стадия. Осложнения основного заболевания: отсутствуют. Сопутствующие заболевания: хронический гастрит, обострение. Хронический холецистит, ремиссия.
На основании имеющихся данных и по результатам врачебной комиссии от 02.06.15 было принято решение о применении эндоскопического метода лечения путем инъекции ботулотоксина А в область НЭС под контролем ЭУС.
Перед проведением эндоскопического вмешательства женщине рекомендовано в течение 2–3 дней принимать только жидкую пищу. Накануне вечером проведено промывание пищевода через желудочный зонд.
Пациенткой было подписано информированное добровольное согласие на проведение процедуры с использованием препарата ботулинического токсина типа А со следующими обстоятельствами лечения:
Срок эффективного действия препарата составляет 4–6 месяцев, после чего возможна повторная инъекции.
Действие препарата наступает через 7–10 дней после проведенной инъекции.
В срок до 1 месяца после инъекции могут наблюдаться такие преходящие побочные эффекты, как слабость мимической мускулатуры.
Для профилактики образования антител к препарату интервал между повторными инъекциями должен как минимум превышать 2 месяца.
По данным международной ассоциации двигательных расстройств, нечувствительность к проведенному лечению составляет порядка 0,01%.
Имеются противопоказания к применению препарата в соответствии с инструкцией.
Непосредственно перед эндоскопической манипуляцией от 08.06.15 была выполнена премедикация (0,01%-ный раствор атропина и 1%-ный раствор Димедрола подкожно) и местная анестезия глотки (орошение слизистой оболочки ротоглотки Дикаином). Эндоскопия выполнена в положении больной лежа на левом боку.
Для проведения процедуры мы использовали стерильную лиофилизированную форму ботулинического токсина типа А, свободного от комплексообразующих белков, продуцируемого Hall штаммом бактерии Clostridium botulinum типа А. Препарат ботулотоксина А введен «off label».
Доза на одну пациентку составила 50 ЕД порошкообразного токсина. Прокалывая резиновую пробку алюминиевого колпачка плотно закрытого флакона, через иглу инъекционным шприцем было введено 2 мл 0,9%-ного раствора хлористого натрия для растворения порошка (это условие являлось необходимым, т.к. ботулотоксин А поступает в клетку только в присутствии ионов натрия).
Из флакона набрали в шприц 1,0 мл разведенной субстанции, добрали в шприц еще 1,0 мл 0,9%-ного раствора хлористого натрия, после чего шприц с 2,0 мл раствора лекарственного средства был готов к введению.
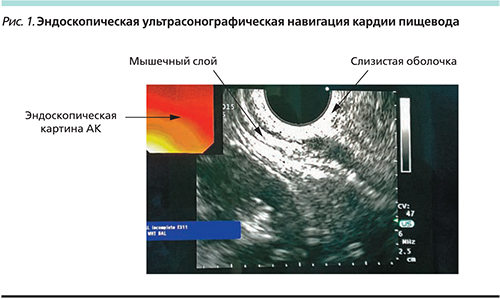
Исследование проведено эхоэндоскопом с конвексным сканированием GF-UCT 140 «Olympus» в условиях внутривенной седации (инъекция атропин 0,5 мг, фентанил 0,1 мг, пропофол 100 мг). Эхоэндоскоп был свободно проведен в пищевод до кардии (рис. 1). В просвете определена масса пищевых масс. Часть пищевых масс была эвакуирована механическим способом в желудок.
Под контролем ЭУС с целью позиционирования пункционной иглы NM-1 фирмы «Olympus» через биопсийный канал видеоэндоскопа OLYMPUS EXERA III CV-190 (рис. 2А, Б) был введен ботулотоксин А равными порциями по 12,5 ЕД в 4 точки в мышечный слой НЭС через слизистую оболочку на 12, 3, 6 и 9 часах (рис. 3, 4).
Эндоскопическое интрасфинктерное введение ботулотоксина А серьезными осложнениями для нашей пациентки не сопровождалось. Инъекция ботулинического токсина типа А была проведена однократно, клинический эффект развился через 72 часа. Действие токсина проявлялось расслаблением спазмированной кардии с последующей ликвидацией симптомов дисфагии и регургитации. Значительное уменьшение симптомов дисфагии было отмечено на 7-е сутки после операции.
Контрольный анализ крови от 15.06.15 был без патологии, на контрольной ЭГДС от 16.06.15 определены кардиоспазм 2-й степени (слабоположительная динамика), хронический гастрит, умеренное обострение. Субъективно пациенткой было отмечено уменьшение дисфагии. Пациентка выписана 16.06.15 в удовлетворительном состоянии. Больная провела в стационаре 15 койко-дней.
Инъекция ботулотоксина А только под видеоэндоскопическим контролем не всегда гарантирует доставку препарата в орган-мишень (мышечную оболочку НЭС), имеется риск введения препарата в другие слои стенки пищевода либо в кровеносные сосуды. Следует также отметить, что длина иглы стандартного инжектора для эндоскопа составляет 5 мм, в то время как инжектор для ЭУС позволяет варьировать глубину инъекции до 30 мм.
При проведении нашей процедуры игла вводилась на глубину 8 мм (при глубине в 5 мм инъекция не достигла бы цели).
Таким образом, использование ЭУС во время инъекции ботулинического токсина типа А представляет собой достаточно привлекательный метод лечения, т.к. это помогает в определении наиболее точной точки для введения токсина в мышечной слой пищевода и обеспечивает гарантированное попадание препарата в мышцу. Инъекция препарата под ЭУС-контролем позволяет избегать указанных выше нежелательных моментов введения препарата только под визуальным контролем, способствует снижению риска кровотечения, а также предотвращает случайную инъекцию токсина в кровеносные сосуды или другие слои стенки пищевода.
Есть несколько сообщений в зарубежной литературе, описывающих успешное применение ЭУС-контроля при введении ботулинического токсина типа А больным АК и варикозно-расширенными венами пищевода (Rana S.S., Bhasin D.K., Rao C., Sarwal R., Singh K., 2013).
Ботулотоксин А показал себя эффективным препаратом для купирования симптомов АК. В перспективе планируется дальнейшее применение описанного способа лечения больных АК и расширение показаний к применению препарата ботулинического токсина типа А.
Поставлен организационный вопрос перед администрацией учреждения о возможностях создания и ведения регистра таких пациентов с последующей статистической оценкой результатов терапии.



