Глюкокортикоиды (ГК) являются единственным лекарственным средством, обладающим сочетанием ярких и быстрых противовоспалительных и иммунодепрессивных свойств и таким образом осуществляющим разностороннее влияние на иммунопатологические процессы при ревматических заболеваниях и некоторых других состояниях [4, 5]. Термин «глюкокортикоид» связан со способностью этих соединений стимулировать отложение гликогена в печени и повышать содержание глюкозы в крови.
В сентябре 2008 г. исполнилось 60 лет со дня первого применения кортизона в клинической практике [6, 7]. Несмотря на более чем полувековой период после внедрения ГК в терапевтическую практику, они до сих пор занимают одно из первых мест в противовоспалительной терапии.
Широкое применение ГК в клинике внутренних заболеваний берет начало с 1927 г., когда три группы исследователей, Hartman и сотрудники, Rogoff и Stewart, продлили жизнь адреналэктомированным животным путем введения жирорастворимой фракции тканей надпочечников. С 1930 г. экстракт надпочечников используется в лечении болезни Аддисона. Далее группа ученых в составе Е.К. Кендалла, Т. Райхтейна и В. Винтерштейнера выделили кортизон из экстракта бычьих надпочечников [7].
Однако история клинического применения ГК неразрывно связана с развитием ревматологии, а именно с клиническим наблюдением врача-ревматолога Филиппа Шоуолтера Хенча (клиника Мейо, США). В августе 1948 г. Ф. Хенч и его коллеги, Ч. Слокум и Х. Полей, лечили больную тяжелой формой ревматоидного артрита лактофенином с целью развития у нее желтухи и уменьшения таким образом выраженности симптомов артрита. Однако лечение оказалось неэффективным. Поэтому было принято решение о введении этой женщине кортизона (в виде суспензии кристаллов в физиологическом растворе). 21 сентября 1948 г. 29-летней женщине с ревматоидным артритом была сделана первая инъекция достаточно высокой дозы кортизона (100 мг) с поразительным клиническим эффектом. Этот день ознаменовал начало эры современной глюкокортикоидной терапии. Впоследствии Ф. Хенч вспоминал, что в течение следующих 3 дней состояние пациентки существенно улучшилось и продолжало улучшаться, пока доза вводимого кортизола не снизилась до 25 мг. Это было первое доказательство высокой клинической эффективности ГК при ревматоидном артрите [15].
В 1950 г. за открытие глюкокортикоидных гормонов и создание на этой основе глюкокортикоидных препаратов Ф. Хенч, Т. Рейхтейн и Э.К. Кендалл были отмечены Нобелевской премией в области медицины и физиологии.
Открытие, синтез и клиническое применение ГК являются одними из самых выдающихся достижений медицины прошлого столетия. С помощью стероидных гормонов врачи получили возможность вмешиваться в многочисленные патологические процессы, существенно моделируя их течение. Это поставило ГК в ряд сильнодействующих препаратов, незаменимых в ревматологии, аллергологии, онкологии, гематологии, гастроэнтерологии, ургентной медицине.
Однако применение ГК в клинической практике нередко сравнивают с обоюдоострым мечом: ГК, с одной стороны, обладают мощной терапевтической активностью, что позволяет быстро достигать положительного результата, однако, с другой стороны, многочисленные побочные эффекты служат причиной ограничения их применения в повседневной клинической практике и использования, только когда все другие лечебные возможности исчерпаны [2, 5].
Остеопороз (ОП), индуцированный приемом ГК, является одним из частых побочных эффектов длительной глюкокортикоидной терапии [1, 7, 22]. Это осложнение вызывает наибольшее беспокойство у врачей и пациентов, поскольку приводит к инвалидности и потере самостоятельности в повседневной жизни. С другой стороны, ОП легче других побочных эффектов ГК диагностируется и поддается профилактике [1, 3, 7].
Когда 70 лет назад Х. Кушинг впервые описал негативное влияние ГК на костную ткань, пациенты страдали только эндогенным гиперкортицизмом. В одной из своих работ Кушинг писал: «Время от времени развиваются переломы ключиц, ребер, грудины. При аутопсии выявляется остеопороз скелета с искривлением позвоночника, кости легко разрезаются ножом ...спонгиозная часть кости исчезает...» [12]. Таким образом, Кушинг впервые в 1932 г. описал связь между нарушением функции надпочечников и повышенной хрупкостью костей, на аутопсии он обнаружил ОП позвонков у 6 из 8 пациентов, умерших от «неустановленного полигляндулярного синдрома». А первый случай перелома костей, обоснованно связанный с приемом ГК, был описан в 1950 г. E.W. Boland и N.E. Headley [10].
Сегодня ситуация кардинально изменилась: существенным образом возросло число людей, использующих ГК по медицинским показаниям.
В настоящее время ГК относятся к числу средств, наиболее широко используемых в клинической практике при многочисленных заболеваниях и в ургентных ситуациях, а это означает, что доля пациентов с потенциально высоким риском развития ГК-индуцированного ОП будет только расти [1].
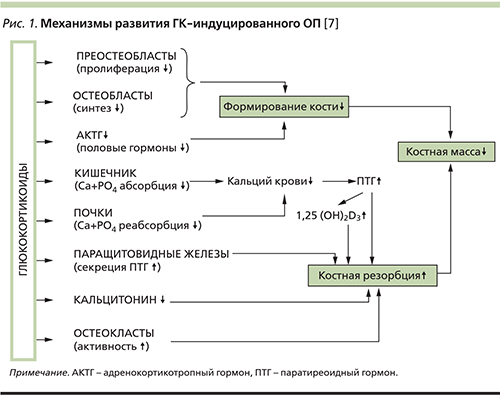
ГК-индуцированный ОП является наиболее частой и тяжелой формой вторичного ОП и характеризуется быстрой потерей костной массы, увеличением риска переломов уже в ранние сроки после начала ГК-терапии, что обусловливает необходимость первичной профилактики переломов у пациентов группы высокого риска [3, 18]. ГК-индуцированный ОП – это метаболическое заболевание костной ткани, которое развивается при лечении ГК в результате их негативного влияния на оба процесса костного ремоделирования – остеобласт-опосредованное формирование и остеокласт-опосредованную резорбцию костной ткани [7, 11, 19]. Механизм развития ГК-индуцированного ОП схематически представлен на рис .1.
За период изучения проблемы ГК-индуцированного ОП медицинское общество прошло путь от восприятия действительности существования данной проблемы и ее опасности для общества к пониманию тонких механизмов развития вторичного ОП и разработки направлений своевременной диагностики, профилактики, предупреждения и лечения. Так, на сегодняшний день известно, что частота развития ОП у пациентов, принимающих ГК более 6 месяцев, составляет около 50%, а 30% пациентов при длительном применении ГК имеют переломы костей различных локализаций [11, 17]. При приеме ГК в ежедневной дозе 7,5 мг и выше относительный риск переломов шейки бедра составляет 2,27 (95% доверительный интервал [ДИ] – от 1,94 до 2,66), а вертебральных переломов – 5,18 (4,25–6,31) по сравнению с пациентами, получавшими несистемную терапию ГК (ингаляционные, топические, в виде назальных или глазных капель) [20]. Интенсивные потери костной ткани происходят в течение первых 6 месяцев терапии ГК, а риск невертебральных переломов существенно возрастает в первые месяцы их системного приема, а в дальнейшем зависит от продолжительности их приема [3, 17, 19].

По сравнению с лицами, не принимающими ГК, относительный риск переломов бедра при использовании ГК увеличивается в 1,7 раза при суточной дозе ГК<10 мг и в 2 раза – при суточной дозе >10 мг, а риск переломов позвонков – в 2,7 и 3,2 раза соответственно. Сочетание длительности приема, высоких доз и постоянного режима приема ГК обусловливает драматическое возрастание риска переломов. Так, у пациентов, постоянно принимающих ГК в дозе >10 мг/сут более 90 дней, риск переломов бедра возрастает в 7 раз, а риск переломов позвонков – в 17 раз. Проведенные исследования продемонстрировали, что относительный риск переломов увеличивается линейно на фоне применения дозы <20 мг/сут, но экспоненциально в случае приема дозы >20 мг/сут [9].
Основные клинические черты ГК-индуцированного ОП представлены ниже [7, 22]:
- наиболее частая форма вторичного ОП;
- развивается при хронических неинфекционных заболеваниях (бронхиальная астма, ревматические заболевания, воспалительные заболевания кишечника, др.);
- развивается у мужчин и женщин любого возраста;
- у 50% пациентов, получавших длительную ГК-терапию, развиваются переломы костей или аваскулярные некрозы;
- переломы костей развиваются при более высокой, чем при первичном ОП, минеральной плотности костной ткани (МПКТ);
- наиболее частыми видами переломов являются компрессионные переломы позвонков, они развиваются бессимптомно, протекают субклинически и вовремя не диагностируются;
- возможна нормализация МПКТ после отмены ГК, однако большинство осложнений ОП, таких как деформация позвоночника и хроническая боль в спине, постоянны.
Результаты исследований последнего десятилетия обусловили изменения критериев, определяющих необходимость обследования, профилактики и лечения пациентов, которые получают системную ГК-терапию. Так, минимальная продолжительность приема ГК уменьшилась с 6 до 3 месяцев. Лечебные и профилактические мероприятия зависят от пола и возраста пациентов. Изменились представления о пороговой суточной дозе ГК: она снизилась с 7,5 до 2,5 мг [13, 14, 22]. Впрочем, противоречивым остается вопрос о предельном значении МПКТ, при котором нужно проводить лечение. Активно внедряется система FRAX – оценка 10-летнего абсолютного риска (вероятности) переломов при ГК-индуцированном ОП у мужчин старше 50 лет и женщин старше 40 лет [16].

Изменения стратегии и тактики ведения больных ГК-индуцированным ОП продемонстрированы во многих клинических рекомендациях:
- канадские рекомендации по профилактике и лечению ГК-индуцированного ОП (2000);
- рекомендации Американской коллегии ревматологов (ACR – American College of Rheumatology) 1996 г., просмотр 2001, 2010 гг. [14];
- австралийские (2001);
- английские 2002 г., просмотр 2004 г.;
- рекомендации Американского эндокринологического общества (2003);
- российские 2005 г., пересмотр 2009 и 2012 гг. [3];
- голландские (2004);
- японские (2005);
- бразильские (2012);
- украинские (2011);
- европейские (IOF и ECTS) – основа для разработки руководящих принципов по менеджменту ГК-индуцированного ОП (2012).
Первые рекомендации ACR в 1996 г. касались пациентов, которые уже начали длительный прием ГК. В рекомендациях было указано, что суточная доза, нуждающаяся во внимании врача, составляет 7,5 мг (в пересчете на преднизолон); продолжительность приема более 6 месяцв. В 2000 г. появились результаты широкомасштабного когортного исследования, которые продемонстрировали увеличение риска переломов костей на фоне использования дозы ГК <5 мг/сут. Эти исследования прежде всего указали на отсутствие «безопасных» доз ГК и необходимость лечебно-профилактических мероприятий для всех пациентов, которым проводится или планируется проведение длительной пероральной ГК-терапии. После пересмотра рекомендаций ACR 2001 г. была снижена «пороговая» суточная доза ГК до 5 мг, а также продолжительность приема ГК до 3 месяцев. Ризедроновая и алендроновая кислоты были рекомендованы как препарат первой линии для профилактики и лечения ГК-индуцированного ОП у всех женщин в постменопаузе и у мужчин, которым начата длительная системная терапия ГК в дозе >5 мг/сут или при условии низких значений МПКТ (меньше -1,0 SD по Т-критерию). Как препарат второй линии рассматривали кальцитонин. В Канадских рекомендациях 2002 г. впервые акцентировано внимание на необходимости проведения денситометрии у пациентов, длительно принимающих ГК не только с диагностической целью, но и для мониторинга эффективности терапии, а главным фактором риска переломов определен длительный прием ГК (более 3 месяцев).
Впервые также было выделено две группы пациентов высокого риска:
- пациенты, которые начали или длительно получают терапию ГК в дозе >7,5 мг/сут более 3 месяцев, таким больным необходимо лечение;
- пациенты, получающие ГК в дозе <7,5 мг/сут более 3 месяцев, для таких больных обязательно измерение МПКТ.
В 2010 г. были опубликованы рекомендации ACR последнего пересмотра по профилактике и лечению ГК-индуцированного ОП. В них четко указано на необходимость учета индивидуальных факторов риска переломов и ОП, которые сформулированы следующим образом:
- низкий индекс массы тела;
- семейный анамнез переломов костей;
- курение;
- употребление ≥3 порций алкоголя в сутки;
- высокая ежедневная доза ГК;
- высокая кумулятивная доза ГК;
- внутривенная пульс-терапия ГК;
- снижение МПКТ, что превышает показатели надлежащих изменений.
На основании этих факторов, а также значений FRAX формируются группы пациентов с низким, средним и высоким риском возникновения переломов и в зависимости от этого предлагается осуществлять профилактические и лечебные мероприятия [16]. Во всех группах лиц, которым проводится ГК-терапия или планируется ее проведение, необходимо назначать коррекцию образа жизни; среди этих рекомендаций важнейшим направлением служт дополнительный прием кальция и витамина D.
В течение длительного времени неизменным подходом к профилактике ГК-индуцированного ОП были использование минимально эффективных терапевтических доз ГК, по возможности снижение их дозы на фоне приема препаратов для локального применения, сбалансированная диета с достаточным потреблением кальция, адекватная физическая нагрузка, исключение курения и употребления алкоголя. При доступности двуэнергетической рентгеновской абсорбциометрии (ДРА) необходимо ежегодное измерение МПКТ. Необходимо также ежегодное измерение роста для контроля его снижения.

Комбинацию кальция и витамина D следует назначать всем больным, начавшим прием ГК. Доза витамина D для взрослых составляет 800 МЕ/сут, а элементарного кальция – 1200–1500 мг/сут, включая питание (см. таблицу). Именно эти рекомендации имеют самую высокую степень доказательности – А.
Профилактика ГК-индуцированного ОП направлена прежде всего на рациональное лечение основного заболевания, предотвращение потери костной массы у пациентов с остеопенией или нормальной МПКТ у лиц, которые начинают терапию ГК (первичная профилактика). Предотвращение дальнейших потерь костной массы и переломов у пациентов с низкой МПКТ и/или наличием переломов в анамнезе на фоне ГК-терапии следует рассматривать как вторичную профилактику ОП.
В рекомендациях ACR (2010) предложено выделять группы риска пациентов (низкий, средний и высокий на основании изучения индивидуальных факторов риска и оценки FRAX), а также проводить лечебные и профилактические мероприятия в зависимости от возраста и пола пациентов (рис. 2 и 3).
В лечении пациентов с ГК-инду-цированным ОП препаратом первой линии являются бисфосфонаты (алендроновая кислота, ризедроновая кислота и золедроновая кислота) [21]. Они рекомендованы для профилактики и лечения ГК-индуцированного ОП всем женщинам в постменопаузе и мужчинам старше 50 лет, которым начата длительная терапии ГК в дозе >5 мг/сут или имеющим низкие показатели МПКТ (менее чем -1SD по Т-критерию). Женщинам репродуктивного возраста с низкой МПК бисфосфонаты могут быть назначены на фоне обязательного применения контрацептивов. Профилактика ГК-индуцированного ОП показана всем пациентам, которым планируется длительная (более 3 месяцев) терапия ГК в дозе >5 мг/сут [14].
Показанием к назначению противоостеопоротического лечения женщин в постменопаузе и мужчин 50 лет и старше, которым проводится или планируется длительная ГК-терапия пероральными препаратами, служит любой из следующих критериев:
- возраст 70 лет и старше (А);
- низкоэнергетические переломы в анамнезе или на фоне приема ГК (А);
- высокие дозы ГК (≥7,5 мг/сут) (D);
- при изменении МПКТ (Т-критерий ≤-1,5SD) (В).
В отсутствие вышеперечисленных критериев при назначения терапии необходимо оценить риск основных переломов с помощью FRAX (D). Если 10-летний риск основных остеопоротических переломов превышает порог вмешательства, пациенту показано противоостеопоротическое лечение (D). Показанием к назначению лечения женщин в пременопаузе и мужчин моложе 50 лет, которым проводится или планируется длительная (3 месяца и более) терапия пероральными ГК, является наличие низкоэнергетических переломов в анамнезе или на фоне приема ГК (А). В отсутствие низкоэнергетических переломов, но наличии низкой МПКТ (Z-критерий ≤-2,0 SD) решение о назначении препаратов для лечения ОП принимается только при учете всех факторов риска и на основе тщательного рассмотрения всей клинической ситуации (D) [3]. Алгоритм терапии пероральными ГК более 3 месяцев представлен на рис. 4.
Таким образом, в 2010 г. ACR предложила обновленную версию рекомендаций для пациентов, которые получают системную ГК-терапию. Если в рекомендациях ACR (2001) акцентировано внимание на отказе от курения и чрезмерного употребления алкоголя, адекватном потреблении кальция и витамина D, то в новые рекомендации включены позиции о необходимости консультирования и мониторинга состояния пациентов, оценки склонности к падениям, определения статуса D гормона. Рекомендации также разработаны для групп пациентов с переломами костей в анамнезе вследствие хрупкости и их отсутствием.
В новых рекомендациях для лечения пациентов наряду с алендроновой и ризедроновой кислотами предложено применение золедроновой кислоты и терипаратида, что существенно расширяет возможности терапии.
Итак, ГК-индуцированный ОП является серьезной проблемой для пациентов, длительно принимающих ГК. За последние 20 лет наши знания об эпидемиологии и патофизиологии этого заболевания существенно расширились, появились препараты с доказанной эффективностью для его профилактики и лечения. Однако значительное количество исследований свидетельствует о серьезных недостатках в организации помощи пациентам с ГК-индуцированным ОП. Национальные клинические рекомендации призваны улучшить понимание проблемы ГК-индуцированного ОП, усовершенствовать методы исцеления и профилактики этого заболевания.



