Одним из самых распространенных хронических заболеваний в пожилом возрасте является остеопороз (ОП), который характеризуется снижением плотности и качества кости, что ведет к возникновению переломов при низком уровне травмы. Конечной целью лечения ОП является предупреждение таких переломов, а проведенные рандомизированные плацебо-контролируемые исследования по оценке эффективности различных противоостеопоротических препаратов доказали антипереломное действие таких лекарственных средств, как бисфосфонаты, деносумаб, терипаратид, стронция ранелат, препараты витамина D и кальция. Кроме того, в этих исследованиях оценивалось влияние препаратов на минеральную плотность костей (МПК), прирост которой выявлялся при повторных денситометрических обследованиях пациентов. Следует помнить, что в клинические исследования происходит отбор больных по жестким критериям, при этом очень часто критерии исключения более многочисленны, чем критерии включения, что заведомо делает выборку больных, вошедших в исследование, неравнозначной тем больным, которых мы встречаем в повседневной практике.
В реальной клинической практике полноценный эффект противоостеопоротических препаратов зависит не только от наличия сопутствующей патологии, но и от тщательности соблюдения рекомендаций по их приему, особенно это относится к пероральным бисфосфонатам. В то же время бисфосфонаты, которые применяются парентерально, также имеют свои особенности действия, например гриппоподобный синдром, возникающий в первые 1–3 дня после введения и достаточно часто приводящий к нежеланию пациентов продолжать лечение данными препаратами, хотя при повторных введениях частота этих побочных эффектов снижается.
Еще один вопрос, который требует внимания при ведении больных ОП, – это перевод пациента с одного препарата на другой, что может быть связано как с неэффективностью предшествующего лечения или пло-хой его переносимостью, так и с низкой приверженностью лечению.
Целью нашей работы было проспективное наблюдение за женщинами с постменопаузальным ОП, начавшими лечение деносумабом, для оценки эффективности, переносимости и приверженности лечению.
Материал и методы
В наблюдение включены 40 женщин в постменопаузе (ср. возраст – 67,6±6,9 года), у которых диагностирован ОП по критериям Всемирной организации здравоохранения хотя бы в одном из отделов осевого скелета (Т-критерий ≤-2,5 стандартных отклонений – СО или остеопения – -1СО<Т-критерий<-2,5СО) при наличии в анамнезе перелома при низком уровне травмы (падении с высоты собственного роста или спонтанном) в возрасте после 40 лет и которым в консультативном отделении ФГБНУ НИИР им. В.А. Насоновой было рекомендовано лечение деносумабом. Основным условием данного проспективного наблюдения являлось подкожное введение препарата 1 раз в 6 месяцев в процедурном кабинете консультативного отделения ФГБНУ НИИР им. В.А. Насоновой для подтверждения получения пациенткой лечения и последующей регистрации возможных побочных эффектов, связанных с препаратом. Все женщины дополнительно получали препараты кальция (500–1000 мг/сут) и витамина D (800–2000 МЕ). Для включения в программу наблюдения все пациентки подписали информированное согласие на обработку обезличенных данных их медицинской документации. Характеристика женщин представлена в табл. 1.
Конечной точкой исследования была динамика МПК в трех отделах скелета, денситометрическое обследование проводилось каждые 6 месяцев. Переломы регистрировались как нежелательное явление.

Статистическую обработку проводили с помощью пакета прикладных программ «Statistica for Windows 8.0 StatSoft» с использованием параметрических и непараметрических методов сравнения. Статистически значимыми считались различия при р<0,05.
Результаты исследования
В течение года 38 (95%) пациенток получили 2 подкожные инъекции деносумаба. Две женщины сделали только по одному введению препарата, а затем отказались продолжить лечение, что было связано с его высокой стоимостью.
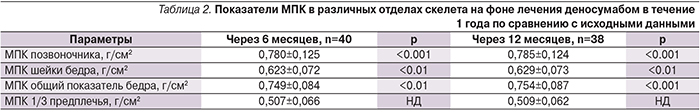
Динамика МПК на фоне лечения через 6 и 12 месяцев наблюдения представлена в табл. 2. Уже через 6 месяцев был отмечен достоверный прирост МПК в осевом скелете, который сохранялся и через 12 месяцев наблюдения. Не было получено досто-верного прироста МПК в дистальном отделе предплечья как после первой, так и после второй инъекции препарата.
Наиболее значимый прирост МПК был в поясничном отделе позвоночника как через 6, так и через 12 месяцев по сравнению с другими областями измерения (р<0,05: см. рисунок).
При анализе динамики показателей МПК у женщин, получавших какую-либо противоостеопоротическую терапию до назначения деносумаба, и в группе без предшествующего лечения не было получено достоверных различий ни по одной из областей измерения МПК между этими пациентами. Также не были выявлены различия в динамике МПК при статистической обработке отдельно по каждой группе препаратов, которые они принимали в течение последнего года до включения в проспективное наблюдение, по сравнению с никогда не лечившимися больными. Анализ прироста МПК у пациентов в зависимости от длительности предшествующего лечения бисфосфонатами не показал значимого ее влияния на эффективность терапии деносумабом, хотя и был наиболее низким у лиц, принимавших бисфосфонаты более 3 лет (3,1%, 1,5 и 1,7% соответственно в поясничном отделе, шейке и общем показателе бедра), в то время как у женщин, начавших лечение впервые, эти показатели составили 4,9%, 4,3 и 4,4% соответственно (р>0,05). Не было получено различий в динамике МПК в зависимости от исходного уровня витамина D в сыворотке крови.
Динамика биохимических показателей представлена в табл. 3. Не было отмечено случаев гипокальциемии, средний уровень кальция в крови во всей группе статистически значимо не изменился. На фоне лечения во всей группе выявлено достоверное снижение уровня общей щелочной фосфатазы через 6 и 12 месяцев терапии, при этом наиболее выраженно, хотя и статистически недостоверно, оно было у лиц без предшествующего лечения по сравнению с женщинами, получавшими бисфосфонаты до начала терапии деносумабом (на 23 и 9% соответственно, p>0,05). Уровень креатинина за время лечения не изменился.
За период наблюдения не было зафиксировано ни одного периферического перелома и клинического перелома позвонка. Не отмечено снижения роста ни у одной пациентки. Лишь одна больная сообщила о высыпаниях на коже через месяц после инъекции, однако связь с подкожным введением деносумаба врач отметил как сомнительную. При повторном введении препарата кожных высыпаний не было.
Обсуждение
Деносумаб – генно-инженерный препарат, представляющий собой полное человеческое моноклональное антитело, механизм действия которого связан с ингибицией лиганда рецептора активатора ядерного фактора каппа В (RANKL – Receptor activator of nuclear factor kappa-B ligand), в результате чего не происходит связывания RANKL с самим рецептором (RANK), находящимся на незрелых остеокластах, предотвращая их созревание, и на зрелых остеокластах, предотвращая их функционирование, что ведет к снижению резорбции костной ткани [1]. Концентрация деносумаба в сыворотке крови в большинстве случаев остается стабильной в течение 6 месяцев после введения, приводя к снижению костного обмена, в первую очередь костеразрушения [2], при этом воздействие на резорбцию костной ткани обратимо [3]. После прекращения лечения данным препаратом отмечалось увеличение уровней маркеров костного обмена и снижение МПК, однако возобновление терапии приводило к резкому снижению маркеров до уровня ниже исходных и повышению МПК в поясничном отделе позвоночника и проксимальном отделе бедра [4].
Препарат показал хорошую эффективность в ходе проведения многоцентровых плацебо-контролируемых клинических исследований, на основании которых он был зарегистрирован для лечения постменопаузального ОП и ОП у мужчин. Деносумаб вводится подкожно 1 раз в шесть месяцев, что может положительно сказываться на приверженности больных ОП лечению данным препаратом.
В наше проспективное наблюдение в реальной клинической практике были включены 40 женщин, при этом 30% из них были с впервые диагностированным ОП, т.е. деносумаб был для них первым противоостеопоротическим препаратом. На фоне его введения отмечался достоверный прирост МПК как в поясничном отделе позвоночника, так и в проксимальном отделе бедра уже через 6 месяцев лечения, при этом увеличение МПК составило в среднем после двух инъекций около 5% в поясничном отделе позвоночника, 3,2% в шейке бедра, 3,0% в бедре в целом, что соответствует данным, полученным в ходе клинических исследований [5–7].

Мы не получили достоверных различий в динамике МПК между пациентами, переведенными с других противоостеопоротических препаратов на деносумаб, и женщинами с постменопаузальным ОП, впервые начавшими лечение. В то же время исследование III фазы STAND показало, что прирост МПК у женщин с постменопаузальным ОП зависит от длительности предшествующего лечения бисфосфонатами: положительная динамика МПК была наиболее выражена у лиц, получавших алендронат 6–12 месяцев, а наименее – больше 24 месяцев [8]. В нашей работе 1 (6%) пациентка получала лечение бисфосфонатами 1 год, 4 (25%) человека – ≤2 лет, а 11 (69%) женщин – более 3 лет. Сравнение прироста МПК через 12 месяцев терапии деносумабом в этих группах женщин не выявило влияния длительности терапии бисфосфонатами на его эффективность. В то же время прирост МПК был наиболее низким у лиц, принимавших бисфосфонаты более 3 лет.
Не было получено различий в динамике МПК в зависимости от исходного уровня витамина D в сыворотке крови, что, возможно, связано с тем, что все пациенты, имевшие показатели 25(ОН)D менее 20 нг/мл, получали дополнительно витамин D3 из расчета 2000 МЕ/сут, в то время как остальные женщины принимали 800 МЕ/сут.
Мы выявили достоверное снижение уровня общей щелочной фосфатазы уже через 6 месяцев после первого подкожного введения деносумаба, которое сохранялось и через 12 месяцев, что косвенно может служить доказательством снижения костного обмена на фоне проводимого лечения. При этом оно было наиболее выражено у лиц, впервые начавших терапию деносумабом. Не было случаев гипокальциемии, что связано, во-первых, с тем, что у всех больных до введения деносумаба был достаточный уровень кальция в сыворотке крови, и, во-вторых, все пациентки дополнительно получали кальций и витамин D.
Имеются данные, что примерно половина больных в клинической практике прекращают прием противоостеопоротических препаратов в течение года после начала лечения [9].
В нашей выборке в течение года 95% пациенток получили 2 инъекции деносумаба, при этом отказ 2 (5%) женщин от продолжения лечения не связан с побочными эффектами препарата.
Таким образом, проведенное одногодичное проспективное наблюдение, выполненное в условиях реальной клинической практики, показало, что деносумаб – эффективное и безопасное средство для лечения больных постменопаузальным ОП. При этом предшествующее лечение противо-остеопоротическими препаратами (бисфосфонатами или стронция ранелатом) существенно не влияло на его эффективность.



