Острый бактериальный риносинусит (ОБР) – воспалительный процесс в полости носа и в одной или нескольких околоносовых пазухах продолжительностью до 12 недель – является серьезной проблемой клинической медицины практически во всем мире, в т.ч. и в России. В лечении пациентов с острыми гнойными воспалительными процессами в околоносовых синусах и их осложнениями принимают участие врачи разных специальностей – оториноларингологи, терапевты, педиатры, неврологи, офтальмологи, нейрохирурги и др. Вопросы диагностики и терапии ОБР не теряют своей актуальности, несмотря на значительное число исследований и публикаций по данной тематике. Хотя в арсенале врачей имеются многочисленные способы и методы лечения больных острыми риносинуситами, в ряде случаев отмечаются хронизация процесса, развитие внутричерепных и орбитальных осложнений. Данные заболевания часто становятся отправной точкой в развитии острого воспаления или обострения хронической патологии в других органах, прежде всего в респираторном тракте и ухе: отита, бронхита, пневмонии, хронической обструктивной болезни легких (ХОБЛ) или бронхиальной астмы.
По данным эпидемиологических исследований, ОБР в мире ежегодно заболевает до 15% взрослого населения и до 5% детей, число таких пациентов продолжает увеличиваться. Острые бактериальные формы риносинусита составляют до 20–25% всей оториноларингологической патологии. Согласно российским статистическим данным, в нашей стране острое бактериальное воспаление околоносовых синусов переносят около 10 млн человек в год, а распространенность риносинуситов (РС) в Москве составляет около 1,5 тыс. случаев на 100 тыс. взрослого населения [1–7]. Эти данные относительные: количество заболеваний острым синуситом, видимо, на порядок больше.
Этиопатогенез острого РС достаточно хорошо изучен. В подавляющем большинстве случаев бактериальному воспалению в околоносовых синусах предшествует вирусная инфекция. К основным возбудителям таких процессов относятся риновирусы, вирусы гриппа А и В, парагриппа, респираторно-синцитиальный вирус, адено-, корона-, энтеровирусы, вирусы ECHO и Коксаки, некоторые другие [8, 9]. Любой катаральный инфекционный процесс в полости носа обусловливает аналогичные патологические изменения и в околоносовых пазухах, т.е. практически на фоне любой респираторной вирусной инфекции развивается острый негнойный РС. Происходящие на этом фоне инактивация мукоцилиарного клиренса, нарушение аэрации и дренажа синусов, развитие в них гипоксии и застой патологического секрета обеспечивают активацию бактериальной флоры и развитие гнойного воспаления. Предрасполагающими факторами в формировании бактериального РС также являются нарушение архитектоники полости носа – деформация перегородки носа, структурные нарушения в области остиомеатального комплекса, увеличение носовых раковин и ряд других, иммунодефицитные состояния, изменения слизистой оболочки полости носа на фоне хронических заболеваний (муковисцидоз, синдром Картагенера, сахарный диабет и др.) и неблагоприятных внешних воздействий. В настоящее время основные бактериальные возбудители острых РС представлены Streptococcus pneumoniaе, Haemophilus influenzae, Moraxella catarrhalis – соответственно в 40–60%, 25–40% и 2–10% клинических случаев, атипичной флорой (Chlamydia pneumoniae, Mycoplasma pneumoniaе) – у 7–12% пациентов. Реже у больных высеваются Staphylococcus aureus, Streptococcus pyogenes (0–5%), аэробные грамотрицательные микроорганизмы и другие бактерии. В ряде случаев (до 20%) определяются микст-инфекции, в т.ч. бактериально-вирусные ассоциации. У больных ОБР могут выделяться грибы (Aspergillus spp., Phaeohyphomyces spp., зигомицеты), однако их значение в развитии данного заболевания пока остается неясным. Этиологические факторы развития ОБР существенно зависят от анамнестических, географических, социально-экономических и некоторых других условий [10–12].
Диагностика РС основана на клинических проявлениях, данных анамнеза и результатах лабораторных и инструментальных исследований.
К основным симптомам РС относятся нарушение носового дыхания, ринорея и патологическое отделяемое по задней стенке глотки, лицевая боль, чувство тяжести и распирания в области проекции синусов, болезненность при пальпации области околоносовых пазух, нарушение обоняния, головная боль, повышение температуры тела. Возможны кашель, слезотечение, боль в зубах верхней челюсти, слабость, общее недомогание. Различают РС легкого, среднетяжелого и тяжелого течения. Тяжесть РС определяется степенью выраженности основных патологических признаков по 10-балльным визуально-аналоговым шкалам. Выраженность симптома до 3 баллов предполагает легкое течение, от 3 до 7 – средней тяжести и более 7 баллов – тяжелое течение РС.
При оториноларингологическом осмотре, в т.ч. с использованием эндоскопической техники, у больных острым РС визуализируются гиперемия и отек слизистой оболочки полости носа, патологическое отделяемое в верхнем, среднем и общем носовых ходах, в куполе носоглотки и по задней стенке глотки. В тяжелых случаях может отмечаться отек мягких тканей в области проекции синусов, обусловленный перифокальным распространением воспалительного процесса.
Многие используемые ранее инструментальные методы диагностики РС (диафаноскопия, термография, ультразвуковое исследование и ряд других) относятся к методам скринингового обследования и, как правило, требуют уточнения. Лучевые методы диагностики дают достаточно точное представление об анатомических особенностях синусов и наличии в них патологического процесса, однако вопрос о виде воспаления (катаральное или гнойное) остается открытым. Поскольку в подавляющем большинстве случаев острой респираторной вирусной инфекции рентгенологическая картина подтверждает наличие патологического процесса в пазухах, во многих странах рентгенография исключена из перечня рутинных методов диагностики неосложненных РС. При осложненных формах заболевания используется компьютерная томография. В Российской Федерации (РФ) рентгенологическое исследование для диагностики воспалительных процессов в пазухах рекомендовано и проводится в большинстве клинических случаев РС.
Пункция околоносовых пазух при РС выполняется как с диагностической, так и с лечебной целью. Несмотря на то что эксперты во многих странах не используют пункцию синусов в качестве рутинной манипуляции в амбулаторной практике вследствие ее инвазивности, в нашей стране пункционное лечение РС проводится часто [2, 3, 13].
Острые РС являются одной из частых причин назначения системной антибактериальной терапии, однако в ряде случаев выбор такой тактики лечения необоснован. Симптомы гнойного воспаления в пазухах и вирусной инфекции во многом схожи, в связи с чем очень важный этап для практического врача – дифференциальная диагностика вирусного и бактериального характера патологического процесса. До настоящего времени не выявлены патогномоничные клинические признаки и критерии, позволяющие различать ОБР и вирусную инфекцию верхних отделов дыхательных путей, и только тщательная оценка продолжительности, тяжести и характера симптомов острого воспалительного процесса и их сочетание в каждом конкретном клиническом случае обеспечивают рациональную основу диагностического поиска. Достоверным подтверждением бактериального характера процесса в пазухах является высокая плотность бактерий в содержимом околоносовых синусов (>105 КОЕ/мл), полученном при пункции, однако на практике такой способ диагностики практически не используется [13–15].
Согласно европейским и отечественным рекомендациям, заподозрить бактериальную этиологию РС возможно при наличии трех и более признаков из нижеперечисленных:
- бесцветные выделения (больше с одной стороны) и гнойный секрет в полости носа;
- выраженная боль в области лица (больше с одной стороны);
- лихорадка (t>38°C);
- повышение скорости оседания эритроцитов (СОЭ) и/или уровня С-реактивного белка;
- наличие «второй волны» патологического процесса (ухудшение после завершения более легкой фазы заболевания) [16].
Лечение бактериальных инфекцион-но-воспалительных процессов в околоносовых пазухах предполагает использование этиотропных, патогенетических и симптоматических средств. Схема лечения включает лекарственные средства различных фармакологических групп – антибиотики, деконгестанты, интраназальные кортикостероиды, мукоактивные препараты, антигистаминные средства, системную противовоспалительную и фитотерапию, а также ирригационное лечение, физиотерапевтические методы и различные способы активного дренирования околоносовых пазух.
Одним из основных направлений лечения ОБР остается адекватная рациональная этиотропная терапия, целью которой является эрадикация возбудителя и восстановление стерильности пазухи, и как следствие – уменьшение симптоматики и продолжительности заболевания, предотвращение хронизации процесса и развития осложнений, снижение риска распространения резистентных штаммов микроорганизмов в человеческой популяции [2, 3, 17, 18].
Избыточное применение антибиотиков – одна из значимых проблем в терапии острых воспалительных процессов в околоносовых пазухах. Решение вопроса о целесообразности системной антибиотикотерапии предполагает использование точных и валидированных клинических критериев для установления диагноза ОБР, тактики «ожидание и наблюдение», определение соотношения пользы и риска назначаемого лечения, выделение ситуаций, когда назначение антибиотиков может быть противопоказано. Наиболее оптимален выбор антибиотика в каждом клиническом случае по результатам микробиологического исследования, но необходимость достаточно длительного времени для получения информации не позволяет использовать данное правило в клинике. На практике в большинстве случаев антимикробные препараты назначаются пациентам эмпирически с учетом эпидемиологической ситуации, особенностей клинической картины и тяжести заболевания. На выбор антибиотика также влияет ряд анамнестических данных: переносимость лекарственных средств, возраст больного, наличие сопутствующих заболеваний, сведения о возможном приеме антибиотиков в предшествующие 4–6 недель. К важным моментам относятся и свойства самого препарата: высокая активность в отношении большинства наиболее вероятных возбудителей данной патологии, эффективность, доказанная в контролируемых клинических исследованиях, способность проникать и накапливаться в очаге воспаления, низкая токсичность, небольшие частота и спектр побочных эффектов, простота и удобство приема. При выборе антибиотика необходимо учитывать все вышеперечисленное. На современном этапе недопустимо назначение лекарственных средств, в т.ч. и антибиотиков, исходя из личного опыта и субъективного мнения медицинских работников. Стандарты выбора препаратов основываются на результатах многочисленных клинических исследований, достоверных с позиций доказательной медицины. Оценка эффективности проводимого лечения осуществляется через 72 часа или в более ранние сроки при нарастании клинической симптоматики и риске развития осложнений. Ухудшение состояния на фоне лечения или отсутствие эффекта через трое суток от начала приема лекарственного средства являются показанием к коррекции антибактериальной терапии [3–5, 13, 16].
Важные проблемы антибактериальной терапии на современном этапе:
- эмпирический подход (патогены редко идентифицируются, тесты занимают много времени);
- резистентность микрофлоры;
- подбор дозы и длительность терапии;
- восприимчивость пациента к проводимому лечению (зависит от пути введения, кратности назначения, переносимости).
Сложности в выборе препарата представляют увеличение числа пациентов с хроническими заболеваниями, нарушением иммунного статуса, огромное и непрерывно растущее число генерических лекарственных препаратов антимикробного действия.
Формирование с течением времени устойчивости к воздействию многих лекарственных веществ – естественное свойство микроорганизмов. Однако нерациональное использование антибактериальных препаратов способствует значительному ускорению роста резистентности возбудителей к используемым препаратам – высокоэффективные ранее лекарственные средства перестают работать. Феномен бактериальной устойчивости представляет большую проблему в терапии инфекционных заболеваний населения и создает реальную угрозу здравоохранению во всем мире.
Рациональное использование антибиотиков предполагает применение препаратов, обеспечивающих эрадикацию микроорганизмов (оказывающих бактерицидное действие), ограничение применения антибиотиков, к которым имеется высокий уровень резистентности или резистентность быстро нарастает, разумное использование свойств существующих лекарственных антимикробных средств.
В качестве этиотропного лечения бактериальных РС эмпирически используются β-лактамы (пенициллины и цефалоспорины), макролиды и фторхинолоны. Препаратом выбора до настоящего времени остаются амоксициллин и амоксициллин/клавуланат. В регионах с частотой резистентности S. pneumoniae к пенициллину менее 10% больных, не получавших антибиотики в предыдущие 6 недель, целесообразно использовать амоксициллин. При высоком риске β-лактамазопродуцирующих штаммов возбудителя назначается амоксициллин/клавуланат. Эффективными в отношении наиболее вероятных бактериальных возбудителей острого РС являются цефалоспорины II и III поколений. Альтернативой β-лактамам в случае их непереносимости при остром РС служат макролиды, однако быстрый рост резистентности пневмококков и низкая природная активность в отношении H. Influenzae обусловливают ограничения эмпирического использования данной группы препаратов пациентами с вышеуказанной патологией. Как альтернативные препараты в лечении бактериальных РС также могут быть использованы респираторные «антипневмококковые» фторхинолоны (левофлоксацин, моксифлоксацин, гемифлоксацин). В связи с превышением 20%-ного порога резистентности основных возбудителей острого РС в качестве эмпирической терапии не рекомендуется рассматривать тетрациклины и ко-тримоксазол [2, 3, 5, 13, 19, 20].
В 2002 г. группой экспертов была предложена схема эмпирической антибактериальной терапии РС, сохраняющая свою актуальность и в настоящее время (см. таблицу) [5, 13].
К сожалению, за последнее время значительно уменьшилось количество появляющихся в клинической практике новых антибактериальных средств. В связи с этим на фоне роста числа антибиотикорезистентных штаммов возбудителей большой интерес представляют антимикробные препараты, разработанные ранее, но до недавнего времени в клинике широко не использовавшиеся. В данном аспекте внимания врачей многих специальностей, в т.ч. и оториноларингологов, заслуживает пероральный цефалоспорин III поколения цефдиторен.
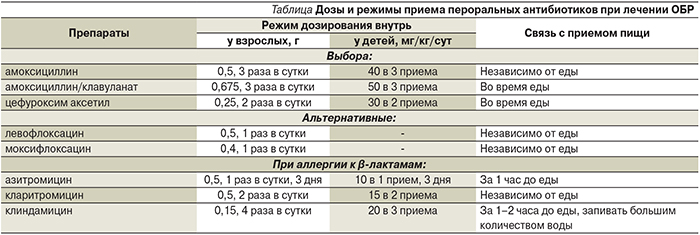
Цефдиторен, будучи β-лактамным антибиотиком, оказывает на чувствительные к нему микроорганизмы бактерицидный эффект за счет нарушения синтеза пептидогликана клеточной стенки и индукции лизиса микробной клетки в результате потери липотейхоевых кислот клеточной стенки [21, 22]. Цефдиторен в отличие от других пероральных цефалоспоринов высокоактивен в отношении основных бактериальных возбудителей острых внебольничных РС – S. pneumoniae, H. influenzae, M. сatarrhalis, а также S. pyogenes, S. aureus (кроме метициллинрезистентных штаммов) и представителей семейства Enterobacteriaceae. Антимикробная и терапевтическая эффективность цефдиторена подтверждены рядом рандомизированных клинических исследований (рис. 1–4).При анализе микробиологической активности цефдиторена в отношении пневмококков в России выявлено, что данный препарат является одним из наиболее высокоактивных среди основных антимикробных средств в терапии инфекций респираторного тракта.
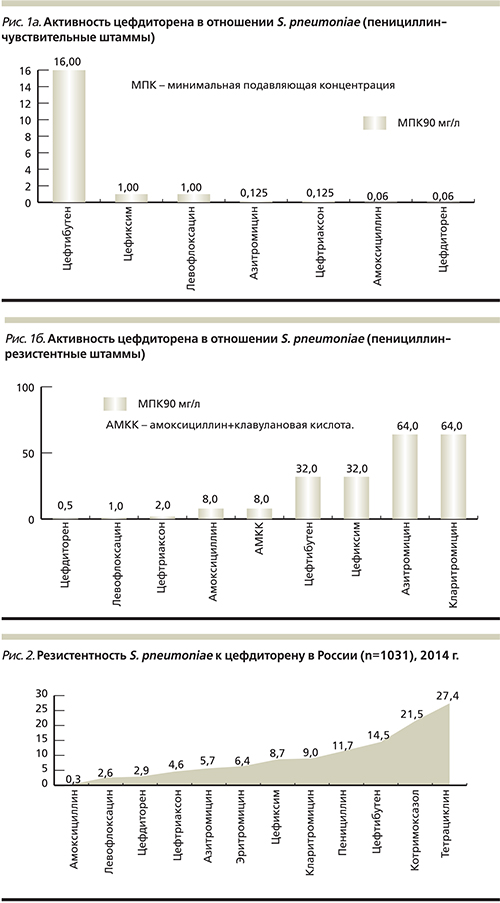
Установлено, что цефдиторен обладает наибольшей активностью в отношении пневмококков по сравнению с другими пероральными цефалоспоринами – к данному препарату были чувствительными 97,1% штаммов. Российские авторы не определяли активность в отношении пеницилинорезистентных штаммов пневмококка, однако в зарубежных исследованиях обнаружено, что цефдиторен значимо превосходит все антибиотики, рекомендуемые к терапии инфекций респираторного тракта, в отношении пенициллинорезистентных штаммов пневмококков. В России цефдиторен разделил второе место с левофлоксацином по количеству нечувствительных штаммов S. pneumoniae и обошел цефтриаксон, частота резистентности к которому в нашей стране встречается среди пневмококков в полтора раза чаще. В Италии цефдиторен применяется c 2008 г., однако, несмотря на это, в ходе исследования более 900 штаммов пневмококка не было обнаружено ни одного устойчивого к препарату. Результаты исследований также показывают, что активность цефдиторена была сравнимой с активностью парентерального цефалоспорина III поколения – цефтриаксона (95,4%) и респираторного фторхинолона – левофлоксацина (97,4%), продолжительное время являвшихся основой терапии среднетяжелых и тяжелых пневмококковых инфекций [21–26].
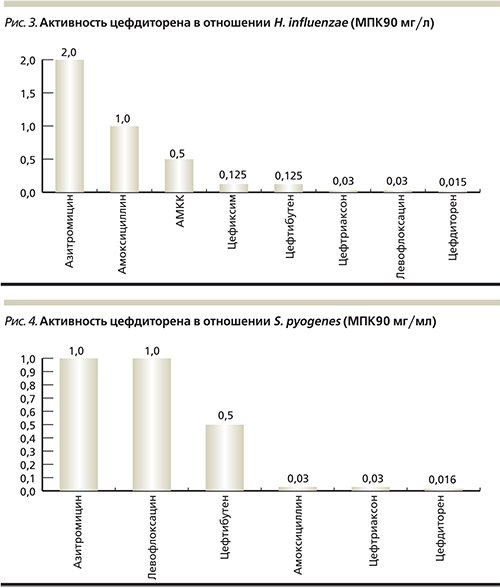
В отношении гемофильной палочки, являющейся вторым по значимости возбудителем в этиологии респираторных заболеваний, цефдиторен обладает высокой природной активностью. Продукция β-лактамаз, характерная для гемофильной палочки, не влияет на активность цефдиторена ввиду его природной устойчивости. Цефдиторен также наиболее активен в отношении штаммов с мутацией генов, проявлявших устойчивость в отношении ампициллина [21].
Бета-гемолитический стрептококк является преимущественным возбудителем острого тонзиллита и при острых РС выявляется достаточно редко. Несмотря на то, что в отечественной литературе встречалась информация о резистентности пиогенного стрептококка к пенициллину, эти данные зачастую объясняются лабораторной ошибкой, и нигде в мире, и в России в частности, не выделено штаммов БГСА (β-гемолитический стрептококк группы А), устойчивого к пенициллинам или цефалоспоринам. Тревогу вызывает рост резистентности к макролидам, МПК которых превышает МПК цефдиторена в 10 раз, в то время как в практике цефалоспорины не рассматриваются как препараты выбора и при неэффективности первичной терапии клиницисты сразу переходят на макролиды, пропуская высокоэффективный класс цефалоспоринов [21].
При изучении влияния цефдиторена и амоксициллина/клавуланата на S. pneumoniae и H. influenzae в составе биопленки было обнаружено, что цефдиторен вызывает статистически значимо большее снижение оптической плотности биопленки обоих микроорганизмов по сравнению как с контролем, так и с амоксициллином/клавуланатом. Амоксициллин/клавуланат проявил значимую по сравнению с контролем активность в отношении S. pneumoniae, но не в отношении H. influenzae (p=0,003 и 0,08 соответственно) [27].
Для антибиотика недостаточно иметь только низкие показатели МПК. Важно создание в месте локализации инфекции концентрации препарата, значимо превышающей МПК. Цефдиторен достаточно быстро уходит из крови и создает стабильные высокие концентрации в тканях и жидкостях респираторного тракта, в десятки раз превосходящие МПК в отношении пневмококка. Это позволяет не просто снять клинические симптомы, а добиться эрадикации возбудителя [26, 28–30].
В России было проведено сравнение свойств различных пероральных цефалоспоринов III поколения. Так как эффективность антибиотиков в основном зависит от микробиологической активности и способности препарата проникать в место локализации процесса, сравнение проводилось по трем показателям: МПК в отношении пневмококка и гемофильной палочки, резистентность штаммов пневмококка, выделенных в России, и проникновение препаратов в ткани респираторного тракта. При сравнении активности цефиксима и цефдиторена в отношении основных возбудителей респираторных инфекций цефдиторен в 16 раз активнее цефиксима в отношении S. pneumoniae и в 8 раз активнее в отношении H. influenzae. Резистентность S. pneumoniae к цефдиторену в России встречается в 3 раза реже, чем к цефиксиму. При анализе фармакокинетики цефдиторена и цефиксима препараты создают сравнимую концентрацию в плазме крови (4,1 и 4,9 мкг/мл соответственно), но проникновение цефдиторена в слизистую оболочку бронхов составило 60% по сравнению с 38% у цефиксима, создающего основную концентрацию в моче и желчи. В отношении пневмококка цефдиторен активнее цефтибутена в 266 раз, в отношении гемофильной палочки ситуация аналогична предыдущему препарату – цефдиторен активнее цефтибутена в 8 раз в отношении гемофильной палочки. Возможно, столь невысокая активность цефтибутена в отношении пневмококка привела к селекции резистентных и умеренно резистентных штаммов, число которых достигает 14,5%, что в пять раз больше, чем штаммов, резистентных к цефдиторену [21].
В обобщенном анализе 2 многоцентровых двойных слепых исследований пациентов старше 12 лет (средний возраст – 27,8 года) с острым тонзиллофарингитом цефдиторен показал сравнимую с пенициллином клиническую эффективность при статистически значимо более высокой микробиологической эффективности [31]. Высокая эффективность цефдиторена в терапии острого РС у взрослых была подтверждена в трех клинических исследованиях, число пациентов в которых превысило 1819. Результаты проведенных исследований эффективности цефдиторена в терапии РС у детей от года до 15 лет в странах, где препарат зарегистрирован и в педиатрической практике, также показали хорошую эффективность [32, 33].
Цефдиторен является пролекарством, т.е. для начала действия ему необходимо пройти ряд химических реакций и перейти в активную форму. Но в отличие от многих пролекарств данный препарат активизируется не в печени с участием ее ферментов, а непосредственно в стенке кишечника при прохождении через нее. Выделяется цефдиторен в неизмененном виде преимущественно с мочой.
В связи с отсутствием печеночного метаболизма цефдиторен не имеет значимых лекарственных взаимодействий. Однако необходимо отметить, что препараты, повышающие pH желудочного сока, снижают его биодоступность, а пробенецид, применяемый при подагре, изменяет выведение всех препаратов путем почечной экскреции, в т.ч. и цефдиторена.
У лиц с печеночной недостаточностью легкой и средней степени тяжести изменений фармакокинетики цефдиторена не будет, при тяжелой печеночной недостаточности кинетика препарата не изучалась. При почечной недостаточности возможно применении цефдиторена при любой степени нарушения, за исключением пациентов на гемодиализе, т.к. нет установленных доз препарата для этих пациентов. Известно, что при 4-часовом сеансе диализа выводится 30% данного антибиотика.
Цефтидорен имеет высокий профиль безопасности, продемонстрированный результатами более десяти клинических исследований, в которых наблюдались в общей сложности около 6000 пациентов с внебольничными инфекциями. В подавляющем большинстве случаев нежелательные лекарственные реакции (НЛР) были легкой или средней степени тяжести и разрешались самостоятельно, частота отмены препарата в связи с развитием НЛР составила всего 2,6%. Летальных исходов и постоянной утраты каких-либо функций организма зафиксировано не было. Наиболее часто на фоне использования цефдиторена отмечались диарея (9,9%), вагиноз (3,9%), тошнота (3,5%), боль в животе (1,8%) и диспепсия (1,1%) [21, 34]. В сравнительном исследовании терапии неосложненного ОБР у 142 детей в возрасте от года до 15 лет при сравнимой эффективности частота развития побочных эффектов со стороны желудочно-кишечного тракта была значимо выше в группе пациентов, получавших амоксициллин/клавуланат. Так, о диарее при применении последнего сообщали в 4 раза, о тошноте – в 5,5, а о рвоте – в 4,6 раза чаще [33]. Значимое преимущество цефдиторена по безопасности по сравнению с кларитромицином было обнаружено в ходе сравнительного исследования эффективности этих препаратов при обострении ХОБЛ. Общая частота развития побочных эффектов у пациентов, получавших кларитромицин, была на 10% выше, чем у лиц, получавших цефдиторен. В группе пациентов, получавших кларитромицин, достоверно чаще отмечали изменение вкуса и тошноту [35].
Цефдиторен в январе 2012 г. одобрен в РФ для терапии острого РС, стрептококкового фарингита/тонзиллита, инфекционного обострения хронической обструктивной болезни легких, внебольничной пневмонии, а также инфекций кожи и мягких тканей у взрослых и детей старше 12 лет. В РФ цефдиторен применяется под названием Спектрацеф, производитель препарата – компания Tedec Meiji Pharma S.A. (Испания). При патологии ЛОР-органов препарат назначается по 200 мг 2 раза в сутки, продолжительность курса лечения составляет 10 дней. Цефдиторен может применяться не только для стартовой пероральной терапии острых внебольничных инфекций респираторного тракта в амбулаторных условиях, но и при ступенчатой терапии данных инфекционных процессов у больных в стационарах, являясь единственным адекватным пероральным β-лактамом для перехода с терапии парентеральными цефалоспоринами III поколения [21–25].
Высокая эффективность и хороший профиль безопасности Спектрацефа позволяют рекомендовать данное лекарственное средство для широкого использования в терапии острых бактериальных инфекций верхних отделов дыхательных путей, в т.ч. РС.



