Дисциркуляторная энцефалопатия (ДЭП) – хроническая прогрессирующая форма цереброваскулярной патологии, характеризующаяся развитием многоочагового или диффузного ишемического поражения головного мозга. В отличие от инсульта, являющегося формой острой цереброваскулярной патологии, при которой обычно происходит фокальное поражение мозга, ДЭП характеризуется двумя основными особенностями: более постепенным развитием (часто с длительным периодом клинически «скрытого» течения) и мультифокальностью поражения мозга.
Термин «дисциркуляторная энцефалопатия» был предложен Г.А. Максудовым и В.М. Коганом почти 60 лет назад и до сих пор вызывает дискуссии [2, 16]. Тем не менее концепция ДЭП остается эвристически привлекательной до настоящего времени, хотя представления об этом состоянии, его диагностике и лечении эволюционируют по мере развития знаний о цереброваскулярной патологии [2, 18, 19].
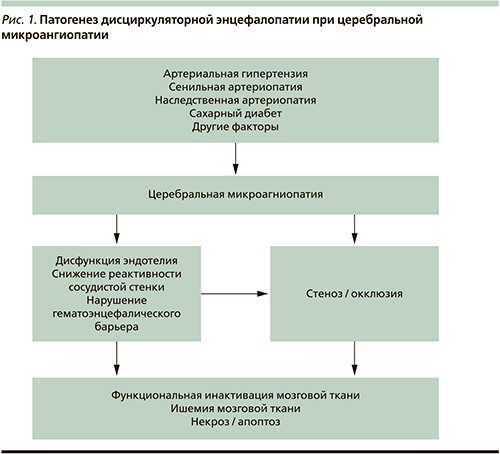
В отличие от острых нарушений мозгового кровообращения большинство случаев ДЭП связано не с патологией крупных экстракраниальных артерий или их основных интракраниальных ветвей, а с поражением мелких мозговых артерий (церебральной микроангиопатией), от которых в первую очередь зависит кровоснабжение глубинных отделов мозга (пенетрирующих артерий) [9, 12, 17]. Основным этиологическим фактором церебральной микроангиопатии является артериальная гипертензия, вызывающая артериосклероз (липогиалиноз) мелких пенетрирующих артерий и артериол (гипертоническую артериопатию). У больных, не страдающих артериальной гипертензией, поражение мелких артерий может быть связано с сенильным артериосклерозом, амилоидной ангиопатией, наследственными и воспалительными ангиопатиями или другими причинами [9, 19, 34].
Распространенное поражение мелких артерий у больных ДЭП сопровождается широким спектром изменений, наиболее важные из которых: 1) диффузное поражение белого вещества, в патогенезе которого существенную роль играет нарушение целостности гематоэнцефалического барьера; 2) множественные лакунарные инфаркты в глубинных отделах мозга; 3) микроинфаркты; 4) микрокровоизлияния; 5) атрофия коры больших полушарий и гиппокампа [2, 27, 34, 36]. Наличие, степень, профиль нейропсихологических нарушений лишь частично коррелируют с типом, выраженностью и локализацией сосудистых изменений по данным компьютерной и магнитно-резонансной томографии. Как и при рассеянном склерозе, тяжесть когнитивных нарушений при ДЭП лучше коррелирует со степенью церебральной атрофии [26, 34, 36, 38]. Основные звенья патогенеза ДЭП отражены на рис. 1.
Ключевым проявлением ДЭП, которое во многом определяет тяжесть состояния больных, являются когнитивные нарушения. Они могут служить важнейшим диагностическим критерием ДЭП и считаются, возможно, наилучшим маркером для оценки динамики заболевания. Коррекция когнитивных нарушений у больных ДЭП часто имеет решающее значение для улучшения качества жизни пациента и его родственников [13]. Когнитивный дефицит по мере прогрессирования ДЭП эволюционирует, что сопровождается качественным изменением его профиля [8, 9, 20]. На ранней стадии ДЭП преобладают умеренные нейродинамические нарушения в виде замедленности, аспонтанности, снижения работоспособности, истощаемости, ослабления концентрации внимания [3, 4, 7]. Тем не менее такие пациенты в целом хорошо справляются с тестами, не предусматривающими учета времени выполнения. Это соответствует легкой степени когнитивных нарушений. При следующей градации тяжести когнитивных нарушений (умеренных когнитивных нарушениях) наряду с нейродинамическими нарушениями развиваются и регуляторные расстройства (подкорково-лобный когнитивный синдром). В основе регуляторного дефекта лежат нарушения инициации, планирования, поэтапной реализации ментальных действий, вытормаживания неадекватных реакций, когнитивной гибкости (способность к переключению) и контроля за достижением запланированного результата [4, 7].
У пациентов с регуляторным дефицитом нарушается выполнение даже тех нейропсихологических тестов, в которых не вводилось ограничение времени.
Нарушение памяти, как правило, бывает умеренным и носит вторичный характер (об этом свидетельствует дефицит свободного воспроизведения при относительно сохранном узнавании и эффективности опосредующих приемов). Эта особенность может служить частным случаем характерной для этой категории больных способности к компенсации когнитивного дефекта [9]. Другой пример того же рода – существенное улучшение выполнения нейропсихологических тестов (особенно на логическую память или абстрактное мышление) даже при небольших подсказках. Тем не менее указанный когнитивный дефицит может способствовать снижению качества жизни больных [13]. В основе развития данного типа когнитивного дефицита лежит нарушение функции фронтостриарных кругов. Когнитивный дефицит данного типа нередко сопровождается депрессией (сосудистой), в основе которой также может лежать разобщение подкорковых образований, лимбических структур и лобной коры [40].
Дальнейшее прогрессирование когнитивного дефекта при ДЭП сопряжено с развитием деменции [2, 19, 38]. Для деменции наряду с выраженными нейродинамическими и регуляторными нарушениями, которые остаются ядром когнитивного дефицита, отмечаются также операциональные нарушения, проявляющиеся в тестах на память, речь, праксис, мышление.
В отличие от больных с умеренной выраженностью когнитивного дефицита предоставление пациенту подсказок или алгоритма действий значительно в меньшей степени улучшает выполнение нейропсихологических тестов. Таким образом, если на более ранних стадиях заболевания доминируют проявления дисфункции подкорково-лобных систем, то по мере прогрессирования ДЭП происходит своего рода «кортикализация» когнитивного дефекта, в основе которой может лежать дальнейшее распространение патологического процесса, например, за счет развития корковых микроинфарктов, вторичной церебральной атрофии либо присоединения альцгеймеровских изменений, например отложения амилоида [8, 11, 14, 15].
К особенностям церебральных сосудов относится тесное взаимодействие с нейронами, которое во многом опосредовано глиальными клетками, прежде всего астроцитами. Нейроны, астроциты и сосудистые клетки (эндотелиоциты, гладкомышечные клетки, перициты) функционально тесно связаны между собой и формируют особые «нейроваскулярные единицы» [25]. Благодаря сопряжению их активности реализуется феномен функциональной гиперемии: увеличение перфузии активированного участка мозга. Этот процесс опосредован рядом вазоактивных ионов (прежде всего калия и кальция), метаболическими факторами (прежде всего оксидом углерода, гипоксией, лактатом, аденозином и особенно оксидом азота), некоторыми нейромедиаторами (глутаматом, дофамином, ацетилхолином) [25].
По данным нескольких исследований, функционирование нейроваскулярных единиц как единого целого нарушается при инсульте и болезни Альцгеймера [22]. Накапливаются данные, свидетельствующие о нарушении деятельности нейроваскулярных единиц уже на ранней стадии ДЭП, что сопровождается функциональным разобщением их основных элементов. Одним из важнейших факторов этого может служить эндотелиальная дисфункция на уровне мелких сосудов, вызывающая снижение их реактивности и, соответственно, дефицит перфузии активных участков мозга [15]. Показано, что артериальная гипертензия, являющаяся одним из основных факторов развития ДЭП, не только изменяет структуру церебральных сосудов, вызывая гипертрофию и ремоделирование сосудистой стенки, способствует развитию атеросклероза крупных сосудов и липогиалиноза мелких сосудов, но и может блокировать феномен функциональной гиперемии [25, 30]. Это, например, может выражаться в том, что при выполнении когнитивных тестов наблюдается менее значительный прирост перфузии в теменной коре и таламусе, что коррелирует с ухудшением их результатов. При этом снижение мозгового кровотока в покое менее постоянно [30].
Именно нарушение функционирования нейроваскулярных единиц и снижение реактивности мелких сосудов могут предопределять малую эффективность традиционных вазоактивных средств при ДЭП и требовать поиска альтернативных подходов к лечению этого состояния.
В ряде исследований отмечено, что в основе когнитивной дисфункции, а частично – и аффективных нарушений при цереброваскулярной патологии может лежать дисфункция различных нейромедиаторных систем: холинергической, дофаминергической, норадренергической. По данным патоморфологического исследования, при ДЭП может происходить холинергическая денервация префронтальной коры за счет прерывания связей с базальным ядром Мейнерта, следующих в перивентрикулярной зоне. При сосудистой деменции снижается также захват 18F-флуородопы и численность зон пресинаптического захвата дофамина в хвостатом ядре, при том что численность D2-рецепторов существенно не меняется [22]. Со снижением активности дофаминергических систем мозга особенно тесно связаны снижение активности, концентрации внимания и другие проявления лобной дисфункции, сопровождающиеся вторичным расстройством памяти. Эти данные открывают путь к поиску эффективной терапии когнитивных и аффективных нарушений при ДЭП [28].
Лечение ДЭП должно проводиться комплексно и включать меры по предупреждению дальнейшего повреждения мозговых сосудов и вещества мозга, улучшению и долгосрочной стабилизации когнитивных функций, коррекции других клинических проявлений заболевания. Наиболее эффективной мерой по предупреждению дальнейшего прогрессирования заболевания, особенно на раннем этапе его развития, является воздействие на сосудистые факторы риска, прежде всего правильная гипотензивная терапия. В ряде исследований показано, что гипотензивная терапия может замедлять развитие когнитивного дефицита. При проведении гипотензивной терапии важно избегать эпизодов чрезмерного снижения артериального давления, особенно пожилым больным с обширным поражением белого вещества или двусторонними стенозами магистральных артерий головы [1, 4, 19, 34, 37].
Коррекция гиперлипидемии позволяет замедлять развитие атеросклеротического стеноза крупных мозговых артерий, снижает вязкость крови (что особенно важно при диффузном поражении мелких мозговых артерий), предупреждает прогрессирование ишемической болезни сердца и, возможно, улучшает функцию эндотелия, препятствует воспалительным изменениям и отложению амилоида в веществе мозга. Важное значение имеют также адекватная коррекция сахарного диабета, метаболического синдрома, поддержание физической активности [34, 47].
У пациентов, перенесших инсульт или транзиторную ишемическую атаку, а также имеющих выраженный атеросклеротический стеноз магистральных артерий головы или сосудистые очаги при компьютерной или магнитно-резонансной томографии, целесообразен длительный прием антиагрегантов (например, аспирина в дозе 50–100 мг один раз в день). При наличии обширного лейкоареоза и микрогеморрагий на магнитно-резонансной томографии применение высоких доз антиагрегантов и антикоагулянтов связано с высоким риском кровоизлияний. Вместе с тем необходимо отметить отсутствие доказательств способности антиагрегантов сдерживать нарастание когнитивных нарушений [9]. У больных выраженным стенозом сонных артерий и умеренным когнитивным расстройством улучшению нейропсихологического статуса может способствовать каротидная эндартерэктомия, но следует соблюдать осторожность при проведении оперативного вмешательства лицам с уже развившейся деменцией [10].
При высоком уровне гомоцистеина показано назначение фолиевой кислоты (2–3 мг/сут), витаминов В6 (20–30 мг/сут) и В12 (200 мкг/сут), однако до сих пор в контролируемых исследованиях не удалось доказать способность этой меры предупреждать новые цереброваскулярные эпизоды или прогрессирование когнитивного дефицита. Необходима адекватная коррекция сопутствующей соматической патологии, в частности сердечной и дыхательной недостаточности, гипотиреоза и т.д. Важное значение имеет коррекция аффективных нарушений, в первую очередь депрессии, оказывающей негативное влияние на субъективное состояние пациентов и качество жизни, а также усугубляющей когнитивный дефицит и служащей одним из предикторов развития деменции. Препаратом выбора при лечении сосудистой депрессии служат селективные ингибиторы обратного захвата серотонина или селективные ингибиторы обратного захвата серотонина и норадреналина, при этом следует учитывать относительную резистентность сосудистой деменции к антидепрессантам и возможность некоторых препаратов группы селективных ингибиторов обратного захвата серотонина и норадреналина повышать артериальное давление.
В качестве одной из наиболее перспективных мишеней для терапевтического воздействия при ДЭП можно рассматривать нейроваскулярную единицу. На настоящий момент показано, что статины, ингибиторы АПФ, например периндоприл, и блокаторы ангиотензиновых рецепторов, а также некоторые холиномиметики (в частности, галантамин) способны повышать реактивность мелких сосудов и улучшать перфузию мозга, однако имеет ли этот эффект клиническое значение, остается неясным [14, 23, 30, 41]. Антиоксиданты, которые блокируют действие свободных радикалов, образуемых вследствие ишемии, потенциально также могут увеличивать функциональную гиперемию, способствуя сопряжению нейронов и сосудов [30]. Улучшение кровообращения в системе мелких мозговых сосудов может быть обеспечено также мерами, направленными на уменьшение вязкости крови и улучшение венозного оттока.
Непосредственно для улучшения когнитивных функций в клинической практике применяют массу препаратов с различным механизмом действия. Одним из первых препаратов, который стал применяться для улучшения когнитивных функций, стал пирацетам – подобные средства часто называют ноотропами. Ноотропные препараты можно условно разделить на четыре основные группы [15]: 1) препараты, воздействующие на определенные нейротрансмиттерные системы; 2) препараты с нейротрофическим действием, 3); препараты с нейрометаболическим действием; 4) препараты с вазоактивным действием.

1. Средства, воздействующие на специфические нейромедиаторные системы. К данной группе принадлежат препараты, действующие на четко определенные нейрохимические системы в мозге. Эффективность препаратов, относящихся именно к этой группе, в последнее десятилетие наиболее убедительно доказана в контролируемых исследованиях больных с различной степенью тяжести когнитивных нарушений. Улучшение когнитивных функций возможно при применении средств, усиливающих активность холинергических, норадренергических, дофаминергических, серотонинергических систем, а также средств, блокирующих глутаматные рецепторы.
Из холиномиметических средств наиболее эффективны ингибиторы холинэстеразы (галантамин, ривастигмин, донепезил). Эффективность ингибиторов холинэстеразы показана при наиболее частых нозологических формах деменции – болезни Альцгеймера, деменции с тельцами Леви, болезни Паркинсона с деменцией. Тем не менее больным сосудистой деменцией, несмотря на уменьшение когнитивного дефицита, особенно регуляторного характера, применение ингибиторов холинэстеразы в среднем не позволяет добиваться существенного улучшения повседневной активности – за исключением случаев смешанной деменции, когда к сосудистому процессу присоединяется альцгеймеровская дегенерация [15].
При сосудистой деменции в крупных плацебо-контролируемых исследованиях продемонстрирован также положительный эффект мемантина, являющегося неконкурентным антагонистом глутаматных рецепторов NMDA (N-метил-D-аспартат). Но, как и в случае с ингибиторами холинэстеразы, при применении мемантина не удается добиваться значительного улучшения повседневной активности, которая в отличие от ситуации при болезни Альцгеймера зависит не только от когнитивного дефекта, но и от двигательных, а также иных расстройств.
При сосудистой деменции возможно также применение предшественников ацетилхолина (например, холина альфосцерат), которые данной категории больных наиболее целесообразно применять в комбинации с ингибиторами холинэстеразы и/или мемантином [14]. Эти средства могут быть эффективными и при умеренном когнитивном расстройстве сосудистого генеза.
Предшественники ацетилхолина, в частности холина альфосцерат (Церетон), объединяют черты препаратов с нейромедиаторным (холинергическим) и нейрометаболическим действиями. Именно препараты этой группы исторически были первыми холиномиметическими средствами, которые стали применяться при когнитивных нарушениях. Тем не менее клинические испытания предшественников ацетилхолина первого поколения – холина и фосфатидилхолина (лецитина) – оказались безуспешными (как в виде монотерапии, так и в комбинации с ингибитором холинэстеразы). Их неэффективность, возможно, объяснялась тем, что они способствовали повышению содержания ацетилхолина в мозге, но не стимулировали его высвобождение, а также плохо проникали через гема-тоэнцефалический барьер.
Препараты второго поколения (в т.ч. холина альфосцерат и цитиколин) лишены этого недостатка. Попадая в организм, холина альфосцерат расщепляется на холин и глицерофосфат. Благодаря быстрому повышению концентрации в плазме и электрической нейтральности холин, освобождаемый при распаде холина альфосцерата, проникает через гематоэнцефалический барьер и участвует в биосинтезе ацетилхолина в мозге. В результате происходит усиление холинергической активности за счет как увеличения синтеза ацетилхолина, так и его высвобождения. Холиномиметическая активность холина альфосцерата у человека подтверждена его стимулирующим влиянием на секрецию гормона роста. Кроме того, согласно экспериментальным данным, холина альфосцерат усиливает высвобождение ацетилхолина в гиппокампе крыс, улучшает память, нарушенную введением скополамина, восстанавливает маркеры холинергической передачи у старых крыс, оказывает нейропротекторное действие, улучшая выживаемость тканей [1].
Последнее может объясняться действием освободившегося при распаде холина альфосцерата глицерофосфата, способного активизировать синтез фосфолипидов мембраны нейронов и тем самым повышать пластичность мембран и поддерживать функцию рецепторного аппарата. Наряду с препаратами некоторых других групп (серотонинергическими антидепрессантами, малыми дозами леводопы) холина альфосцерат способен стимулировать активность прогениторных клеток в гиппокампе и субвентрикулярной зоне и процессы неонейрогенеза.
За последнее десятилетие в зарубежных исследованиях показана эффективность ряда препаратов, усиливающих дофаминергическую и норадренергическую передачу, при нарушениях внимания и регуляторных функций, постинсультной афазии, посттравма-тических когнитивных нарушениях [15].
2. Средства нейрометаболического действия. Данная группа включает большое число средств, первично воздействующих на те или иные аспекты метаболизм нейронов. Наиболее изученным препаратом данной группы является пирацетам, который, согласно экспериментальным данным, не только стимулирует обменные процессы в головном мозге, способствуя утилизации глюкозы и повышая устойчивость мозговой ткани к гипоксии, но и усиливает глутаматергическую и холинергическую передачу.
В контролируемых исследованиях препарат оказывал умеренное действие на когнитивные нарушения различной этиологии, уменьшал выраженность постинсультной афазии, однако в длительном одногодичном исследовании больных с умеренным когнитивным расстройством положительный эффект препарата продемонстрировать не удалось [15].
Стандартизированный экстракт из листьев растения Гинкго двулопастного (Ginkgo biloba), согласно нескольким контролируемым исследованиям, вызывает умеренное улучшение когнитивных функций у больных с легкой степенью болезни Альцгеймера и сосудистой деменции. В некоторых исследованиях показан благоприятный эффект препарата Ginkgo biloba и на больных с преддементной стадией когнитивных нарушений. Наиболее крупное на сегодняшний день многоцентровое плацебо-контролируемое исследование способности Ginkgo biloba предупреждать развитие деменции у пожилых лиц, проведенное в США и включившее более 3000 лиц старше 75 лет, соответствующих возрастной норме, и около 500 лиц с умеренным когнитивным расстройством, показало, что длительный прием экстракта Ginkgo biloba не приводит к снижению риска деменции и болезни Альцгеймера. Тем не менее снижение риска сосудистой деменции, особенно для лиц с исходной возрастной нормой, оказалось близким к уровню достоверности [29]. Согласно экспериментальным данным, компоненты экстракта Ginkgo biloba оказывают антиоксидантный, вазодилататорный, антиагрегантный эффекты, стабилизируют состояние митохондрий, защищают нейроны от ишемии, снижают вязкость крови, тормозят формирование бета-амилоида, усиливают активность холинергической системы [29].
В целом эффективность препарата нуждается в дополнительном исследовании. Наиболее целесообразно применять данный препарат со средствами, воздействующими на нейромедиаторные системы, в частности холинергическую.
В качестве антиоксиданта возможно также применение этилметилгидроксипиридина сукцината (ЭМПС) Нейрокс, основным механизмом которого является стимуляция супероксиддисмутазы и обезвреживание супероксидного радикала. Нейропротективное действие антиоксидантов показано в основном в исследованиях, проводимых in vitro, и редко подтверждается в клинических исследованиях, но в случае ЭМПС были получены положительные результаты в ряде клинических испытаний. Так, было показано, что Нейрокс может быть эффективным в лечении острого периода ишемического инсульта, при котором выявляются признаки истощения антиоксидантной системы. Было показано, что на фоне лечения отмечается более быстрое восстановление функционального статуса [1].
Терапевтический потенциал ЭМГПС (Нейрокса) позволяет надеяться на способность препарата улучшать когнитивные и аффективные функции, благоприятно влиять на обмен липидов и процесс атерогенеза.
3. Средства нейротрофического действия включают пептидергические препараты, получаемые путем гидролиза головного мозга животных и содержащие комплекс низкомолекулярных пептидов, которые, согласно экспериментальным данным, оказывают тканеспецифическое действие на клетки головного мозга и способны стимулировать репаративные процессы в нервной системе. В контролируемых исследованиях показан умеренный положительный эффект таких препаратов на когнитивные функции пациентов с болезнью Альцгеймера и сосудистой деменцией, который сохраняется не менее 3–4 месяцев.
4. Средства с вазоактивным действием включают антагонисты кальция (например, нимодипин), производные алколоидов спорыньи (дигидроэргокриптин, дигидроэрготоксин, нисерголин), производные барвинка (винпоцетин, винкамин) и некоторые другие средства.
Несмотря на широкую популярность «вазоактивных средств», их роль в лечении ДЭП окончательно не определена. Способность этой группы лекарственных средств в долгосрочном плане улучшать перфузию мозга не доказана [14]. Ослабление реактивности пораженных мелких сосудов может быть серьезным препятствием на пути их лечебного эффекта. Тем не менее механизм возможного положительного действия этих препаратов на когнитивные функции может быть связан не столько с вазоактивным, сколько с нейрометаболическим или нейромедиаторным действием. Из препаратов данной группы больных ДЭП наиболее хорошо изучена эффективность нимодипина. В крупном годовом плацебо-контролируемом исследовании было показано умеренное благоприятное влияние нимодипина на регуляторные когнитивные функции, однако стабилизации общего уровня когнитивных нарушений на фоне приема нимодипина достигнуть не удалось [35].
Таким образом, с учетом многоаспектности в патогенезе ДЭП наиболее перспективно комбинирование средств, влияющих на различные звенья патогенеза заболевания и его отдельных симптомов (рис. 2).



