По данным ВОЗ, патология тканей пародонта занимает одно из ведущих мест в структуре стоматологической заболеваемости и является главной причиной преждевременной потери зубов [3]. В настоящее время считается, что в развитии воспалительных заболеваний пародонта первостепенное значение имеет синергическое взаимодействие основных представителей пародонтопатогенной микрофлоры (МФ) в составе биопленки [4, 11]. Исследования последних лет были сфокусированы на идентификации возбудителей заболеваний пародонта. Для этих целей используют методы молекулярной биологии, в частности высокоточную диагностику с использованием ПЦР (полимеразная цепная реакция) [1, 2, 6].
Современные методы лечения пародонтита, в т.ч. с применением антибактериальных препаратов, не всегда обеспечивают достижение стойкой ремиссии у пациентов. Несмотря на большой опыт применения антибиотиков в пародонтологии, в настоящее время не сформулированы четкие показания к проведению системного применения антибактериальных препаратов при лечении пациентов с хроническим генерализованным пародонтитом (ХГП), также имеются противоречивые данные о последовательности применения антибактериальной терапии (АБТ) и механического удаления зубных отложений [5, 10]. Применяя при пародонтите АБТ, необходимо исходить из того, что пародонтопатогенные микроорганизмы существуют в состоянии биопленок, которые придают микроорганизмам высокую устойчивость к проводимым лечебным мероприятиям [8, 9, 11].
Целью исследования стала оценка эффективности системного применения антибактериальных препаратов для лечения пациентов с ХГП средней и тяжелой степеней с учетом коэффициента обсемененности пародонтальных карманов (ПК).
Материал и методы исследования
В исследование были включены 80 пациентов с ХГП (38 мужчин и 42 женщины) в возрасте от 35 до 68 лет, которым проводилось комплексное обследование и лечение. Критериями включения в исследование стали наличие у пациента ХГП средней или тяжелой степени без фоновой патологии или с таковой, но без признаков обострения.
Все пациенты, включенные в исследование, в полном объеме и в доступной форме были проинформированы о проводимых методах обследования и лечения; каждым участником исследования было подписано добровольное информированное согласие.
После установления диагноза пациенты были распределены случайным образом на 4 группы, однако так, чтобы в каждой группе было по 10 человек с ХГП средней степени и 10 человек с ХГП тяжелой степени тяжести.
В группе 1 в состав комплексного лечения включали системную АБТ азитромицином. В группе 2 для АБТ использовали препарат цефиксим.
В группе 3 пациентам назначали комбинированный антибактериальный препарат, содержащий 500 мг ципрофлоксацина и 600 мг тинидазола.
В группе 4 (контрольной) системную АБТ не проводили.
Обследование пациентов проведено с оценкой состояния пародонтального комплекса, рентгенологического исследования, а также анализа качественного и количественного состава микробиоценоза ПК на этапах: 1) первичного обследования; 2) через 14 дней, 3 и 6 месяцев после проведенного лечения. В содержимом пародонтальных карманов определяли 11 бактерий: Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola, Prevotella intermedia, Parvimonas micra, Fusobacterium nucleatum, Campilobacter rectus, Eubacterium nodatum, Eikenella corrodens, Capnocytophaga spp. Забор проб для ПЦР проведен стерильными бумажными эндодонтическими штифтами (размер № 25), которые погружали в наиболее глубокий ПК до его дна и оставляли на 10 секунд. Анализ проводили методом мультиплексной ПЦР с помощью наборов реактивов Мicro-IDent и Мicro‑IDent plus (Hain Lifescience, Германия). Амплифицированные образцы идентифицировали методом обратной гибридизации в соответствии с протоколом фирмы-производителя. Для определения соотношения патогенов в образцах, количество копий геном–эквивалентов (ГЭ) бактерий каждого вида нормировали относительно общей бактериальной массы, представленной в образце (детекция по консервативному участку гена 16S рРНК), а также относительно количества геномной ДНК человека (фрагмент гена рецептора гормона роста).
Для более точной характеристики дисбиотических изменений состава МФ у пациентов с ХГП и оценки антибактериальной эффективности лечения нами был разработан собственный коэффициент, отражающий относительное содержание пародонтопатогенных агентов (степень обсемененности) в ПК вне зависимости от степени тяжести деструктивных изменений в пародонте:

После эффективного комплексного лечения с включением АБТ значения данного коэффициента должны стремиться к 0 за счет уменьшения или полной элиминации пародонтопатогенных представителей МК в содержимом ПКУ.
Результаты исследования
При исходном определении содержимого ПК у пациентов с пародонтитом как при средней, так и при тяжелой степени заболевания было выявлено присутствие той или иной комбинации пародонтопатогенных агентов (см. таблицу).
С помощью ПЦР-исследования установлено, что с прогрессированием пародонтита происходит увеличение частоты встречаемости и количества практически всех исследованных пародонтопатогенов, за исключением A. actinomycetemcomitans и E. сorrodens, количество которых у пациентов с ХГП средней и тяжелой степеней достоверно не различалось, в среднем составив 103–104 ГЭ/образец. При ХПГ тяжелой степени в ПК отмечено резкое увеличение не только частоты встречаемости, но и количества P. gingivalis, T. forsythia и Т. denticola, также увеличилось содержание P. intermedia, C. rectus, Capnocytophaga spp.
Следует отметить, что у пациентов с ХГП тяжелой степени пародонтопатогенные микроорганизмы образовывали более сложные ассоциации по сравнению с пациентами с ХГП средней степени тяжести, у которых образцы поддесневой МК характеризовались менее выраженным разнообразием пародонтопатогенных представителей. При ХГП тяжелой степени в ассоциациях доминировали такие представители агрессивной МФ, как P. gingivalis, T. forsythia, T. denticola, P. intermedia, F. nucleatum, P. micra.
Так, у пациентов с ХГП тяжелой степени P. gingivalis, T. forsythia, T. denticola одновременно выявлены в 67,5% случаев, а при ХГП средней степени – в 75,0%. P. intermedia, P. micra, F. nucleatum, C. rectus, Campylobacter spp. встречались соответственно в 25,0 и 47,5% случаев. По литературным данным, эти ассоциации бактерий оказывают наиболее выраженное повреждающее действие на ткани пародонта [7].
Исследование МФ ПК показало, что по мере утяжеления клинических симптомов пародонтита наблюдалась тенденция к увеличению количества бактерий в содержимом ПК, что было характерно для большинства представителей патогенной МФ, лишь содержание A. actinomycetemcomitans в ПК у пациентов с ХГП средней и тяжелой степеней достоверно не различалось.
У всех пациентов, в ПК которых выявлено наличие A. actinomycetemcomitans, количество этого микроорганизма оказалось сравнительно низким и не превышало 103–104 ГЭ/образец.
Включение в комплексное консервативное лечение больных ХГП средней степени тяжести АБТ позволило не только существенно снизить общую бактериальную нагрузку на ткани пародонта, но и значительно уменьшить частоту выявления и количественное содержание всех исследованных пародонтопатогенов в составе поддесневой МФ.
Азитромицин показал высокую антимикробную активность в отношении A. actinomycetemcomitans, P. gingivalis, T. forsythia и T. denticola. Так, при ПЦР-исследовании через 14 дней после проведенного лечения у пациентов группы 1 бактерии вида А. actinomycetemcomitans не обнаруживались, частота выявления P. intermedia, T. denticola снизилась в 2, T. forsythia – в 1,5 раза, а P.gingivalis уменьшилась на 30%.
У пациентов, получивших курс цефиксима, значительно снизилось количество пигментообразующих бактерий (P. gingivalis, T. forsythia) и спирохет (T. denticola).
Комбинированный препарат, содержащий ципрофлоксацин и тинидазол, оказался эффективным лекарственным средством против всех изученных пародонтопатогенных микроорганизмов, как грамположительных, так и грамотрицательных, особенно против A. actinomycetemcomitans и всех анаэробов.
В группе 4 (контрольной), где АБТ не проводили, частота встречаемости пародонтопатогенных микроорганизмов изменилась не так существенно.
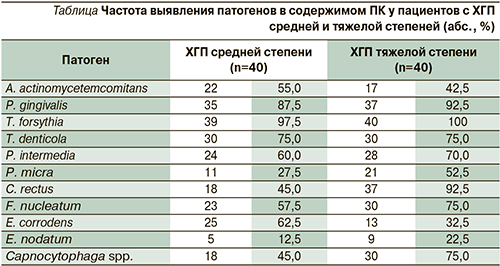
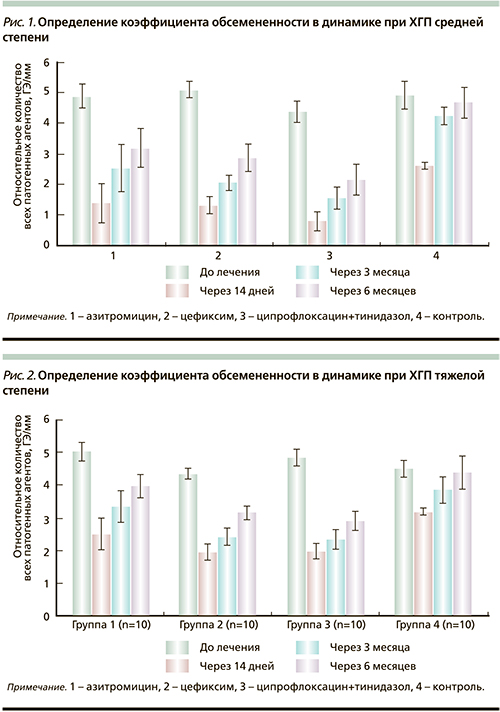
Расчет нашего коэффициента показал, что до проведенного лечения он в среднем был равен 4,82±0,30 у пациентов с ХГП средней степени тяжести и 4,69±0,21 – при ХГП тяжелой степени. Оценка эффективности лечения с помощью разработанного нами коэффициента обсемененности ПК показала, что данный показатель после терапии снижался во всех четырех группах за счет уменьшения или полной элиминации пародонтопатогенных представителей МФ в содержимом ПК, но в группах 1–3 после курса АБТ значения данного коэффициента снижались на порядок, в то время как у пациентов группы 4 (контрольной) его падение было не столь существенным (рис. 1, 2).
В отдаленные сроки антимикробный эффект от проведенного лечения снижался во всех группах, но даже через 6 месяцев после терапии частота встречаемости и количественное содержание пародонтопатогенных микроорганизмов у пациентов в группах 1–3 были существенно ниже, чем в группе 4 (контрольной). Наиболее стойкий эффект отмечен в группе 3, пациентам которой назначали комбинированный препарат ципрофлоксацин+тинидазол, где сохранялся высокий антимикробный эффект в отношении большинства пародонтопатогенных микроорганизмов. По‑видимому, это связано с тем, что в составе поддесневой МФ при ХГП тяжелой степени выявляются различные сообщества патогенных бактерий, обладающих значительной устойчивостью к антибиотикам, поэтому сочетанное использование двух препаратов повышает эффективность лечения. К преимуществам комбинированной АБТ относятся расширенный спектр антимикробной активности, синергичность действия и профилактика развития бактериальной устойчивости. Вместе с тем при сочетании двух препаратов повышается риск развития побочных эффектов.
По результатам исследования системное применение азитромицина рекомендуется при частых обострениях ХГП средней степени тяжести, возникновении пародонтальных абсцессов, выявлении в составе поддесневой МФ A. actinomycetemcomitans (в количестве > 104 ГЭ/образец), а из анаэробов – фузобактерий и превотелл.
Антибиотик цефексим группы цефалоспоринов III поколения пролонгированного действия показан при ХГП средней степени тяжести, когда в составе поддесневой МФ превалируют грамположительные и грамотрицательные представители оранжевого комплекса (F. nucleatum, C. rectus, P. micra, P. intermedia, E. nodatum), возможно присутствие A. actinomycetemcomitans, но количественное содержание P. gingivalis и T. forsythia не превышает 103 ГЭ/образец.
Ципрофлоксацин в сочетании с тинидазолом целесообразно использовать при ХГП тяжелой степени. Результаты применения данной комбинации препаратов в комплексом лечении ХГП тяжелой степени свидетельствуют об ее эффективности даже при высоком исходном уровне P. gingivalis и T. forsythia в ПК (>106 ГЭ/образец): активность воспаления в тканях пародонта снижалась на фоне полной элиминации или значительного уменьшения количества пародонтопатогенных микроорганизмов. Это позволяло создавать оптимальные условия для последующего хирургического и ортопедического лечения.
Таким образом, динамика данных ПЦР-диагностики показала, что комплексное лечение с системной этиотропной АБТ способствовало снижению частоты встречаемости и количества отдельных видов пародонтопатогенных микроорганизмов в составе МФ ПК у пациентов с ХГП средней и тяжелой степеней. Полученные результаты свидетельствуют о том, что проведение АБТ на этапах комплексного лечения больных ХГП тяжелой степени позволяет не только существенно снижать общую бактериальную нагрузку на ткани пародонта, но и значительно уменьшать частоту выявления и количественное содержание в составе поддесневой МФ всех исследованных пародонтопатогенов, что подтверждается расчетом коэффициента обсемененности ПК.



