Ювенильный идиопатический артрит (ЮИА) – хроническое воспалительное заболевание суставов неизвестной этиологии продолжительностью не менее 6 месяцев, начинающееся в возрасте до 16 лет [1]. ЮИА относится к числу наиболее распространенных ревматических заболеваний детского возраста [2]. Согласно действующей классификации ILAR (International League of Associations for Rheumatology), ЮИА подразделяется на 7 субтипов, каждый из которых имеет свое определение и диагностические критерии [3]. Под полиартикулярным вариантом ЮИА (пЮИА) понимают артрит пяти и более суставов, развившийся в течение первых
6 месяцев заболевания. В среднем полиартикулярные формы ЮИА встречаются примерно у 20% от общего числа пациентов с ЮИА, большая часть которых (85%) являются негативными по ревматоидному фактору (РФ). Однако если к этой группе добавить пациентов, относящихся к субтипу «распространяющийся олигоартрит», т.е. пациентов, которые за первые 6 месяцев приобрели менее пяти пораженных суставов, но в последующем суставное поражение распространилось, превратившись в классический полиартит, то общая доля пациентов с полиартикулярным течением заболевания составит от трети до половины общего числа пациентов с ЮИА.
Пациентам с полиартикулярными вариантами ЮИА, особенно позитивным по РФ, в связи с неблагоприятным прогнозом уже с момента постановки диагноза рекомендуется назначение традиционных базисных противовоспалительных препаратов (БПВП) [4]. Препаратом выбора служит метотрексат, реже используется комбинация метотрексата с гидроксихлорохином и сульфасалазином, т.н. тройная терапия, чаще применяемая взрослыми с РФ-позитивным полиартритом. Отсутствие эффекта, недостаточный эффект на протяжении 3–6 месяцев лечения либо непереносимость высоких доз метотрексата служат основанием для эскалации терапии с использованием генно-инженерных биологических препаратов (ГИБП) [5]. В настоящее время известна роль ведущих провоспалительных цитокинов – интерлейкина-1 (ИЛ-1), ИЛ-6, а также фактора некроза опухоли α (ФНО-α) в патогенезе полиартикулярного субтипа ЮИА [6, 7]. Для блокирования воспалительного пути, опосредованного цитокинами, разработано несколько видов генно-инженерных биологических препаратов, часть из которых уже получила одобрение в США, странах Европы и РФ для лечения пЮИА. Среди блокаторов ФНО-α в РФ в настоящее время разрешены этанерцепт детям с 2-летнего возраста, адалимумаб – с 4-летнего возраста. Инфликсимаб и голимумаб не получили одобрения, т.к. их эффективность не была доказана в международных многоцентровых рандомизированных клинических исследованиях (РКИ). Цертолизумаб пегол в настоящее время находится в стадии клинического испытания у детей в возрасте старше 6 лет. Первый среди блокаторов ИЛ-1, анакинра, исходно был разработан для терапии взрослых пациентов с ревматоидным артритом [8], однако в педиатрии он применяется преимущественно для лечения системного ЮИА (сЮИА) [9–11], не имея официальных показаний, а также официально зарегистрирован для лечения криопирин-ассоциированного периодического синдрома.
Среди блокаторов ИЛ-1 в России только канакинумаб разрешен к применению у детей старше 2 лет для лечения сЮИА [12–14]. Новый блокатор ИЛ-1, – рилонацепт, имеющий показания к лечению криопирин-ассоциированного периодического синдрома [15], также показал свою эффективность в отношении сЮИА. Несмотря на известную роль ИЛ-1 в патогенезе ревматоидного артрита и пЮИА, эффективность препаратов, блокирующих этот сигнальный путь, не очень высока. Эти препараты имеют весьма ограниченное применение, кроме случаев сЮИА, где блокаторы ИЛ-1 рассматриваются как вариант стартовой терапии наравне с блокаторами ИЛ-6 [16].
Кроме того, для лечения пЮИА в РФ зарегистрирован абатацепт – блокатор ко-стимуляции Т-лимфоцитов, разрешенный к применению у детей в возрасте старше 6 лет. В 2013 г. после завершения международного многоцентрового РКИ CHERISH, тоцилизумаб (ТЦЗ), моноклональное антитело к рецепторам ИЛ-6, был официально разрешен в качестве лечения пЮИА у детей в возрасте 2 лет и старше [17]. До этого эффективность ТЦЗ для лечения системного ЮИА была показана в двух РКИ [18–19]. В настоящее время в реальной клинической практике для лечения детей с ЮИА, рефрактерных к метотрексату, чаще других используются блокаторы ФНО-α, однако и они не всегда оказываются эффективными в контроле воспалительного процесса, поэтому необходимы препараты с другим механизмом действия, такие как блокатор ИЛ-6 и блокатор ко-стимуляции Т-лимфоцитов.
В настоящее время опыт применения ТЦЗ при пЮИА ограничен двумя исследованиями, одним из которых является исследование CHERISH, вторым – открытое многоцентровое исследование, проведенное на базе пяти клиник Японии и включившее 19 пациентов (клинические испытания NCT00144664 и NCT00144625), а также единичные клинические наблюдения [20].
Цель исследования: дать оценку эффективности и безопасности применения ТЦЗ у детей с пЮИА, получавших лечение в СПбГПМУ.
Материал и методы
В ретроспективное обсервационное исследование были включены 20 детей, страдающих полиартикулярным вариантом ЮИА, резистентных к предшествующей терапии традиционными БПВП, получавших терапию ТЦЗ не менее 6 месяцев.
Критерии включения в исследование:
- Наличие полиартикулярного варианта течения ЮИА с наличием не менее 5 активных суставов на момент включения. Под полиартикулярным вариантом течения ЮИА подразумевался распространяющийся олигоартрит, полиартрит позитивный и негативный по РФ. Все подтипы определены согласно классификационным подходам ILAR [3].
- Недостаточная эффективность и/или непереносимость метотрексата в виде парентеральных инъекций в дозе 15 мг/м2/нед либо комбинации метотрексата с другим традиционными БПВП.
- Отсутствие активного увеита в течение как минимум 6 месяцев до первого введения ТЦЗ.
Критерии исключения:
- Наличие признаков системного артрита в дебюте заболевания.
- Наличие признаков любой активной инфекции, а также латентной ТВ(туберкулезной)-инфекции. При наличии признаков латентной ТВ-инфекции пациенты могли быть включены в исследование только после курса химиотерапии, назначенной фтизиатром.
- Наличие любого иного заболевания или состояния, препятствующего проведению терапии ТЦЗ, по мнению лечащего врача. Все пациенты получали ТЦЗ в дозе 8 мг/кг в виде внутривенных инфузий каждые 4 недели.
В исследование включены пациенты, получавшие непрерывную терапию ТЦЗ на протяжении не менее 6 месяцев. Максимальный срок наблюдения за пациентами, которые начали терапию в 2010 г., составил 42 месяца. Дизайн исследования предполагал внесение в базу данных основных показателей активности артрита, таких как число активных суставов (ЧАС), уровни гемоглобина, лейкоцитов, тромбоцитов периферической крови, измерение скорости оседания эритроцитов (СОЭ), измерение концентрации С-реактивного белка (СРБ), общего холестерина и триглицеридов сыворотки крови до начала терапии ТЦЗ и каждые 6 месяцев. Под гиперхолестеринемией понималось любое повышение уровня общего холестерина натощак более 5,17 ммоль/л, а под гипертриглицеридемией – повышение уровней триглицеридов более 1,69 ммоль/л (верхняя граница нормы локальной лаборатории). Промежуток в 6 месяцев был выбран не случайно. Для всех пациентов терапия ТЦЗ была инициирована в педиатрическом отделении № 3 СПбГПМУ, иногородние пациенты продолжали терапию в регионах, приезжая на контрольные обследования в СПбГПМУ каждые 6 месяцев.

Окончанием исследования считался последний известный эпизод введения ТЦЗ. Данные обо всех побочных эффектах во время исследования собирались по возможности максимально рано относительно времени их появления. Оценивалась возможность изменения сопутствующей иммуномодулирующей терапии для всех пациентов, а также достижение статуса неактивного заболевания, определяемого как отсутствие активных суставов, отсутствие системных проявлений, имеющих отношение к ЮИА, отсутствие увеита, нормальные значения показателей реактантов острой фазы, отсутствие активности заболевания, по мнению врача [21]. Осмотр офтальмолога с применением биомикроскопии осуществлялся в сроки в соответствии с рекомендациями ACR (American College of Rheumatology) в зависимости от возраста, наличия антинуклеарного фактора, за исключением пациентов, имевших увеит до назначения ТЦЗ. В этом случае осмотр офтальмолога осуществлялся непосредственно перед каждой инфузией.
Отдельно производилось сравнение эффективности ТЦЗ как первого (n=12), так и последующего генно-инженерного биологического препарата (n=8), когда ТЦЗ использовался после других ГИБП (блокаторы ФНО-α или абатацепт).
Статистический анализ выполнен при помощи пакетов статистических программ Statistica 6.0, Biostat, MedCalc и Microsoft Excel. Использовались методы описательной статистики (определялись медиана и интерквартильный размах), χ2, точный критерий Фишера. Для сравнения двух зависимых групп использовались парный тест Вилкоксона, для сравнения более двух зависимых групп – тест Фридмана. Для сравнения двух независимых групп использовался тест Манна–Уитни. Применяли анализ специфичности и сенситивности, ROC-анализ (определялись отрезные точки, сенситивность и специфичность, AUC – area under the curve – «площадь под кривой»), Log-Rank-анализ, регрессионные модели Cox, а также анализ выживаемости Kaplan–Meier.

Результаты
Среди детей, включенных в исследование, большую часть (85%) составляли девочки. Все пациенты имели полиартикулярное поражение (>5 активных суставов), а также опыт предшествующей неэффективной терапии метотрексатом либо комбинацией метотрексата с другим традиционным БПВП. Большинство пациентов имели длительный стаж артрита с предшествующей неэффективностью при применении лекарственных препаратов разных классов. Из 20 детей, включенных в исследование, 16 получали терапию метотрексатом, 4/16 –комбинацию метотрексата с другими традиционными БПВП (циклоспорин, лефлюномид). Четырем детям метотрексат был отменен перед инициацией терапии ТЦЗ: троим – в связи с предшествующей неэффективностью, одному – в связи с выраженными диспепсическими явлениями. На момент инициации терапии ТЦЗ дети не получали системных или локальных кортикостероидов, хотя ранее 70% пациентов получали системные внутривенные или пероральные кортикостероиды. Тяжесть пациентов можно также оценивать по количеству применяемых ранее традиционных БПВП и ГИБП. Только метотрексат получали всего 25% детей, 35% детей имели опыт неэффективности при применении двух традиционных БПВП, у 30% детей имела место недостаточная эффективность трех традиционных БПВП, а в отношении 1 (5%) ребенка имела место неэффективность терапии 4 БПВП, примененных последовательно на разных этапах заболевания. До назначения ТЦЗ 40% детей имели опыт предшествующей терапии ГИБП: 3 ребенка получали ранее терапию одним ГИБП, тогда как еще 5 детей последовательно применяли 2 ГИБП как с одинаковым, так и с отличным механизмом действия.
Причиной отмены ГИБП служили первичная неэффективность либо ускользание эффекта, полученного ранее. Длительность артрита (медиана) до инициации терапии ТЦЗ составила 6 лет. Подробная демографическая характеристика пациентов, включенных в исследование, а также исходы терапии представлены в табл. 1.
Длительность терапии составила от 12 до 42 месяцев, данные представлены на рис. 1. В настоящее время половина пациентов, как следует из диаграммы, получают терапию ТЦЗ на протяжении почти трех лет.
Оценка эффективности терапии оценивалась по уменьшению числа активных суставов, улучшению и нормализации показателей воспалительной активности, достижению статуса «неактивное заболевание», уменьшению сопутствующей терапии.
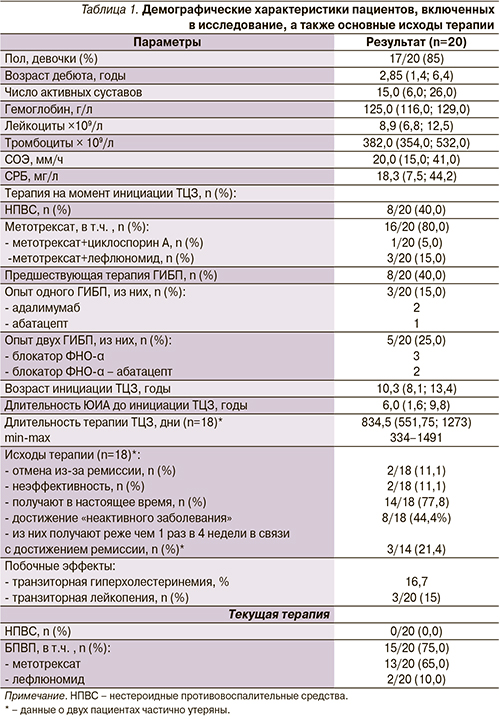
На фоне проводимой терапии ТЦЗ НПВС удалось отменить всем 100% пациентов, 4 детям, получавшим комбинацию двух традиционных БПВП, удалось отказаться от второго традиционного БПВП, 3 пациентам удалось отменить метотрексат. Монотерапия ТЦЗ проведена 25% детей в ходе исследования. В табл. 2 представлена динамика основных показателей, отражающих активность ЮИА.
Сравнение показателей, оцениваемых каждые 6 месяцев, проведено по отношению к показателям, полученным до начала терапии ТЦЗ. Как видно из табл. 2, на фоне проводимой терапии отмечено достоверное уменьшение числа активных суставов, уровней СОЭ, СРБ, числа лейкоцитов и тромбоцитов уже к окончанию первого полугодия терапия. Число активных суставов уменьшалось более медленными темпами по сравнению с другими показателями активности, такими как СОЭ и СРБ, уменьшившись в три раза к окончанию первого полугодия терапии, достигнув медианы числа активных суставов, равной нулю к 24-му месяцу терапии (рис. 2–3). Интересно, что применение ТЦЗ приводило к повышению уровня гемоглобина, который исходно был в пределах нормальных значений практически у всех пациентов. Известно, что анемия при хроническом воспалении связана с гиперпродукцией гепсидина, синтез которого стимулируется ИЛ-6. Медикаментозная блокада эффектов ИЛ-6 приводит к уменьшению уровня гепсидина, что реализуется в интенсификации эритропоэза [22]. Подобный эффект ранее был показан в исследовании TENDER при использовании ТЦЗ для лечения системного ЮИА [19]. Подробные данные динамики основных показателей активности ЮИА представлены в табл. 2. Изменения липидных показателей общего холестерина сыворотки и триглицеридов за время наблюдения претерпели следующие изменения. Так, уровень общего холестерина максимально повышался на 10% по сравнению с исходным к 6-му месяцу с последующим снижением и нормализацией к 18-му месяцу, оставаясь неизменным до конца периода наблюдения. Исходно частота гиперхолестеринемии (>5,17 ммоль/л) составляла 8,7%, максимально увеличившись к 6-му месяцу до 33,3%, постепенно снизившись в последующем до частоты в 25% (12–18-й месяц). Начиная с 24-го месяца случаев гиперхолестеринемии выявлено не было. Уровень триглицеридов в течение исследования повышался незначительно только у 1 пациента к 6-му месяцу. Изменения уровней холестерина и триглицеридов, а также изменение доли детей с гиперхолестеринемией и гипертриглицеридемией не имели статистически достоверных различий по сравнению с исходными значениями.
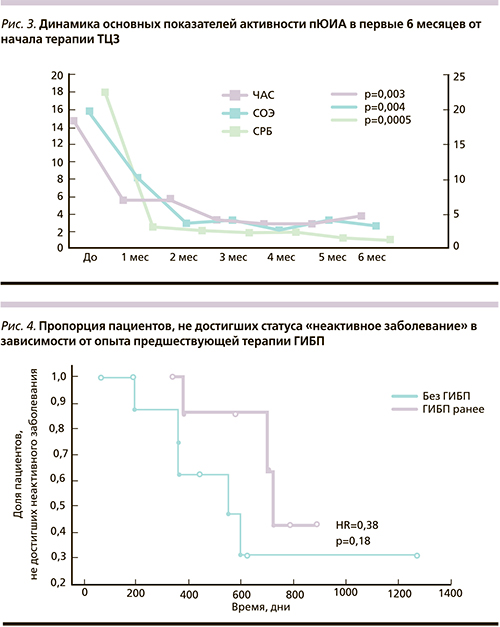
В ходе исследования 8 пациентов в разные сроки достигли статуса «неактивное заболевание» в соответствии с критериями C. Wallace [21], что составило 44,4% от общего числа детей. Не выявлено достоверных различий в сроках и частоте достижения статуса «неактивное заболевание» между пациентами, получавшими и не получавшими ранее ГИБП (отношение рисков [ОР]=0,38; p=0,18) до назначения ТЦЗ (рис. 4). Кроме того, при сравнении исходных демографических характеристик и показателей активности ЮИА не выявлено статистически достоверных различий между пациентами, получавшими и не получавшими ранее ГИБП (данные не представлены). При проведении статистического анализа выявлены предикторы, ассоциированные с более ранним достижением статуса «неактивное заболевание». Наиболее чувствительными критериями оказались уровень СРБ≤7,5 мг/л (сенситивность – 1,0, специфичность – 0,71, отношение шансов [ОШ]=21,0, 95% доверительный интервал [ДИ] – 0,9–477,3; р=0,023), монотерапия ТЦЗ без БПВП на момент инициации (сенситивность – 0,5, специфичность – 1,0, ОШ=23,0, 95% ДИ – 1,0–520,1; р=0,008). Применение Log-Rank-анализа подтвердило значимость выявленных ранее предикторов неактивного заболевания: СРБ≤7,5 мг/л (р=0,03), СОЭ≤19 мм/ч (р=0,01), монотерапия ТЦЗ (р=0,01). Те же факторы были подтверждены методами регрессионного анализа (табл. 3). В настоящее время из 8 детей, достигших статуса «неактивное заболевание», двоим отменен ТЦЗ в связи с развитием длительной ремиссии, а еще 3 пациентам ТЦЗ вводится с большими промежутками (1 раз в 6–8 недель) как этап подготовки к отмене (все 5 пациентов получали монотерапию ТЦЗ).

Среди побочных эффектов следует отметить транзиторную гиперхолестеринемию, гипертриглицеридемию, описанные ранее (табл. 1), одна пациентка страдала микроспорией, потребовавшей отмены ТЦЗ на срок 4 месяца для проведения противогрибковой терапии. После выздоровления терапия ТЦЗ была продолжена снова с прежней эффективностью, пациентка в последующем достигла статуса «неактивное заболевание». В ходе исследования было зафиксировано 4 эпизода транзиторной нейтропении у 3 пациентов, двое из которых получали традиционные БПВП. Степень снижения лейкоцитов у двух пациентов (3 эпизода из 4) соответствовала I степени, согласно классификации ВОЗ, и 1 эпизод у 1 ребенка соответствовал II степени. Нейтропения не сопровождалась присоединением интеркуррентных заболеваний, не требовала специальной терапии (антибиотиков или стимуляторов лейкопоэза). В ходе терапии у пациентов отмечены единичные случаи респираторных инфекций, частота которых не отличалась от среднепопуляционных. Случаев тяжелых инфекций, требовавших госпитализации и назначения парентеральной антибактериальной терапии не было.
Одной пациентке в связи с развитием деформирующего остеоартроза тазобедренного сустава было выполнено эндопротезирование тазобедренного сустава. Оперативное вмешательство было запланировано в межинфузионный промежуток и прошло без осложнений.
Среди частных эффектов следует отметить достаточно хороший эффект ТЦЗ на течение артрита височно-нижнечелюстного сустава (ВНЧС). Как известно, поражение ВНЧС достаточно торпидно к проводимой терапии и зачастую требует применения внутрисуставных инъекций кортикостероидов даже пациентами, получающими метотрексат в сочетании с блокаторами ФНО-α [23].
В нашем исследовании отмечено купирование двустороннего артрита ВНЧС у пациентки, не получавшей ранее ГИБП, значительное улучшение функции ВНЧС у девочки, имевшей в анамнезе опыт применения двух блокаторов ФНО-α, на фоне которых артрит ВНЧС прогрессировал.
У третьей пациентки, также имевшей опыт применения одного блокатора ФНО-α, отмечено купирование болевого синдрома, а также существенное увеличение открывания рта (с 20 до 36 мм). Ремиссия артрита ВНЧС продолжалась более года, однако затем у девочки был отмечен рецидив артрита ВНЧС, потребовавший внутрисуставного введения кортикостероидов.
Одна пациентка имела в анамнезе увеит с продолжительностью ремиссии более года до инициации терапии ТЦЗ. За время применения ТЦЗ обострений увеита выявлено не было.
Инфузионных реакций за все время наблюдения зафиксировано не было в отличие от случаев применения ТЦЗ у пациентов с системным ЮИА, где инфузионные реакции были зафиксированы чаще [18, 24].
Обсуждение
Результаты нашего исследования, подобно результатам двух РКИ, свидетельствуют о достаточно высокой эффективности и безопасности ТЦЗ. В нашем исследовании уже через 6 месяцев пациенты достигали статуса «неактивного заболевания», максимальная доля пациентов, достигших состояния «неактивное заболевание», составила 44,4%. Двум пациентам удалось в настоящее время отменить ТЦЗ в связи с достижением длительной ремиссии, 21,4% находившихся в ремиссии пациентов удалось удлинить межинфузионные интервалы как этап подготовки к возможной отмене. Пациенты, не получавшие ранее ГИБП, немного быстрее достигали статуса «неактивное заболевание» по сравнению с пациентами, имевшими опыт применения ГИБП, хотя различия статистически недостоверны. Подобный феномен был отмечен ранее во время проведения РКИ других ГИБП [25]. Тем не менее среди 8 пациентов, достигших статуса «неактивное заболевание», 3 (37,5%) пациентов получали ранее один или два ГИБП; кроме того, из 8 пациентов, получавших ранее ГИБП, те же 3 (37,5%) пациента достигли статуса «неактивное заболевание».
При сравнении пациентов, получавших и не получавших метотрексат, достоверных различий получено не было, тем не менее отмечено, что пациенты, не получавшие метотрексат, быстрее достигали статуса «неактивное заболевание». С одной стороны, небольшая по численности выборка требует дальнейшего наблюдения, с другой – этот факт в первую очередь может свидетельствовать об эффективности монотерапии ТЦЗ.
В нескольких РКИ уже было показано, что монотерапия ГИБП сопоставима по эффективности с комбинированной терапией ГИБП и метотрексатом [26], тогда как в других исследованиях показан их синергизм [27]. Возможно, сопутствующая терапия метотрексатом важна для пациентов – ответчиков ACR 50-70-90, а также способна влиять на частоту рецидивов, удержание или усиление полученного эффекта, длительность сохранения статуса «неактивное заболевание». Данный аспект нами не учтен, т.к. решение этих вопросов не входило в поставленные задачи. В отношении взрослых пациентов с ревматоидным артритом в результате нескольких серьезных исследований показан эффект монотерапии ТЦЗ, сопоставимый с комбинированной терапией ТЦЗ с метотрексатом [28–30].
Возможность монотерапии, высокая эффективность, а также сравнительно редкие инфузии препарата (1 раз в 4 недели) делают его достаточно удобным для детей и их родителей. Внутривенный путь введения может создавать некоторые трудности для пациентов младшего возраста, тогда как многие подростки сознательно выбирают препарат с продолжительным межинфузионным интервалом, т.к. это позволяет им быть более независимыми и реже посещать стационар. Наличие внутривенного пути введения обеспечивает более надежную концентрацию препарата в крови, тогда как особенности строения подкожно-жировой клетчатки могут влиять на абсорбцию подкожно-вводимого препарата и уровень концентрации препарата в крови, особенно если это касается крупных белковых молекул [31].
Среди побочных эффектов следует отметить нейтропению, частота которой в нашем исследовании была зафиксирована хотя бы один раз у 15% пациентов. При этом тяжелых нейтропений (III степень по классификации ВОЗ и выше) выявлено не было.
В исследовании CHERISH доля пациентов, имевших хотя бы один эпизод нейтропении (I степень и выше), составила 37,2%, а частота тяжелых нейтропений – 3,7% [17, 32], тогда как в первом исследовании, выполненном в Японии, тяжелых нейтропений зафиксировано не было [20]. Ни в нашем исследовании, ни в исследованиях, опубликованных ранее, снижение числа нейтрофилов не сопровождалось увеличением риска инфекционных заболеваний [17–20]. Частота (16,9%) серьезных нейтропений была значительно выше в исследовании TENDER, где ТЦЗ использовался для лечения сЮИА с интервалом каждые 2 недели, а общая доля пациентов, имевших хотя бы одни эпизод любого снижения нейтрофилов, составила 57,1% [33].
В нашем исследовании частота нейтропений была ниже, чем в опубликованных исследованиях, где подсчет числа нейтрофилов осуществлялся перед каждой инфузией. Мы также анализировали данные о числе нейтрофилов из медицинской документации ежемесячно, т.к. практически всем пациентам независимо от места проведения терапии лабораторный мониторинг выполнялся перед каждой инфузией.
В нашем исследовании частота гиперхолестеринемии была сравнительно невысокой – доля пациентов, имевших хотя бы один эпизод повышения холестерина, составила 16,7%. Гиперхолестеринемия носила отчетливый транзиторный характер, тогда как в исследовании CHERISH частота гиперхолестеринемии составила 34,6%. Истинное значение повышения холестерина не совсем ясно; так, у взрослых пациентов с ревматоидным артритом повышение уровней холестерина на фоне терапии ТЦЗ не сопровождалось повышенным риском кардиоваскулярных событий и не требовало специальной коррекции [34]. Гиперхолестеринемия ранее была отмечена также и у взрослых пациентов с ревматоидным артритом, получавших терапию ТЦЗ [35]. В нашем исследовании также была выявлена гипертриглицеридемия (28,6%), которая носила более постоянный характер в отличие от гиперхолестеринемии. Интересно, что в первом исследовании ТЦЗ при пЮИА, выполненном в Японии, нет указаний на развитие нейтропении, а также нарушений липидного обмена. В исследовании, выполненном S. Yokota и соавт. в 2008 г., отмечено также незначительное повышение уровней холестерина по сравнению с исходными, однако повышение уровня холестерина не выходило за пределы нормальных значений [18]. Возможно, отсутствие выраженных нарушений липидного обмена может быть объяснено особенностями питания жителей Японии.
В нашем исследовании не было зафиксировано инфузионных реакций, частота которых отличается от субтипа артрита. Так, в доступных исследованиях при применении ТЦЗ при пЮИА предоставлены разные данные – в японском исследовании инфузионных реакций зафиксировано не было (0/19), в исследовании CHERISH – 0,5% (1/188) [17, 20]. У пациентов с сЮИА частота инфузионных реакций была выше. Так, в исследовании S. Yokota и соавт. (2008) частота инфузионных реакций, приведших к отмене препарата, составила 3,5% (2/56), а у 17,9% (10/56) пациентов были зафиксированы легкие инфузионные реакции [18]. В исследовании TENDER частота инфузионных реакций составила 0,9% (1/112), в исследовании S. Yokota и соавт. (2014) частота составила 3,0% (2/67), в нашем исследовании по сЮИА частота инфузионных реакций была еще более высокой – 9,1% (3/33) [24, 36].
В настоящее время при наличии в арсенале ревматолога нескольких достаточно эффективных ГИБП с разным механизмом действия вопрос выбора препарата носит весьма актуальный характер. Одной из актуальных и нерешенных проблем детской ревматологии является разработка терапевтических алгоритмов, позволяющих максимально точно и с наименьшими временными затратами подобрать наиболее эффективный ГИБП для каждого конкретного пациента. Индивидуальность ответа на блокаду того или иного цитокина может быть обусловлена разным цитокиновым профилем даже для пациентов, относящихся к одному клиническому субтипу. Отчетливым примером может служить сЮИА, где основными цитокинами являются ИЛ-1 и ИЛ-6.
Известно, что примерно 2/3 пациентов с сЮИА одинаково хорошо отвечают на блокаду ИЛ-1 и ИЛ-6, тогда как треть пациентов не отвечают ни на один из указанных препаратов и требуют смены антицитокинового препарата. Проводятся попытки объяснения разной чувствительности к блокаде цитокинов у пациентов с конкретными вариантами ЮИА.
В качестве кандидатов рассматриваются генетические полиморфизмы в генах цитокинов (ФНО-α, ИЛ-1, ИЛ-6), способные модулировать чувствительность рецептора, катаболизм цитокина и влиять на передачу воспалительного сигнала в таргетную клетку [37–39].
Нерешенным остается вопрос выбора стартового ГИБП и т.н. препаратов «второй линии», т.к. исследований в этой области недостаточно. Отмечено, что некоторые ГИБП более эффективны, когда применяются первыми, соответственно, оставляя тот или иной лекарственный препарат в качестве резервного, и существует опасность «недополучения» желаемого эффекта от лекарственного препарата [25, 40]. Все это требует проведения дальнейших исследований и обобщения имеющихся данных для улучшения качества оказания медицинской помощи детям с ЮИА.
Основными недостатками нашего исследования следует отметить небольшую численность, а также ретроспективный характер, хотя принципиальных различий в опубликованных результатах нет. Из положительных моментов следует отметить, что из доступных исследований наше наиболее продолжительное и оценивает степень достижения статуса «неактивное заболевание».
Заключение
В исследовании показана долгосрочная эффективность и безопасность ТЦЗ для пациентов с полиартикулярным вариантом ЮИА. Показаны высокая степень достижения статуса «неактивное заболевание», эффективность монотерапии ТЦЗ, не отличимая от комбинированной терапии ТЦЗ с метотрексатом. Не выявлено статистически достоверных различий в эффективности терапии пациентов, прежде не получавших и получавших ГИБП. На фоне терапии ТЦЗ не выявлено серьезных побочных эффектов, приведших к отмене препарата.



