Введение
Роль кислотообразования в желудке изучается с давних времен, и успехи физиологов последнего столетия позволили окончательно расшифровать механизмы, регулирующие процесс кислотопродукции в желудке, синтезировать лекарственные средства, направленные на супрессию продукции соляной кислоты (СК), необходимую для терапии ряда заболеваний.
Безусловно, функция кислотопродукции желудка остается одним из ключевых звеньев регуляции всего пищеварительного тракта.
Фундаментальные исследования отечественных и зарубежных ученых позволили установить, что СК желудка выполняет множество функций [1, 2]:
- создает кислую среду, необходимую для воздействия ферментов желудочного сока;
- активирует пепсиногены и трансформирует их в пепсины;
- способствует денатурации белков
- в полости желудка;
- влияет на моторную активность желудка (в частности, его выходного отдела);
- способствует абсорбции железа, кальция и витамина B12;
- обеспечивает антибактериальное действие желудочного сока;
- стимулирует панкреатическую секрецию.
 Хотя физиологические функции СК многообразны, ее избыточная продукция служит сильным фактором агрессии, истощая возможности кислотопротекции пищевода, желудка и двенадцатиперстной кишки. Уровень внутрижелудочной кислотности у конкретного пациента определяется числом функционирующих париетальных клеток, секретирующих СК, и возможностями нейтрализации СК щелочными компонентами желудочного сока.
Хотя физиологические функции СК многообразны, ее избыточная продукция служит сильным фактором агрессии, истощая возможности кислотопротекции пищевода, желудка и двенадцатиперстной кишки. Уровень внутрижелудочной кислотности у конкретного пациента определяется числом функционирующих париетальных клеток, секретирующих СК, и возможностями нейтрализации СК щелочными компонентами желудочного сока.
В данном контексте важную роль играет скорость кислотопродукции – чем выше этот показатель, тем меньше вероятность нейтрализации и, соответственно, выше кислотность желудочного сока [3, 4].
Причины повышенной секреции СК могут быть обусловлены генетически детерминированным увеличением массы париетальных клеток, повышенным высвобождением гастрина в ответ на прием пиши, а также нарушением нейроэндокринной регуляции кислотообразования (усиление вагусного влияния, гиперплазия и гиперфункция G-и энтерохромаффиноподобных клеток (ECL-клеток) [1]. Именно избыточное кислотообразование лежит в основе патогенеза состояний, объединенных в XX в. термином «кислотозависимые заболевания» (КЗЗ).
Кислотозависимые заболевания
По современным представлениям, КЗЗ – это группа нозологических единиц, ассоциируемых с кислотной агрессией желудочного сока, причинами которой могут быть дисбаланс между механизмами кислотопродукции и кислотонейтрализации, недостаточность кардиального или пилорического сфинктеров, иррациональное питание и злоупотребление алкоголем [5, 7].
Традиционно к КЗЗ относят следующие патологии [1, 5, 6]:
- гастроэзофагеальная рефлюксная болезнь;
- функциональная диспепсия;
- хронический гастрит/дуоденит;
- язвенная болезнь желудка/двенадцатиперстной кишки;
- эрозивно-язвенные поражения желудка и двенадцатиперстной кишки на фоне приема нестероидных противовоспалительных препаратов;
- эрозивно-язвенные поражения желудка и двенадцатиперстной кишки, ассоциированные с гиперпаратиреозом;
- синдром Золлингера–Эллисона;
- хронический панкреатит.
Для КЗЗ характерны хроническое течение, затяжные обострения, разнообразие клинических проявлений, что обусловливает частую обращаемость больных за медицинской помощью. Оказывая выраженное негативное влияние на качество жизни больных и являясь потенциально опасными в отношении развития жизнеугрожающих осложнений (желудочно-кишечные кровотечения, перфорация, прободение язвенного дефекта), КЗЗ представляют собой серьезную медико-социальную проблему [5].
Несмотря на гетерогенность этиологических процессов, КЗЗ объединяет общий патофизиологический фактор – кислотно-пептическая агрессия желудочного сока. Общность этого патофизиологического звена определила единую терапевтическую мишень – блокаду синтеза СК на различных этапах ее продукции [4].
Механизмы продукции СК
Соляная кислота вырабатывается париетальными клетками, расположенными в наружной части фундальных (главных) желез желудка. Суммарное количество париетальных клеток в желудке здорового человека приближается к 1 млрд (1000 × 106) [8]. Микроскопически париетальные клетки характеризуются крупным размером (диаметр – 20–25 мкм), овальной или пирамидальной формой и массой митохондрий, секреторных канальцев и тубуловезикул [2]. Механизм секреции СК париетальными клетками обусловлен наличием специфического трансмембранного переносчика ионов водорода – Н+-, К+-АТФазы, также известной как протонная помпа [2, 3, 7].
Протонная помпа относится к семейству белков — АТФаз P-типа, отвечающих за транспорт ионов через клеточные мембраны. Этот белок транспортирует ион Н+ через апикальную мембрану из цитозоли париетальной клетки в просвет секреторного канальца в обмен на ион К+. Источником энергии для данного транспорта является гидролиз молекулы АТФ. Последующий выход ионов К+ из цитозоли сопряжен с выходом ионов Cl- по типу симпорта. В итоге в просвете канальцев происходит взаимодействие ионов H+ и Cl- с образованием СК (рис. 1) [2, 9–11].
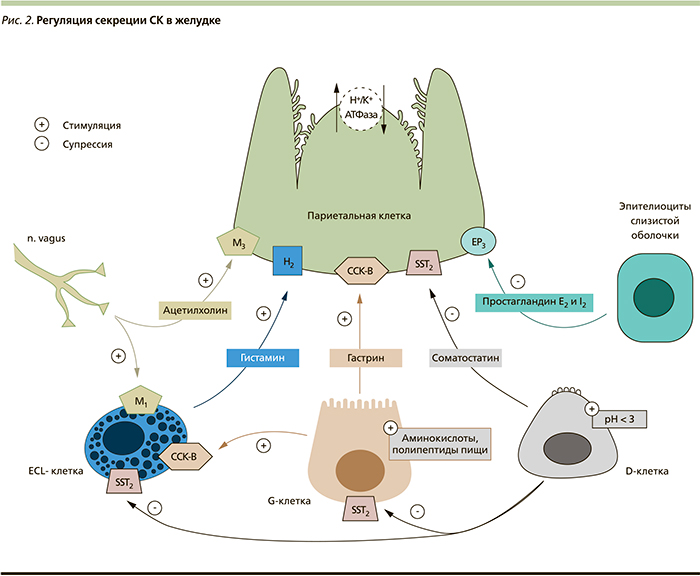
На активность секреторной функции париетальной клетки прямо или опосредованно влияют многие эндогенные субстанции. К основным стимуляторам секреции относятся ацетилхолин, гистамин и гастрин, в то время как основными эндогенными супрессорами являются соматостатин и простагландины Е2 и I2 (рис. 2) [12, 13].
Под воздействием вышеназванных стимуляторов происходит морфологическая трансформация париетальной клетки с переходом от фазы покоя (базальной секреции) к фазе стимуляции (стимулированной секреции). При этом большая часть Н+-, К+-АТФаз, находившихся в тубуловезикулах, в фазу стимуляции интегрируются в апикальную канальцевую мембрану париетальной клетки [2, 3, 11, 13].
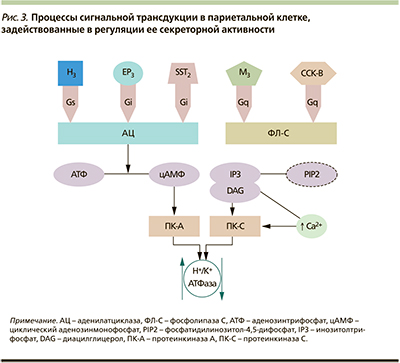 Стимулирующее влияние блуждающего нерва на желудочную секрецию происходит посредством энтеральной нервной системы с участием нейротрансмиттера ацетилхолина. Ацетилхолин, высвобождаясь из окончаний аксонов постганглионарных холинергических нейронов, связывается с мускариновым М3-холинорецептором на базолатеральной поверхности париетальной клетки. М3-холинорецептор сопряжен с Gq-белком, за счет которого происходит дальнейшая сигнальная трансдукция в клетке. Происходит активация фосфолипазы-С, которая катализирует расщепление мембранного фосфолипида фосфатидилинозитол-4,5-дифосфата (PIP2) на инозитолтрифосфат (IP3) и диацилглицерол (DAG). Инозитолтрифосфат открывает кальциевые каналы в эндоплазматическом ретикулуме, что вызывает увеличение концентрации ионов Cа2+ в париетальной клетке. Молекулы диацилглицерола совместно с ионами кальция активируют протеинкиназы С, которые фосфорилируют ряд таргетных белков, увеличивающих секреторный потенциал париетальной клетки (рис. 3) [2, 10, 11, 14, 15]. Ацетилхолин оказывает также опосредованное стимулирующее действие на париетальную клетку, оно реализуется через М1-холинорецептор на ECL-клетке, вызывая высвобождение гистамина [10, 13].
Стимулирующее влияние блуждающего нерва на желудочную секрецию происходит посредством энтеральной нервной системы с участием нейротрансмиттера ацетилхолина. Ацетилхолин, высвобождаясь из окончаний аксонов постганглионарных холинергических нейронов, связывается с мускариновым М3-холинорецептором на базолатеральной поверхности париетальной клетки. М3-холинорецептор сопряжен с Gq-белком, за счет которого происходит дальнейшая сигнальная трансдукция в клетке. Происходит активация фосфолипазы-С, которая катализирует расщепление мембранного фосфолипида фосфатидилинозитол-4,5-дифосфата (PIP2) на инозитолтрифосфат (IP3) и диацилглицерол (DAG). Инозитолтрифосфат открывает кальциевые каналы в эндоплазматическом ретикулуме, что вызывает увеличение концентрации ионов Cа2+ в париетальной клетке. Молекулы диацилглицерола совместно с ионами кальция активируют протеинкиназы С, которые фосфорилируют ряд таргетных белков, увеличивающих секреторный потенциал париетальной клетки (рис. 3) [2, 10, 11, 14, 15]. Ацетилхолин оказывает также опосредованное стимулирующее действие на париетальную клетку, оно реализуется через М1-холинорецептор на ECL-клетке, вызывая высвобождение гистамина [10, 13].
Гистамин является локально-действующим веществом, высвобождающимся при дегрануляции ECL-клеток. Взаимодействие гистамина с париетальной клеткой происходит через гистаминовые Н2-рецепторы. Н2-рецепторы сопряжены с Gs-белком, стимулирующим аденилатциклазу, которая катализирует реакцию синтеза циклического аденозинмонофосфата (цАМФ) из аденозинтрифосфата (АТФ). Являясь вторичным мессенжером в процессе стимуляции секреторной активности париетальной клетки, цАМФ активирует цАМФ-зависимые протеинкиназы (протеинкиназы А) (рис. 3) [2, 11, 13, 14]. Таргетными белками этой протеинкиназы служат многие белки цитоскелета, в частности эзрин, принимающий ключевое участие в перестроении апикальной поверхности париетальной клетки, задействованной в процессе активации секреции СК [16].
Гастрин, вырабатываемый G-клетками антрального отдела желудка в ответ на стимуляцию последних компонентами пищи (полипептиды, аминокислоты и др.), достигает париетальных клеток посредством системного кровотока [10, 13]. Его прямое стимулирующее действие реализуется через холецистокининовые ССК-B-(CCK-2 по номенклатуре IUPHAR*)-рецепторы на базолатеральной поверхности париетальной клетки, а опосредованное стимулирующее действие через взаимодействие с тем же подтипом рецепторов на ECL-клетке [10, 11, 17]. Процессы внутриклеточной сигнальной трансдукции и участвующие вторичные мессенжеры при активации ССК-B-рецептора эквивалентны вышеописанным при активации М3-холинорецептора (рис. 3) [11, 14].
Вышеописанные звенья регуляции секреторной активности париетальной клетки как на межклеточном уровне взаимодействия, так и на рецепторном и сигнальном и являются актуальной и потенциальной терапевтической мишенью для антисекреторной терапии.
Терапия КЗЗ
Эпоха лечения КЗЗ начитывает несколько этапов, связанных с применением различных групп фармакологических препаратов. С целью лечения этой группы патологий использовались неселективные и селективные М-холинолитики, блокаторы гистаминовых H2-рецепторов, а также блокаторы CCK-2-рецепторов. Однако введение в клиническую практику ингибиторов протонной помпы (ИПП) привело к революционному прорыву в лечении КЗЗ. С появлением ИПП другие классы антисекреторных препаратов стали постепенно вытесняться из клинической практики в связи со значительно менее выраженным антисекреторным эффектом и большим спектром побочных действий. Сегодня можно без сомнения сказать, что ИПП занимают передовое место в структуре антисекреторных препаратов и являются «золотым» стандартом в терапии КЗЗ [1, 2, 7, 10, 13].
Преимуществом ИПП служит быстрое подавление секреции СК, отсутствие гиперпродукции СК после окончания применения препарата, а также независимость от других механизмов (ацетилхолин, гистамин и гастрин), стимулирующих желудочную кислотопродукцию [10].
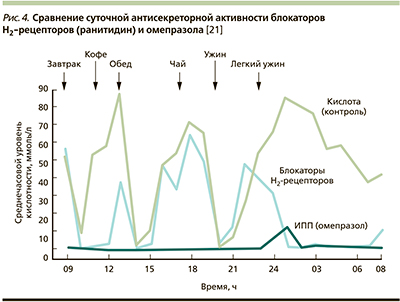 По химической природе ИПП относятся к слабым основаниям, в этой форме они не активны, но, накапливаясь в кислой среде канальцев париетальных клеток, где происходит их протонирование, они преобразуются в активную форму сульфенамид. Последний способен связываться с помощью дисульфидных связей с цистеиновыми группами протонной помпы, что приводит к необратимому ингибированию фермента и угнетению секреции СК. Кислотосупрессивный эффект ИПП по отношению как к базальной, так и стимулированной секреции длится в течение 24 часов и более. Примерно за такое время париетальная клетка синтезирует новые молекулы протонной помпы [18–20]. Показано, что однократный прием ИПП в средней терапевтической дозе приводит к угнетению желудочной кислотопродукции на 80–98 %, что существенно больше по сравнению с блокаторами гистаминовых Н2-рецепторов (рис. 4) [19, 21, 22].
По химической природе ИПП относятся к слабым основаниям, в этой форме они не активны, но, накапливаясь в кислой среде канальцев париетальных клеток, где происходит их протонирование, они преобразуются в активную форму сульфенамид. Последний способен связываться с помощью дисульфидных связей с цистеиновыми группами протонной помпы, что приводит к необратимому ингибированию фермента и угнетению секреции СК. Кислотосупрессивный эффект ИПП по отношению как к базальной, так и стимулированной секреции длится в течение 24 часов и более. Примерно за такое время париетальная клетка синтезирует новые молекулы протонной помпы [18–20]. Показано, что однократный прием ИПП в средней терапевтической дозе приводит к угнетению желудочной кислотопродукции на 80–98 %, что существенно больше по сравнению с блокаторами гистаминовых Н2-рецепторов (рис. 4) [19, 21, 22].
В 1988 г. в Европе был зарегистрирован первый ИПП – омепразол под торговым названием «Лосек®» (АstraZeneca, Швеция). Уже в 1996 г.
Лосек стал самым продаваемым фармацевтическим товаром в мире. Несмотря на более чем 20-летнюю историю, он и до сегодняшнего дня остается одним из наиболее востребованных лекарственных средств [20].
На сегодня в клиническую практику внедрены и многие другие представители ИПП, однако эталонным препаратом этой группы можно назвать эзомепразол (Нексиум®; AstraZeneca, Швеция), который является S-энантомером омепразола (омепразол представляет собой рацемическую смесь S- и R-энантомеров). Стереоспецифичность эзомепразола не проявляется в механизме его действия на протонную помпу, однако она придает ему преимущества по отношению к омепразолу, обусловливая более медленный метаболизм препарата [23]. Данное явление находит свое отражение в увеличении такого показателя, как площадь под кривой «концентрация в плазме–время» (AUC) [24]. Преимущества фармакокинетического профиля эзомепразола позволяют ему более эффективно и стабильно блокировать протонную помпу [23, 25].
Тем не менее омепразол до сих пор является широко назначаемым препаратом как в мире, так и в России. Более того, в России до 90 % от всех реализованных ИПП составляет этот препарат. В целом этот тренд во многом объясняется ценовой доступностью многочисленных генериков омепразола [26]. Однако стоит отметить, что в нашей стране нет единого реестра, в котором бы сравнивалась эффективность оригинального препарата и его генериков. В связи с использованием некачественных субстанций и вспомогательных веществ, а также малой доступностью ряда стран-производителей для контроля в сфере фармацевтической продукции (Индия, Китай, Пакистан, и др.), генерик не всегда обладает должной биологической, фармацевтической и терапевтической эквивалентностью с оригинальным препаратом. В связи с этим в настоящее время практикующий врач нередко сталкивается с проблемой недостаточной эффективности генериков [27].
Как уже было сказано выше, существенным доводом в пользу назначения генериков всегда была их меньшая стоимость по сравнению с оригинальным препаратом. Однако с 2013 г. это преимущество было нивелировано компанией AstraZeneca за счет существенного снижения цены на оригинальный препарат омепразола Лосек МАПС.
Обращает внимание, что данный препарат выпускается в форме высокотехнологичной таблетки МАПС (англ. MUPS – от Multiple Unit Pellet System). Эта лекарственная форма омепразола запатентована компанией «AstraZeneca» как самостоятельная ввиду ряда структурных особенностей. Каждая МАПС-таблетка состоит из множества микрогранул омепразола (1000), покрытых дополнительной энтеросолюбильной защитной оболочкой. Благодаря такой оболочке активнодействующее вещество не подвергается агрессивному воздействию СК, и омепразол высвобождается лишь в щелочной среде двенадцатиперстной кишки, что обеспечивает предсказуемый и воспроизводимый антисекреторный эффект [20].
Заключение
Резюмируя вышеизложенное, можно заключить, что в XXI в. неуклонно растет число пациентов, страдающих КЗЗ. Мероприятия, направленные на модификацию образа жизни (характер питания, его регулярность), являются важным аспектом, который должен разбираться с данной категорией пациентов его лечащим врачом. Однако интенсификация жизни такова, что диетические мероприятия не приносят стойкого эффекта и вынуждают пациентов к приему ИПП в качестве курсовой терапии или в режиме «по требованию». Лекарственная форма Лосек МАПС обеспечивает надежный антисекреторный эффект в силу содержания множества кислотоустойчивых микрогранул омепразола, опосредуя высвобождение активного вещества лишь в щелочной среде двенадцатиперстной кишки. Недавнее cнижение стоимости Лосека МАПС, безусловно, обеспечивает большую доступность оригинального высококачественного препарата для пациентов и является хорошей предпосылкой к возвращению его в широкую клиническую практику.



