Сегодня адекватное лечение рака молочной железы (РМЖ) связано прежде всего с определением молекулярно-генетического подтипа опухоли. Классификация РМЖ на основе экспрессии иммуногистохимических маркеров была впервые сформулирована Moll в 1982 г., когда он предложил разделить опухоли на «люминальные» и «базальные» в зависимости от того, какие цитокератины в них экспрессируются. В 1987 г. Darkiee описал связь между ранними рецидивами РМЖ и экспрессией базальных цитокератинов. В 1998 г. Malzahn обратил внимание на то, что базальные РМЖ, как правило, низкодифференцированные, эстрогеннегативные и имеют плохой прогноз. В 2000 г. Perou и соавт. использовали микрочипы, содержащие гибридизационные пробы к 8102 мРНК, для получения индивидуального экспрессионного профиля опухоли [1]. Согласно этой молекулярно-генетической классификации, выделяются следующие варианты РМЖ, различающиеся по прогнозу и чувствительности к различным видам лекарственной терапии [2]:
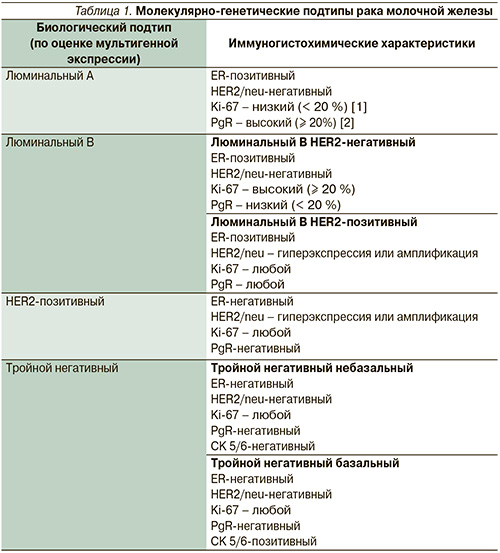
- Люминальный А: ER(+) и/или PgR(+)/HER2/neu(-);
- Люминальный B: ER(+) и/или PgR(+)/HER2/neu(+);
- HER2/neu-позитивный: ER(-)/ PgR(-)/HER2/neu(+);
- Базальноподобный: ER(-)/PgR(-)/HER2/neu(-).
Данная классификация является суррогатной, т.к. далеко не полностью отражает уровни экспрессии различных белков, выявленных молекулярно-генетическими исследованиями и более полно отражающих биологические свойства опухоли. Многое зависит также от критериев оценки иммуногистохимических реакций. До сих пор нет единого мнения о пороговых значениях экспрессии рецепторов эстрогенов. Разные авторы считают эстрогенпозитивными новообразования, в которых при иммуногистохимическом исследовании положительно окрашивается 10 % [3, 4], 5 [5] или даже 1 % клеток [6]. На основании новых исследований по результатам химиотерапии [7] молекулярно-генетическая классификация была дополнена и расширена (табл. 1).
Поскольку генетический анализ – довольно дорогой способ диагностики, в последнее время был проведен ряд исследований, сопоставлявших уровни экспрессии белков и активности генов. Это позволяет использовать иммуногистохимические методы для выявления молекулярно-биологических свойств опухоли и определения молекулярно-генетического подтипа РМЖ.
Особый интерес сегодня вызывает т.н. тройной негативный рак (ТНР) [8, 9]. Он характеризуется отсутствием экспрессии стероидных гормонов (ER и PgR) и амплификации гена HER2 и составляет, по данным разных авторов, от 11 до 22 % всех карцином молочной железы [10–12]. ТНР встречается преимущественно среди молодых женщин и в период пременопаузы; характерен для определенных этнических групп [11]. Так, в США этот тип РМЖ встречается чаще среди афроамериканок и женщин испанского происхождения [12]. По данным G. Morris и др., частота тройного негативного рака среди афроамериканок и белых больных составляет 20,8 и 10,4 % соответственно [13].
Долгое время считали, что все опухоли, имеющие ТНР, – базальноподобные, согласно классификации Perou. Впервые базальноподобный подтип опухолей выделил Wetzels в 1989 г., обнаружив в исследованных карциномах экспрессию маркеров, характерных для клеток, расположенных в эпителии базально, т.е. лежащих на базальной мембране [14]. При изучении экспрессии РНК было выявлено, что карциномы с тройным негативным фенотипом – более разнородная группа, включающая базальноподобный РМЖ, «claudin-low» РМЖ и другие вновь выявленные подтипы (табл. 2) [2, 15–17]. Исходя из этого становится понятным, что для определения истинно базальноподобного РМЖ недостаточно стандартных маркеров (ER, PgR, HER2/neu), необходимо использовать дополнительно кератины (5/6, 8/18), EGFR, виментин, ламинин, остеонектин, кавеолин-1, NGFR [18–20]. Гистологические варианты РМЖ с тройным негативным фенотипом включают протоковый, медуллярный, метапластический, реже – аденокистозный [21].
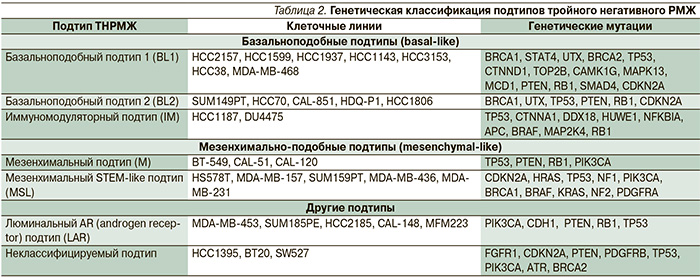
Базальноподобный рак составляет 8–20 % всех случаев РМЖ и 70 % карцином с тройным негативным фенотипом, чаще встречается среди лиц молодого возраста. Гистологически в большинстве случаев представлен инвазивной сосочковой карциномой (43 %), крибриформной (7,7 %), муцинозной (21 %), чистой тубулярной (4,2 %), смешанной тубулярной (11,4 %), тубуло-лобарной (16,7 %), смешанной протоково-дольковой (17,6 %), апокриновой и редко – медуллярным или метапластическим типами. Как правило, наблюдаются низкая степень дифференцировки, выраженный клеточный полиморфизм, высокое ядерно-цитоплазматическое соотношение, высокий митотический индекс, выраженный апоптоз, центральные и угревидные некрозы [22–25].
В основе агрессивного фенотипа базальноподобных опухолей лежит соответствующий генотип, свидетельствующий о происхождении из наименее дифференцированных, возможно даже стволовых, клеток [26]. Характерной чертой базальноподобных опухолей является выраженная нестабильность, в частности наибольшая частота дупликаций и делеций ДНК, что свидетельствует о нарушении механизмов репарации ДНК, а также поломки сигнального пути BRCA-1 [27, 28].
В настоящее время имеются определенные трудности в определении базальноподобного типа, поскольку стандартное иммуногистохимическое исследование включает ER, PgR и HER2/neu, а для определения базальноподобного типа необходимо дополнительное выявление базальных цитокератинов. Как уже отмечалось, не всякий рак с тройным негативным фенотипом базальноподобный [10]. По некоторым данным, только 70–91 % опухолей молочных желез с тройным негативным фенотипом являются истинно базальноподобными, в то время как остальные представляют собой другие биологически разнородные молекулярные подтипы [9]. С другой стороны, не всегда базальноподобный рак характеризуется отсутствием ER, PgR и HER2/neu. Например, в 14 % образцов базальноподобного рака была обнаружена экспрессия ER и HER2/neu [15, 29].

С появлением толстоигольной биопсии под контролем ультразвукового исследования значительно расширились возможности дооперационной диагностики РМЖ. При выполнении данного вида биопсии имеется возможность получения достаточного объема материала, особенно при взятии 2–3 трепанобиоптатов, позволяющих не только установить гистологический вариант и степень дифференцировки рака, но и провести дополнительные иммуногистохимические и молекулярно-генетические исследования. Это особенно актуально для неоадъювантной терапии. Следует обратить особое внимание на условия фиксации, которые отражаются на качестве иммуногистохимического исследования и гибридизации in situ. Материал должен фиксироваться исключительно в 10 %-ном растворе нейтрального забуференного формалина, т.к. все тест-системы для определения таргетных макромолекул (ER, HER2/neu и т.п.) разработаны и клинически апробированы только для этого фиксатора. Объем используемого фиксатора должен в 10 раз превышать объем фиксируемого образца ткани. Оптимальное время фиксации для операционного материала – 24–48 часов, биопсийного – 6–8. Фиксацию проводят при комнатной температуре (15–25 °C). Необходимо также тщательно соблюдать методические аспекты проведения иммуногистохимического исследования и гибридизации in situ. Кроме того, большое значение имеет адекватная оценка результатов проведенных исследований, которая зависит прежде всего от уровня квалификации специалиста. Однако нельзя не отметить, что определенные трудности обусловлены гетерогенностью, характерной для многих опухолей. Поэтому необходимо в биопсийном материале получать несколько фрагментов первичной опухоли, а при сомнительных результатах по операционному материалу исследовать дополнительный блок.
Не менее важно оценить степень повреждения опухоли в результате проведенного лечения. Для оценки эффективности лечения необходимо изучить остаточную опухоль или ложе удаленной опухоли. Патолог должен установить и указать макроскопический размер остаточной опухоли, а также расстояние от края резекции.
Изменения в остаточной опухоли могут быть различными. Чаще карцинома уменьшается в размере, и снижается число клеток в ней. Необходимо указывать размер и клеточность остаточной опухоли, т.к. распространенность резидуальной инвазивной карциномы наряду со статусом лимфатических узлов является важным прогностическим фактором. В некоторых случаях выявляются дистрофические изменения клеток (рис. 1).
Наблюдается выраженный фиброз с наличием лимфо-гистиоцитарной инфильтрации, обилием ксантомных клеток, «лечебных» гигантов, ангиоматоз. Степень лечебного патоморфоза определяется в соответствии с выбранной системой оценки.
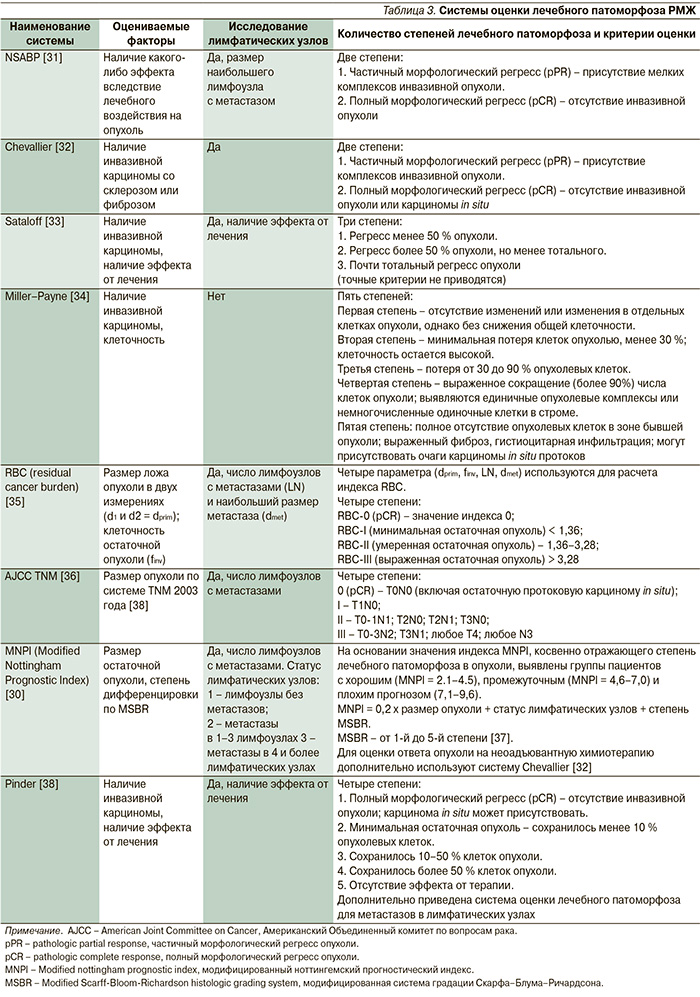
Существует более 8 систем для оценки степени ответа на терапию (табл. 3).
Некоторые исследователи сравнивают карциномы до и после терапии (Miller–Payne, Pinder), другие определяют размер остаточной опухоли (AJCC). В нашей стране по сей день широко используется определение лечебного патоморфоза по Г.А. Лавниковой. Эта система базируется на оценке повреждения опухоли и включает четыре степени лечебного патоморфоза. Однако для общего понимания и участия в международных протоколах необходимо применять системы, распространенные за рубежом. Одним из таких индексов может служить MNPI [30]. Таким образом, патологоанатом оценивает ответ опухоли на лечение по принятому в данной клинике протоколу.
В части случаев удается добиться полной резорбции опухоли, однако патологоанатому необходимо быть крайне осторожным и избегать ошибочных заключений, связанных с неадекватным исследованием материала. Хирург должен указывать в направлении на гистологическое исследование размеры и локализацию первичной опухоли по данным пальпации и лучевых методов исследования до начала лечения. Кроме того, необходимо отразить дозы и сроки неоадъювантной терапии. При макроскопическом исследовании морфолог описывает обнаруженные изменения в зоне локализации первичного очага, тщательно измеряет остаточную опухоль, берет для микроскопического исследования адекватное размеру узла число фрагментов. Если опухоль визуально не определяется, зона, указанная в направлении, исследуется тотально, т.к. только в этом случае можно достоверно подтвердить полную резорбцию опухоли. Кроме того, при гистологическом исследовании следует обращать внимание на характерные изменения ткани после «ухода» опухоли.
В зоне предсуществовавшей карциномы, как правило, выявляются участки фиброза и некроза, очаги лимфо-гистиоцитарной инфильтрации с наличием многоядерных гигантских клеток (рис. 2, 3).
В случае рецидива болезни новые очаги опухоли подлежат обязательному морфологическому, иммуногистохимическому и молекулярно-биологическому исследованию, поскольку тип рака может изменяться.
Успех лечения РМЖ зависит прежде всего от верификации диагноза.
При этом помимо классического гистологического описания должны быть учтены молекулярно-биологические характеристики опухоли. Определение последних требует выполнения ряда стандартизованных процедур, без которых резко возрастает вероятность ошибочного заключения и как следствие – неадекватного лечения.
Оценка изменений опухоли после неоадъювантной терапии заслуживает особого внимания, поскольку результатом этих данных определяется выбор дальнейшей тактики лечения и прогноз.



