Рассеянный склероз (РС) – хроническое аутоиммунное заболевание центральной нервной системы (ЦНС), характеризующееся демиелинизацией и аксональным повреждением.
РС обычно диагностируется у лиц молодого и среднего возраста (20–40 лет). Принято считать, что он редко встречается среди детей, между тем 5 % всех случаев РС составляют педиатрические пациенты [1, 2]. Отмечены случаи РС в грудном и раннем детском возрасте, пик заболеваемости приходится на пубертатный период [3].
Традиционно Т-клетки считают главным фактором, ответственным за иммунну 9-ю атаку структур ЦНС, в частности миелина. Самые последние данные демонстрируют более сложную картину, где B-лимфоциты, антитела и врожденный иммунитет также участвуют в повреждении тканей и не только миелина, но и аксона, корковых нейронов и перехвата Ранвье [4]. Особенностью детского возраста является повышенная реактивность иммунной системы и незрелость определенных механизмов регуляции.
В соответствии с Международным консенсусом клинических критериев детский РС, как и взрослых, определяется несколькими эпизодами демиелинизации ЦНС, разделенных во времени и пространстве [5–8].
У детей наиболее часто встречается рецидивирующе-ремиттирующий тип течения РС, который имеет относительно благоприятный прогноз [9, 10]. В некоторых случаях ремитирующее течение заболевания сменяется вторично-прогрессирующим РС (ВПРС), для которого характерно постепенное нарастание неврологических расстройств с периодами обострений или без них [11]. При первично-прогрессирующем РС отмечается неуклонное нарастание симптомов с момента начала заболевания, у детей он встречается относительно редко [12].
В терапии РС своевременная диагностика и назначение адекватной терапии важны. Несвоевременное неадекватное лечение приводит к значительной инвалидизации пациентов и иногда представляет угрозу жизни пациента.
Тактика лечения обострений РС у детей хорошо известна: кортикостероиды (метилпреднизолон) вводят в дозе 20–30 мг/кг массы тела (максимальная суточная доза – 1 г) внутривенно капельно ежедневно или через день в течение 3–5 дней с последующим недлительным пероральным приемом. Противовоспалительное и иммуносупрессивное влияние кортикостероидов наиболее эффективно в острую стадию патологического процесса. Если, несмотря на проведенную пульс-терапию, не наблюдается клинического улучшения состояния пациента (кортикорезистентность) или при снижении дозы кортикостероидов отмечается ухудшение состояния пациента (стероидная зависимость), может быть эффективным внутривенное введение препаратов иммуноглобулина (Гамунекс, Октагам). Плазмаферез рекомендуется проводить в качестве альтернативного лечения при частых обострениях РС у детей во избежание побочных эффектов от введения кортикостероидов.
 Превентивная терапия. В педиатрической популяции не проводилось рандомизированных контролируемых клинических исследований эффективности применения препаратов, изменяющих течение РС. Применение этих препаратов в детской практике базируется на результатах клинических исследований взрослых и ретроспективного анализа опыта эмпирического лечения РС у детей. Полученные результаты свидетельствует об эффективности и безопасности применения интерферонов-β (ИНФ-β) у детей и подростков [13–15]. Эти препараты относятся к 1-й линии терапии РС, и сюда входят внутримышечный ИНФ-β-1a (30 мкг 1 раз в неделю), подкожный ИНФ-β-1а (22 или 44 мкг 3 раза в неделю), подкожный ИНФ-β-1b (8 млн ЕД через день) и глатирамера ацетат (20 мг/сут). Глатирамера ацетат все еще не одобрен для лечения РС у детей.
Превентивная терапия. В педиатрической популяции не проводилось рандомизированных контролируемых клинических исследований эффективности применения препаратов, изменяющих течение РС. Применение этих препаратов в детской практике базируется на результатах клинических исследований взрослых и ретроспективного анализа опыта эмпирического лечения РС у детей. Полученные результаты свидетельствует об эффективности и безопасности применения интерферонов-β (ИНФ-β) у детей и подростков [13–15]. Эти препараты относятся к 1-й линии терапии РС, и сюда входят внутримышечный ИНФ-β-1a (30 мкг 1 раз в неделю), подкожный ИНФ-β-1а (22 или 44 мкг 3 раза в неделю), подкожный ИНФ-β-1b (8 млн ЕД через день) и глатирамера ацетат (20 мг/сут). Глатирамера ацетат все еще не одобрен для лечения РС у детей.
По результатам опубликованных данных, около 40 % детей, больных РС, прекращают лечение вследствие непереносимости, токсичности, сохраняющихся рецидивов или несоблюдения режима приема, что обусловливает необходимость разработки новых методов лечения этой группы пациентов [16].
Препараты превентивной терапии РС, к сожалению, менее эффективно сдерживают течение прогрессирующих форм заболевания. При дальнейших клинических обострениях или «немом» прогрессировании (неврологический дефицит нарастает в отсутствие новых рецидивов или признаков активного воспаления при проведении магнитно-резонансной томографии – МРТ) РС можно трактовать как рефрактерный. В этих условиях рекомендуются отмена ИНФ и переход к препаратам 2-й линии.
Показания к замене терапии (притом пациент получает лечение полной дозой ИНФ-β в течение ≥ 6 месяцев и неукоснительно соблюдает схему приема препарата):
а) учащение или отсутствие урежения обострений и/или появление новых очагов в T2-режиме МРТ или нарастание объема поражения на МРТ по сравнению с предыдущим лечением;
б) ≥ 2 клинических обострений и/или подтвержденных на МРТ в течение 12 месяцев [17].
Таким образом, переход к препаратам 2-й линии должен быть оправдан только при явной неэффективности и прогрессировании заболевания в течение 6–12 месяцев лечения ИНФ или при развитии выраженных побочных эффектов.
Лечение рефрактерных форм детского РС. Для лечения рефрактерных форм детского РС можно рассматривать несколько новых иммуномодулирующих средств: натализумаб – препарат на основе моноклональных антител к молекулам адгезии, химиотерапевтические средства (циклофосфамид – ЦФ, митоксантрон) и препараты с новыми механизмами действия (например, финголимод, терифлуномид и диметилфумарат – BG-12). Из них в России одобрены для лечения РС у взрослых натализумаб, финголимод, митоксантрон.
Натализумаб показал свою эффективность в ряде исследований взрослых, но в настоящее время нет достоверных данных об эффективности его применения у детей.
Митоксантрон и ЦФ рассматриваются в качестве средств терапии 2-й линии выбора при РС у детей [18–21].
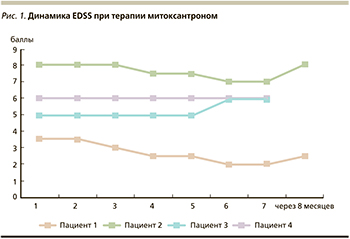
Собственный опыт лечения пациентов с рефрактерными формами РС митоксантроном ограничивается 4 клиническими случаями, каждый из которых тщательно проанализирован. Митоксантрон назначали в дозе 12 мг/м2 внутривенно капельно каждые 3 месяца в течение 2 лет. Результат проведенной терапии отражен на рис 1.
У пациента 1 после 8 месяцев ремиссии отмечено клинико-радиологическое обострение. Побочным действием препарата стал агранулоцитоз. У пациента 2 увеличилось число контраст-позитивных очагов на МРТ. У пациента 3 на фоне лечения митоксантроном было зафиксировано клинико-радиологическое обострение. И только пациент 4 не имел рецидивов заболевания на протяжении всего курса терапии (2 года), но после окончания лечения вновь наступило обострение.
К особенностям режима применения митоксантрона относится необходимость длительного курса лечения без возможности проведения пульс-терапии при обострениях РС в связи с крайне высоким риском кардиотоксичности. Накопленный, хотя и небольшой, опыт лечения митоксантроном позволяет сделать следующее предварительное заключение: митоксантрон стабилизирует состояние пациентов, позволяет добиваться относительной, но нестойкой ремиссии, имеет ограниченные показания и не может рассматриваться как средство неотложной помощи при жизнеугрожающих состояниях.
В настоящее время в мире накоплен определенный опыт проведения высокодозной химиотерапии с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (Ауто-ТГСК) при ВПРС [24, 25].
 В качестве источника гемопоэтических стволовых клеток используют клетки периферической крови, как правило, мобилизованные с помощью гранулоцитарного колониестимулирующего фактора (Г-КСФ) и ЦФ.
В качестве источника гемопоэтических стволовых клеток используют клетки периферической крови, как правило, мобилизованные с помощью гранулоцитарного колониестимулирующего фактора (Г-КСФ) и ЦФ.
Современным стандартом проведения трансплантаций при РС служит использование немиелоаблативного режима химиотерапии: ЦФ + антитимоцитарный глобулин (АТГ). Эта схема лечения показала свою эффективность и меньшую токсичность [22].
В последние годы активно изучается эффективность мезенхимальных клеток в лечении РС. Было показано, что терапия стволовыми клетками мезенхимального происхождения позволяет добиваться ингибирования Т-клеточного ответа на стимуляцию аллоантигенами, митогенами и микроорганизмами in vitro, снижения экспрессии CD4+-активационных маркеров, CD25+, CD38+, CD69 и Т-клеточной активации in vivo. Стволовые клетки мезенхимального происхождения способствуют увеличению содержания Т регуляторных клеток CD4+, CD25+, CD127low (Т-регуляторы), снижению пролиферации В-лимфоцитов и подавлению продукции ИНФ, интерлейкинов-4 и -10 (ИЛ-4, -10). Регуляторные Т-клетки подавляют пролиферацию цитотоксических Т-лимфоцитов, ингибируют активность естественных киллеров, макрофагов и В-клеток. Т-регуляторы обладают большим потенциалом в подавлении патологического иммунного ответа, наблюдающегося при аутоиммунных заболеваниях. При ряде аутоиммунных заболеваний (в т.ч. при РС) отмечено снижение числа и угнетение функции Т-регуляторов [23].
В настоящее время на базе Российской детской клинической больницы совместно с Российским национальным исследовательским медицинским университетом им. Н.И. Пирогова и Федеральным научно-клиническим центром детской гематологии, онкологии и иммунологии им. Д. Рогачева осуществляется выполнение трехстороннего клинико-лабораторного протокола по применению высокодозной химиотерапии с последующей Ауто-ТГСК у детей с тяжелыми рефрактерными формами РС. Цель исследования: оценить эффективность Ауто-ТГСК в случае крайне тяжелого рефрактерного течения РС у детей и подростков, а также уровень Т-регуляторов в контексте трансплантации гемопоэтических стволовых клеток.
Материал и методы
На данный момент по протоколу пролечены 9 пациентов с тяжелыми рефрактерными формами РС.
Необходимо отметить, что до начала соответствующей терапии все 9 пациентов получали ИНФ-β-1b, но обострения сохранялись. При попытке купирования обострений отмечено кортикорезистентность. Дополнительное использование в терапии внутривенного введения препаратов иммуноглобулина и проведение некоторым пациентам плазмафереза не дали значимого эффекта. Некоторые пациенты были пролечены митоксантроном. Таким образом, речь шла не только о кортикорезистентности, но и о рефрактерности практически ко всем базисным препаратам.
Абсолютным критерием включения пациентов в протокол стало наличие у пациентов двух и более стероид-рефрактерных клинико-МРТ-обострений за последние 6 месяцев. Данному критерию соответствовали все пациенты. При этом часть детей на момент начала терапии находились в очень тяжелом состоянии, один – в критическом с клинической картиной дыхательной недостаточности, тетраплегией и бульбарным синдромом (9 баллов по шкале EDSS – Expanded Disability Status Scale) c пролонгированным обострением, которое не купировалось вплоть до начала химиотерапии. Средний балл по шкале EDSS [24] обследуемой группы больных составил 6,16 ± 0,2 (4–9) балла.
Средний возраст пациентов на момент включения в исследование составил 16,0 ± 1,7 года. Период от первого эпизода демиелинизации до постановки достоверного РС составил 15,5 ± 4,1 месяца. Длительность заболевания на момент включения пациентов в исследование составил 28,8 ± 13,38 месяца. Все пациенты на момент проведения терапии имели ВПРС.
У всех больных, включенных в протокол, отмечены признаки выраженного воспалительного процесса в головном и спинном мозге по результатам МРТ.
Терапия выполнена в несколько этапов. После всех необходимых диагностических мероприятий пациентам проведена мобилизация стволовых клеток периферической крови препаратом ЦФ в дозе 2 г/м2 с последующим назначением Г-КСФ с 7-го дня от начала введения ЦФ. По истечении не менее 3 недель от начала терапии ЦФ выполнена химиотерапия в составе ЦФ (200 мг/кг, разделенных на 4 эквивалентные дозы на дни -5-й, -4, -3, -2-й), АТГ лошадиный (160 мг/кг в 4 эквивалентных дозах на дни -2-й, -1,+1,+2-й) или его аналог в скорректированной дозе. Трансфузия аутологичных стволовых клеток крови выполнена на день 0. Стимуляция гемопоэза Г-КСФ — с +5-го дня.
Всем пациентам проведена неврологическая оценка (EDSS, контроль инфекционных и токсических осложнений), МРТ головного и спинного мозга с контрастным препаратом, определение субпопуляционного состава лимфоцитов крови с оценкой Т-регуляторных клеток на +30-й, +60, +90, +180-й дни, далее каждые 6 месяцев.
Для анализа своевременности начала терапии пациенты были разделены на две группы: со своевременным (группа 1) и несвоевременным (группа 2) назначением высокодозной терапии с последующей Ауто-ТГСК, согласно рекомендациям рабочей группы по лечению аутоиммунных заболеваний European Group for Blood and Marrow Transplantation (EBMT) [25].
Статистическая обработка данных проведена с использованием тестов Колмогорова–Смирнова и Шапиро–Уилка. В случае связанных выборок при сравнении двух групп использован парный t-критерий Стьюдента и/или его непараметрический аналог – критерий Вилкоксона, в случае несвязанных выборок использован непарный t-критерий Стьюдента и/или его непараметрический аналог критерий Манна–Уитни.
Результаты
Длительность иммуносупрессивной терапии от момента фиксации рефрактерности до момента начала кондиционирования для 1-й группы составил в среднем 3,0 ± 0,3 месяца, а для 2-й – 12,0 ± 2,3. Различие между группами достоверно (р = 0,0007).
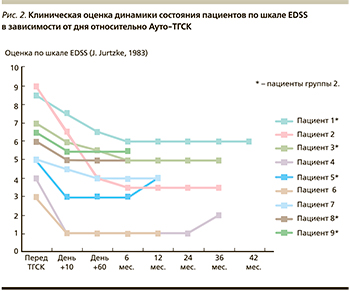
Состояние пациентов по шкале EDSS в период проведения терапии и после представлено на рис. 2. Так, у пациентов 1-й группы отмечено улучшение неврологического статуса уже в раннем посттрансплантационном периоде, что, вероятно, обусловлено действием ЦФ и АТГ. Оценка EDSS в первые 60 дней снизилась в среднем на 2,5 ± 0,21 балла, при этом в последующий период – лишь на 0,2 ± 0,02, что подтверждает теорию о значимом эффекте Ауто-ТГСК от иммуносупрессивных агентов, используемых в кондиционировании. Максимальное снижение балла по шкале EDSS в исследуемой когорте составило 5,5 балла (2,7 ± 0,3). У пациентов 4 и 6 (группа 1) EDSS соответствовало 1 баллу (минимальные признаки нарушений в 1-й функциональной системе).
При анализе гематологической и общесоматической составляющих протокола показано, что у пациентов после Ауто-ТГСК достаточно быстро происходило приживление лейкоцитарного ростка (лейкоциты > 1,0 т/мкл). В среднем приживление происходило на 11,2 ± 0,7-й дня, что сокращало период аплазии кроветворения и уменьшало риск возможных осложнений.
Осложнения проводимой терапии фиксировались в 66,7 % случаев (6 пациентов из 9), однако они не носили жизнеугрожающего характера и были представлены фебрильной нейтропенией (n = 4) и сывороточной болезнью (n = 2). Осложнения были купированы с помощью усиленной антибактериальной терапии и коротким курсом метилпреднизолона. Отдаленных осложнений не отмечено.
Все пациенты в настоящий момент наблюдаются в нашей клинике или в клинике для пациентов старше 18 лет. Период наблюдения в посттрансплантационном периоде на момент статистической обработки данных составил 6–42 месяца (21,1 ± 0,9).
У пациентов, терапия которых была начата своевременно, ее эффективность оказалась достоверно лучше. Так, в 1-й группе EDSS составил 3,12 ± 0,72 балла, во 2-й – 1,7 ± 0,41 (р = 0,01). Семь (77,7 %) пациентов из 9 в настоящий момент находятся в ремиссии. У 2 (у пациентов 4 и 5) пациентов отмечено обострение заболевания.
У пациента 4 повторное обострение случилось через 3 года после Ауто-ТГСК на фоне стрессовой ситуации. До того момента у пациента отмечены стабильные клинико-радиологические показатели и данные субпопуляционного состава лимфоцитов крови; эти два слова ни к чему не привязаны, поддерживающей терапии не требовалось. У пациента 5 повторное обострение случилось на фоне неудовлетворительных показателей иммунофенотипирования крови: значимого снижения иммунорегуляторного индекса, нарастания уровня CD8+-клеток.
При абсолютно рефрактерном к 1-й и 2-й линиям терапии течение РС высокодозная терапия с использованием ЦФ и АТГ с последующей Ауто-ТГСК оказалась эффективным методом купирования аутоиммунной воспалительной реакции. В ряде случаев данная терапия стала жизнесохраняющей, поскольку ЦФ способствовал быстрому и эффективному купированию воспаления. Зачастую эффект был виден на ранних сроках после начала терапии (мобилизация стволовых клеток и кондиционирование).
Разработанная схема кондиционирования с введением АТГ на +1-й и +2-й дни благоприятно влияла на последующее течение заболевания в связи с Т-деплецией in vivo уже трансплантированных клеток, снижая до минимума риск воздействия активированных Т-лимфоцитов на пациента.
Ключевыми показателями эффективности предложенной терапии стали стабилизация неврологической картины, отсутствие отрицательной динамики, по данным МРТ, нормализация показателей субпопуляционного состава лимфоцитов периферической крови и отсутствие выраженных осложнений.



