Актуальность проблемы
В России нет единой статистики распространенности хронического болевого синдрома (ХБС). В мире ХБС в настоящий момент рассматривается как самостоятельная болезнь, требующая этиопатогенетического лечения. Распространенность ХБС в популяции оценивается от 2 до 40–49 %. Особое значение ХБС имеет в онкологической практике, где на начальном этапе опухолевого процесса боль беспокоит около 50 % больных, при прогрессировании – 75 %, а в терминальной стадии до 90 % онкологических пациентов считают боль основным симптомом опухоли [1, 2]. Лечение хронической боли как онкологического, так и неонкологического генеза является до конца не решенной задачей. Всемирная организация здравоохранения приводит универсальный алгоритм терапии боли в онкологии – «обезболивающая лестница ВОЗ», который предписывает ступенчатое назначение анальгетиков – от неопиоидных к слабым опиоидам, а затем применяются при их неэффективности сильнодействующие опиоидные средства – морфин и синтетические опиоиды [World Health Organization, 1986; Vancouver Hospice Program, 1989] [3]. Этот фундаментальный алгоритм, составленный более 20 лет назад, останавливается на методике лечения сильной боли сильным опиоидом в сочетании с нестероидным противовоспалительным средством и адъювантным препаратом. При этом вопрос о терапии при прогрессировании боли выше 3-й ступени при неэффективности предложенного лечения остается без ответа. Следующим этапом при неэффективности консервативной терапии боли предложены инвазивные методики. Интервенционные методики лечения ХБС подразделяются на минимально инвазивные – такие, как нейромодуляция и нейростимуляция, и деструктивные операции, к которым относятся симпатэктомия, деструкция входной зоны задних корешков (DREZ), хордо- и цингулотомия. Особый интерес для функционально сохранных больных представляют минимально инвазивные методики. Под нейромодуляцией подразумевают метод терапевтического воздействия на функции нервной системы с помощью недеструктивных электрических и медиаторных средств. При выраженной спастичности и преимущественно невропатическом характере болей с успехом применяется хроническая электростимуляция. В онкологической практике, где боль чаще носит ноцицептивный характер, актуальным становится интратекальное введение лекарственных препаратов.
Этиологическим фактором 10 % хронических болевых синдромов остается онкологический процесс [3]. Группа больных с ХБС онкологического генеза чрезвычайно сложна. Если пациента с неонкологической болью присуща некая стабильная интенсивность боли, которая остается неизменной порой многие годы, то при лечении онкологической боли уже на ранних этапах лечения можно прогнозировать постепенный рост интенсивности боли как следствие расширения поверхности ноцицепции. Лечение хронической боли в такой ситуации всегда должно иметь резервы для расширения фармакологической поддержки. У онкологической боли в отличие от любой другой есть и патогенетические отличия. Возникновение и поддержание онкологической боли обусловлены активацией ноцицептров такими медиаторами, как простагландины, внеклеточные ионы водорода Н+, эндотелин-1, субстанция Р, интерлейкины и фактор некроза опухоли. Особенностью формирования онкологической боли служит способность болевых рецепторов возбуждаться не только в ответ на взаимодействие с воспалительными альгогенами, но и при специфическом воздействии опухолевых факторов, что способствует усилению восприятия и проведения болевых импульсов [4]. Восприятие болевых стимулов происходит на всех уровнях нейрооси – от периферии до коры головного мозга. На каждом из этих уровней действуют различные нейромодуляторные и нейроэндокринные механизмы. В настоящее время ни одну нейромодуляторную систему или отдельно взятый нейротрансмиттер нельзя расценивать как исключительный в рецепции или модуляции боли.
Эффекты введения морфина в спинномозговую жидкость изучаются с 1970-х гг., когда были открыты опиатные рецепторы и эндогенные опиаты. В 1979 г. французские исследователи во главе с Le Motte обнаружили опиоидные рецепторы в спинном мозге приматов [5]. С того времени опиоиды стали применяться с целью купирования острой и хронической боли. Морфин и другие опиоиды успешно применяются для купирования болевого синдрома при инфаркте миокарда, почечной колике, для обезболивания родов, а также для пролонгированного послеоперационного обезболивания у кардиохирургических, ортопедических и спинальных больных.
Помимо периферических ноцицепторов и проводников болевой чувствительности в системе восприятия боли участвует система модуляции боли, представленная на всех уровнях периферической и центральной нервной системы. Распределяясь в спинномозговой жидкости, морфин реализует свое действие через антиноцицептивную систему, представленную в спином мозге опиатными рецепторами.
При введении в спинномозговую жидкость (СМЖ) опиоиды сами распределяются между нервной тканью и СМЖ на основе их коэффициента разделения. Морфин, имеющий низкий коэффициент разделения, остается в пределах СМЖ в начальном количестве и медленно диффундирует в нервную ткань, отвечая за задержку начала действия и пролонгированную продолжительность эффекта. Кроме того, он способен мигрировать в краниальном направлении с возможностью достижения дыхательного центра в стволе головного мозга, обусловливая угнетение дыхания. С другой стороны, его преимущество заключается в том, что он может расширять анальгетическое действие далеко за пределы участка инъекции. Все другие опиоиды намного более, чем морфин, жирорастворимы и остаются в СМЖ в течение более короткого времени. Следовательно, они начинают действовать быстрее, а продолжительность их действия короче. Вероятность миграции этих агентов вверх намного меньше. По этой причине ниже и вероятность угнетения дыхания при использовании этих опиоидов, но при этом, для того чтобы иметь ожидаемый эффект, они должны вводиться вблизи требуемого участка действия. Улучшение качества анальгезии от действия опиоидов происходит в желатинозной субстанции. Нейроны желатинозной субстанции оказывают тормозное влияние на вставочные нейроны заднего рога и вызывают пресинаптическое торможение импульсов заднего корешка.

На фоне прослеживающейся тенденции роста общей выживаемости онкологических больных появляется группа пациентов с относительно контролируемым заболеванием, ожидаемой продолжительностью жизни более 3–6 месяцев, качество жизни которых снижается лишь некупируемой хронической болью.
Интратекальный путь предлагает много преимуществ: более быстрое начало действия, лучшую эффективность, низкие уровни в опиоидах крови и уменьшение побочных эффектов.
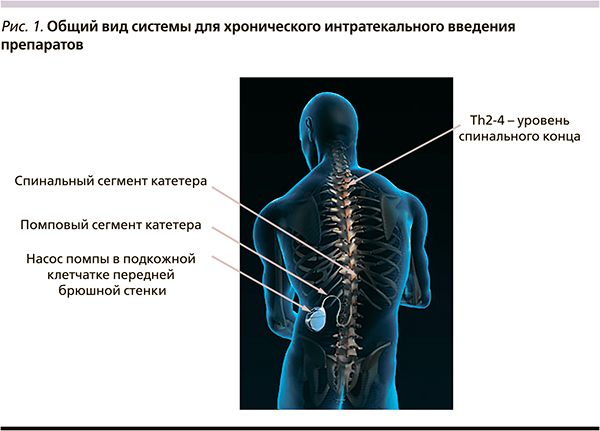
С учетом постоянного присутствия симптомов методом выбора являются закрытые стерильные системы, не требующие регулярных инвазивных процедур, обладающие минимальным количеством побочных эффектов, позволяющие варьировать дозу препарата в течение суток в зависимости от интенсивности боли, физической активности и «прорывов боли». Все более значимое место в лечении ХБС занимают высокотехнологичные инвазивные методы нейрохирургии. На схеме (рис. 1) представлен общий вид системы для хронического интратекального введения препаратов производства фирмы Medtronic, США. Конец спинального сегмента катетера расположен на уровне Th2–4 грудных позвонков. Катетер проходит интратекально, т. е. в субарахноидальном пространстве – между мягкой и паутинной мозговыми оболочками. Катетер подкожно соединяется с насосом помпы, расположенным в подкожной клетчатке передней брюшной стенки.
Для функциональной нейрохирургии принципиально существуют две большие группы пациентов: пациенты с болями на фоне основного злокачественного заболевания и пациенты с хроническими «незлокачественными» болями. В плане интратекальной опиоидной терапии мощные международные исследования посвящены “non-cancer pain” [6]. Группы онкологических больных относительно малочисленны (табл. 1). При этом во всех доступных работах подчеркивается их высокая эффективность именно при болях онкологического генеза [7–10].
Целью нашей работы стала разработка метода терапии тяжелых ХБС путем длительного интратекального введения микродоз морфина имплантируемой программируемой помпой для улучшения качества жизни больных, получающих высокие дозы опиоидных анальгетиков.
Материалы и методы
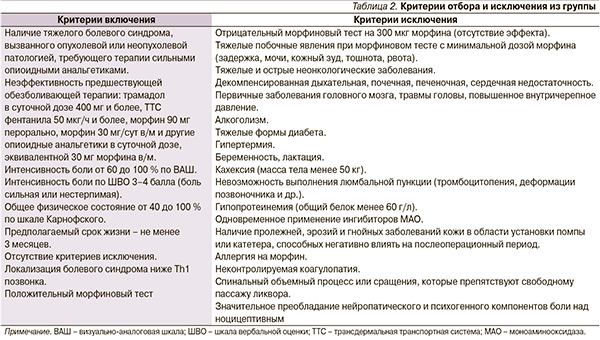
Стандартных показаний к установке морфиновой помпы до настоящего времени не сформулировано. Отбор онкологических больных для имплантации морфиновой помпы представляет сложную задачу, т. к. включает помимо определения локализации и интенсивности болевого синдрома оценку общесоматического статуса и ожидаемой продолжительности жизни. В западных исследованиях показано, что затраты на имплантацию и обслуживание морфиновой помпы окупаются после 3 месяцев отказа от комплексной анальгетической терапии III ступени обезболивания. Таким образом, мы предложили свой список показаний и противопоказаний (табл. 2).
В нашем материале рассмотрено лечение 10 больных с ХБС, из них 9 – с ХБС онкологического генеза и 1 – с неопухолевой патологией (с ятрогенным болевым синдромом, т. н. болезнью оперированного позвоночника). Средний возраст больных составил 59,9 года, причем самому пожилому больному из нашей группы был 81 год. Мужчин было 6 (66 %), женщин 3 (33 %).
У всех больных диагностирован ХБС интенсивностью 60–100 % по ВАШ (в среднем 96,1 ± 6,9), 8 больных страдали нейропатическим компонентом боли.
Пациенты ранее получали следующую анальгетическую терапию: налбуфин 80 мг/сут в сочетании с клоназепамом 1 мг/сут и трамадолом 300 мг/сут (у неонкологической больной); таблетки морфина продленного действия 180 мг/сут в сочетании с прегабалином 150 мг/сут и трамадолом 400 мг/сут; таблетки морфина продленного действия 150 мг/сут в сочетании с трамадолом 400 мг/сут и кеторолом; ТТС фентанила 75 мкг/ч в сочетании с трамадолом 400 мг/сут и промедолом 20 мг/сут; морфин 3 мл/сут в сочетании с оксикодоном 5 мг/сут и габапентином; ТТС фентанила 25 мкг/ч в сочетании с кеторолом. Проводимая терапия не обеспечивала адекватный контроль боли (средний показатель ВАШ на исходном этапе на фоне приема препаратов составил 84,1 ± 14,5) и требовала повышения доз препаратов, часто превышающих терапевтические. Побочные эффекты терапии опиоидными препаратами присутствовали у всех больных: головокружение, сонливость, запоры, атония мочевого пузыря, нарушение цикла сон–бодрствование, что отражалось на качестве жизни по шкале Карновского; средний балл составил 60 ± 10 баллов.
В план лечения на первом этапе входит морфиновый тест. Предварительно пациент за 12 часов отказывается от анальгетической терапии. В условиях отделения реанимации при мониторировании артериального давления, сердечного ритма, частоты дыхательных движений в минуту и пульсоксиметрии выполняется тестовое интратекальное введение расчетной дозы морфина от 100 до 300 мкг. Наблюдение больного на койке отделения реанимации составляет 2–3 часа. Оцениваются исходный болевой синдром по шкале визуальной оценки (ШВО) и DN4, время, за которое достигнут анальгетический эффект, а также интенсивность боли по ВАШ при развившемся анальгетическом эффекте. Затем при очевидном отсутствии побочных явлений пациент переводится в палату. В течение последующих суток производится оценка длительности анальгетического эффекта и побочных эффектов введенной дозы морфина.
В случае положительного морфинового теста пациенту возможна имплантация помпы. Вторым этапом в условиях операционной, под эндотрахеальным наркозом проводится установка катетера субарахноидально на уровне, соответствующем иннервации источника боли. Подкожно имплантируется программируемая морфиновая помпа, которая соединяется с введенным интратекально катетером. Помпа располагается между подвздошным гребнем и реберной дугой. Насос помпы имплантируется из линейного разреза на передней брюшной стенке длиной 10 см справа или слева (выбор определяется локализацией рубцовых изменений на передней брюшной стенке и желанием пациента), где формируется карман, в который помещается помпа и фиксируется четырьмя швами к апоневрозу.
Непосредственно после восстановления уровня сознания после наркоза производится программирование помпы в соответствии с необходимым расчетным объемом морфина в сутки. Дополнительно предусматривается и программируется доза и кратность введения морфина для купирования «прорывов» боли. Больные наблюдаются 5–7 дней – до снятия швов. Проводится ежедневная оценка эффективности обезболивания и возможных побочных эффектов. Далее больные наблюдаются в амбулаторном режиме не реже 1 раз в месяц в течение 3 месяцев. Предусматривается телефонный контакт 1 раз в неделю и чаще при необходимости. После 3 месяцев проводятся плановая оценка состояния больного, перезаправка помпы в условиях стационара, контроль ее работы. При необходимости проводится новый пересчет дозы морфина и перепрограммирование помпы.
Мы использовали морфиновые помпы Synchromed II компании Medtronic. Выбор определен возможностями гибкого программирования суточной и болюсных доз, доступностью компонентов для перезаправки. Надо заметить, что к настоящему моменту лишь помпы Synchromed II компании Medtronic разрешены к использованию совместно с морфином.
Интенсивность боли оценена по общепринятым шкалам оценки (ВАШ, ШВО) 3 раза в день с фиксированием данных в дневник пациента. Невропатический компонент боли оценен по шкале DN4.
Результаты
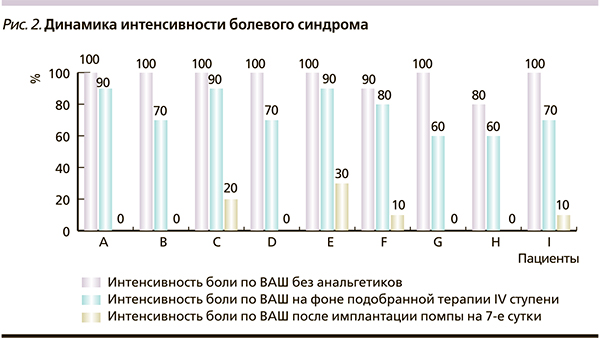
К 1-м суткам после имплантации помпы интенсивность боли у всех пациентов уменьшилась до 0–20 % по ШВО (рис. 2). Скорость введения морфина (базовая терапия), достаточная для контроля ХБС, варьировалась от 200 до 400 мкг/сут (в среднем 233,0 ± 68,7). Все пролеченные пациенты полностью прекратили прием опиоидных анальгетиков, принимаемых накануне.
Отмечены расширение физической активности 4 из 6 больных пациентов по шкале Карновского (в среднем 83,4 ± 11,0), отсутствие явлений медикаментозной седации, нормализация психологического состояния, улучшение общесоматического статуса. Однако у 2 пациентов с длительной историей приема опиоидных анальгетиков (более полугода) со вторых суток развился специфический абстинентный синдром, вызванный прекращением системного действия опиатов, что требовало симптоматической терапии в течение 4–10 суток. Эффект отмены коррелировал в зависимости от наркогенного потенциала препарата, использованного пациентом до имплантации морфиновой помпы. Наиболее сильный синдром отмены, длившийся в течение 4 суток, мы наблюдали у пациента, в течение 6 месяцев принимавшего морфин-сульфат континуум в дозе 30–60 мг. Недлительный (1–2 дня) синдром отмены мы лечили у пациентов после длительного использования ТТС с фентанилом и после регулярного применения промедола. Стабильно в течение суток длился абстинентный синдром у принимавших трамадол с адъювантами в высоких дозах. Мы были приятно удивлены полным отсутствием синдрома отмены у пациентки, в течение 1,5 лет получавшей по 20 мг налбуфина – опиоидного анальгетика без наркогенного потенциала. Еще одним описанным эффектом интратекального морфина является интенсивный кожный зуд, который мы наблюдали у двух больных однократно на исходе первых суток после имплантации. Побочный эффект успешно купирован.

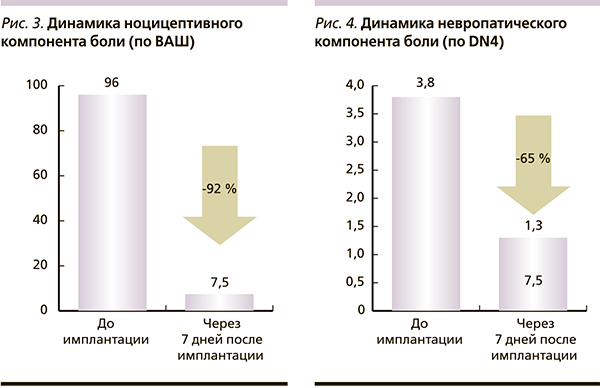
Все пациенты отметили более эффективное обезболивание, отсутствие системных опиоидзависимых побочных эффектов и повышение качества жизни после подбора программы индивидуального режима введения морфина помпой. Мы отметили, что при невропатических болях эффект опиоидов кажется менее выраженным или требуются дополнительные коанальгетики (например, прегабалин) (рис. 3, 4).
Тяжелых хирургических осложнений в нашем исследовании не наблюдалось. Из ожидаемых – образование серомы (1 пациент). В связи с образованием последней произведена ревизия зоны стояния насоса помпы с ее реимплантацией под апоневроз прямой мышцы живота.
Все пациенты отметили более эффективное обезболивание, отсутствие системных опиоидзависимых побочных эффектов и повышение качества жизни после подбора программы индивидуального режима введения морфина помпой. Мы отметили, что при невропатических болях эффект опиоидов кажется менее выраженным или требуются дополнительные коанальгетики (например, прегабалин).
Выводы
Морфиновые помпы были установлены 10 больным с тяжелым ХБС (9 онкологических больных и 1 с болью, вызванной миелопатией). Впервые в России апробирована методика хронической интратекальной терапии с помощью имплантируемых программируемых помп. Изучена динамика изменения боли в течение длительного времени после применения нейромодуляции в виде интратекальной терапии. Метод представляет собой обратимый, недеструктивный, нейромодуляторный вид терапии. Можно выделить несколько ключевых преимуществ хронического интратекального введения перед традиционными пролонгированными формами препаратов. На фоне интратекальной опиоидной терапии происходит улучшение качества жизни, уменьшение сонливости, отсутствие угнетения сознания. Отмечается уменьшение запоров, представляющих сложнейшую проблему терапии опиоидами. Пациент получает длительное облегчение боли и может контролировать количество вводимого препарата в зависимости от интенсивности боли и физической активности.
В целом мы оцениваем этот метод как перспективный для онкологических больных при соблюдении критериев отбора пациентов, детальном владении методикой имплантации и программирования помпы.


