Эпидемиология
По данным разных авторов, гранулезоклеточные опухоли (ГКО) яичников составляют 1–2 % всех опухолей яичников и 5–8 % от всех злокачественных опухолей яичников [1–4]. В Санкт-Петербурге, по последним данным Популяционного ракового регистра, ГКО заболевают в среднем 12–13 женщин в год, что составляет 2,23 % от всех опухолей яичников [2]. Возрастное распределение частоты заболевания ГКО имеет два возрастных пика: постменопаузальный и препубертатный; около 5 % случаев выявляется в препубертатном периоде и более 60 % – в постменопаузальном [3], причем опухоли, возникающие в разные возрастные периоды, имеют свои клинико-морфологические особенности, в связи с чем R. Young и R. Scully разделили все ГКО на два типа: взрослый и ювенильный [6].
Этиология и патогенез
Опухоли яичников представляют собой гетерогенную группу опухолей, включающую эпителиальные, герминогенные и опухоли стромы полового тяжа. Принятое у клиницистов деление опухолей яичников на эпителиальные и неэпителиальные весьма условно, поскольку экспериментальные исследования на животных моделях доказывают эпителиальное происхождение клеток гранулезы и их роль в развитии рака яичников [7]. J.L. Pitman и соавт. [7] в эксперименте доказывают гипотезу развития рака яичников из недифференцированных гранулезных клеток, происходящих из регуляторных герминогенных клеток, которые длительное время могут оставаться доброкачественными и в процессе онтогенеза прогрессировать в злокачественные опухоли с различным фенотипом. Этим авторы объясняют значительное распространение рака яичников к моменту его диагностики и, наоборот, возможность раннего выявления ГКО. ГКО длительно растут локально, а затем распространяются на соседние органы и внутрибрюшинно. Пути метастазирования ГКО до конца не ясны. Метастазирование обычно происходит на поздних стадиях заболевания [8].
Этиология ГКО, как и большинства эпителиальных опухолей яичников, неизвестна. Некоторые исследования свидетельствуют о предрасположенности к развитию ГКО яичников женщин, подвергавшихся стимуляции овуляции по поводу бесплодия [9, 10].
ГКО яичников отличаются своей способностью выделять половые стероидные гормоны (эстрогены) и гликопротеидный гормон ингибин, которые используются в клинике как опухолевые маркеры. Выраженная гормонзависимость ГКО определяет клиническую картину заболевания и чувствительность к гормонотерапии [8].
Гистологическая классификация и морфологическое строение
Первое описание ГКО было сделано Rokitansky в 1855 г. [11], но до сих пор вопрос о злокачественном потенциале ГКО окончательно не решен [3, 9, 10]. Согласно гистологической классификации опухолей яичников, ГКО относятся к новообразованиям стромы-полового тяжа, к которым помимо ГКО относятся опухоли группы тека-фибром и сертоли-стромальноклеточные опухоли. Международная гистологическая классификация Всемирной организации здравоохранения опухолей яичников последнего пересмотра (2003) предусматривает для каждого гистологического типа опухоли морфологический код злокачественности с учетом определенных морфологических параметров. Согласно этой классификации, ГКО яичников взрослого типа имеют морфологический код 8620/1, а ювенильного – 8622/1. Код под дробью, равный единице, означает, что данная опухоль по классификации относится к пограничным опухолям или опухолям с непредсказуемым течением [3]. Опухоли с выраженными морфологическими признаками злокачественности (клеточный полиморфизм и высокая митотическая активность) обозначаются морфологами как злокачественные ГКО (код 8620/3), но они наблюдаются гораздо реже [2].
Макроскопическая картина ГКО взрослого типа, к которым относят около 95 % всех ГКО, чаще всего имеет вид инкапсулированной опухоли со средними размерами 12–13 см, имеющей гладкую или дольчатую поверхность [3]. На разрезе опухоль кистозно-солидной структуры, серовато-желтого или желтовато-коричневого цвета. Обнаруживаются очаги геморрагий и некроза [3, 12]. Эта макроскопическая картина настолько типична для ГКО взрослого типа, что обнаружение во время операции опухоли яичника, имеющей на разрезе желтоватый цвет с кровоизлияниями, позволяет врачу заподозрить именно ГКО яичника. Взрослый тип ГКО включает пять морфологических подтипов, среди которых наиболее частый – микрофолликулярный, характеризующийся тельцами Call-Exner и включениями типа «кофейных зерен». ГКО взрослого типа значительно чаще (в 95 %) поражают только один яичник. Очень редко ГКО могут иметь полностью кистозную структуру [3]. Макроскопическая картина ГКО ювенильного типа мало чем отличается от таковой взрослого типа. При ювенильном типе ГКО чаще имеют лобулярное строение и признаки лютеинизации, редко обнаруживают тельца Call-Exner [3, 11, 13]. При иммуногистохимическом исследовании в ГКО определяется экспрессия CD99, ингибина А, виментина, цитокератина, калретинина, S-100 протеина и гладкомышечного актина-α. При этом ГКО негативны по отношению к цитокератину 7 и мембранному антигену эпителиальных клеток [14, 15]. Диагноз ГКО представляет значительные трудности для патологоанатома и требует большого опыта работы.
Клиническое течение
ГКО в отличие от эпителиальных опухолей (аденокарцином) яичников в большинстве случаев выявляются в ранних стадиях. Раннее выявление ГКО определяется их выраженной гормонзависимостью, связанной с продукцией опухолью эстрогенов. Проявление гиперэстрогении (нарушения менструального цикла, аменоррея, ациклические кровотечения и кровотечения в постменопаузе) обнаруживают около 66 % больных ГКО [4, 16]. Гиперэстрогенией обусловлено частое сочетание ГКО с гиперплазией эндометрия (4–10 %) и аденокарциномой эндометрия (5–35 %) [4, 11]. Поэтому при обследовании пациенток с подозрением на ГКО необходимо выполнять биопсию эндометрия.
Симптомы и клиника ГКО яичников зависят от возраста пациентки и ее репродуктивного статуса. Поскольку ГКО продуцируют стероидные гормоны, у девочек в препубертаном периоде развитие ГКО может проявляться ложным преждевременным половым созреванием. В репродуктивном возрасте ГКО проявляются в различных нарушениях менструального цикла, связанных с явлениями гиперэстрогении. В постменопаузальном возрасте наиболее частым симптомом ГКО являются нерегулярные маточные кровотечения, связанные с гиперэстрогенией и часто сопутствующей в этом возрасте ГКО яичников гиперплазией или аденокарциномой эндометрия.
К поздним симптомам ГКО относятся таковые, аналогичные эпителиальным опухолям яичников (боли и тяжесть внизу живота, увеличение размеров живота). Эти симптомы свидетельствуют о значительном распространении ГКО, прогноз которых при поздних стадиях крайне неблагоприятный.
Диагностика
Основными диагностическими служат лучевые методы (ультразвуковое исследование, магнитно-резонансная томография), данные которых свидетельствуют о том, что размеры ГКО варьируются от 1 до 30 см, а средний диаметр составляет около 12–13 см [11, 17]. Изображения, выявляемые при исследовании обоих типов ГКО, не отличаются и характеризуются как солидным компонентом, так и кистозным с многокамерными кистами. Сонно- и томографические изображения не специфичны для ГКО и не позволяют проводить адекватный мониторинг больных после лечения, которое с учетом возможности развития поздних рецидивов должно быть длительным [11, 17].
Опухолевыми маркерами при ГКО являются эстрадиол, ингибин и антимюллеровый гормон. Поскольку ГКО – это гормонально активные опухоли, продуцирующие эстрадиол, его повышение обнаруживается более чем у 80 % больных ранними стадиями. При прогрессировании заболевания и снижении дифференцировки опухоли снижается и уровень эстрадиола в крови. Ингибин – гликопротеидный гормон, существующий в двух формах: ингибин А и ингибин В. У женщин присутствуют обе формы ингибина. Они имеют разный профиль колебаний содержания в течение менструального цикла, связанный с изменениями уровня фолликулостимулирующего гормона (ФСГ). В крови постменопаузальных женщин уровень ингибина очень низкий (менее 5 мг/мл), что определяет его высокую специфичность как опухолевого маркера [18].
По данным C.H. Mom и соавт. [19], концентрация сывороточного ингибина А была повышена у 67 % исследованных пациенток при первичной постановке диагноза ГКО и у 58 % – при рецидиве заболевания, а инги-бина В – у 89 и у 85 % больных соответственно. Антимюллеровый гормон практически не определяется у женщин в препубертатном периоде и постменопаузе, а в репродуктивном периоде его уровень не превышает 5 нг/мл.
У больных ГКО антимюллеровый гормон повышается в 76–93 % случаев, при этом его уровень в крови может достигать 1124 нг/мл [20–22]. Антиген 125 (CA-125) не коррелирует с опухолевым прогрессированием при ГКО [11, 18, 23].
Лечение
Хирургическое лечение. Основной метод лечения ГКО – хирургический. Объем операции зависит от стадии заболевания и возраста пациентки. Большинство клиницистов сходятся во мнении, будто в отношении пациенток юного и молодого возраста при IА-стадии заболевания можно ограничиться односторонней аднексэктомией с адекватным хирургическим стадированием, что позволяет сохранять этим женщинам репродуктивную функцию [24–26]. В пре- и постменопаузальном возрасте предпочтение отдается радикальной операции в объеме экстирпации матки с придатками и удаление большого сальника с обязательным оптимальным хирургическим стадированием [24–30]. Как показывают данные литературы [31] и собственный опыт, при метастатических и рецидивирующих ГКО в связи с их поздним рецидивированием хороший эффект дают повторные циторедуктивные операции. Однако эффективность их снижается с каждым последующим рецидивом заболевания.
Химиотерапия. Влияние объема операции на прогноз заболевания в настоящее время не определено, как и не определена роль адъювантной химиотерапии [28–30, 32, 33]. В настоящее время признано, что при I стадии ГКО и благоприятном прогнозе можно ограничиться только операцией, тогда как при более распространенных процессах и неблагоприятном прогнозе целесообразно применение послеоперационной химиотерапии [34]. К основным препаратам лечения ГКО яичников относятся производные платины, этопозид, блеоцин, винбластин, доксорубицин, таксаны. В качестве I линии химиотерапии пациенток после радикального удаления опухоли обычно проводят 3 курса по схеме BEP (блеомицин, этопозид, цисплатин), а при оставшихся опухолевых очагах – 4 курса химиотерапии по той же схеме [34]. В широкомасштабное проспективное исследование GOG (Gynecologic Oncology Group) были включены 57 пациенток с ГКО яичников II–IV стадий, получавших в качестве I линии химиотерапии схему BEP. Исследование показало, что 69 % пациенток с распространенными стадиями и 51 % с рецидивами заболевания наблюдались без прогрессирования в течение трех лет, что, по мнению авторов, делает перспективным применение схемы BEP в качестве I линии химиотерапии пациентов с распространенными стадиями ГКО и рецидивами заболевания после хирургического лечения [35].
В качестве II линии химиотерапии рекомендуется использовать схемы PVB (цисплатин, винбластин, блеоцин), CAP (циклофосфан, доксорубицин, цисплатин) и TP (таксол, цисплатин) [30, 34, 36].
Гормонотерапия. Перспективным направлением паллиативного лечения рецидивов ГКО считается гормонотерапия на базе прогестагенов (мегестрол) и агонистов гонадотропин-релизинг-гормонов [34, 37, 38].
В обзоре R.D. Hardy и соавт. [8] приводятся данные о 22 ГКО, которые были прогестерон-рецептор-положительными, а 32 % из них были эстроген-рецептор-положительными. Применение авторами еженедельно чередующихся циклов мегестрола и тамоксифена позволило достигнуть пациенту с третьим рецидивом ГКО полной ремиссии через 22 месяца лечения и 5-летней безпрогрессивной выживаемости [8].
Аналоги гонадотропин-рилизин-гормонов (лейпролидацетата и др.) ингибируют высвобождение гонадотропин-рилизинг-гормона и таким образом ингибируют стероидгенез яичников. Это в свою очередь уменьшает стимуляцию клеток гранулезы [38, 39]. Проспективное исследование терапии лейпролид ацетатом 6 пациентов с рецидивами ГКО показало частичный ответ на терапию 40 % и стабилизацию – 60 % пациенток [40].
В настоящее время исследуется эффективность применения таргетной терапии, а именно ингибиторов mTOR в лечении ГКО яичников [41].
Лучевая терапия. Лучевая терапия ГКО яичников применяется в ограниченных случаях – при локализованных рецидивах или метастазах опухоли, а также при противопоказаниях к химиотерапии [33]. По данным J.K. Wolf и соавт., сообщающих о 14 пациентках с ГКО, получавших лучевую терапию по поводу клинически оцениваемых опухолевых узлов, эффект был получен от 6 (43 %) больных. Из них 3 пациентки наблюдались затем в течение 21 года без признаков рецидива заболевания, а остальные 3 имели рецидив в сроки от 4 до 5 лет. Остальные 8 (57 %) пациенток либо не ответили на лучевую терапию, либо имели прогрессирование заболевания [42]. Е. Choan и соавт. [43] сообщили о 3 случаях эффективной лучевой терапии в суммарной дозе 30–50 Грей больных рецидивной или остаточной ГКО яичников. При этом опухоли регрессировали на 85–90 %, а продолжительность ответа на лучевую терапию составила от 5 до 21 месяца.
Прогноз
Клинически непредсказуемое течение ГКО определяется тем, что от 10 до 50 % этих опухолей могут рецидивировать через длительный период времени после первоначального диагноза в сроки от 10 до 30 лет, при этом иметь агрессивный потенциал [4, 36, 44]. Если при I стадии ГКО 5-летняя выживаемость составляет 94–98 %, то при II–III стадиях – 70–44 % [45, 46]. При этом частота рецидивов возрастает со стадией заболевания от 5,4 % при I, до 21 – при II и 40 % – при III стадиях [47]. Тем не менее около 90 % ГКО взрослого типа диагностируются в I стадии заболевания, и именно в этой группе пациентов оценить прогноз очень трудно [17, 45, 48]. Особенно сложным представляется решение о выполнении органосохраняющей операции при I стадии ГКО. Такое решение должно основываться на оценке прогноза.
Неоспоримыми прогностическими факторами при ГКО считают стадию заболевания и оставшиеся опухолевые массы после выполненной операции [5, 11, 47]. Большинство авторов сходятся во мнении, будто размер опухоли больше 5–10 см неблагоприятно влияет на прогноз заболевания [4, 5, 12]. Некоторые исследователи считают, что возраст моложе 40 лет оказывает благоприятное влияние на прогноз, а разрыв опухоли во время операции – неблагоприятное влияние, хотя мнения по этим вопросам противоречивы [4, 6, 27, 49].
Прогностическое значение таких морфологических признаков, как степень дифференцировки, митотическая активность и полиморфизм опухоли при ГКО I стадии, когда особенно важно оценить прогноз заболевании, неоднозначно оценивается исследователями [5, 6, 11, 12, 49, 50]. Согласно данным некоторых исследований, экспрессия в ГКО мутантного гена p53 ассоциируется с плохим прогнозом, а экспрессия ингибина – с хорошим [51, 52].
Однако до сих пор ГКО как взрослого, так и ювенильного типов считаются «непрогнозируемыми опухолями», т. к. вопрос об их злокачественном потенциале окончательно не решен [5].
Собственные исследования
С целью повышения точности прогноза для больных при ГКО яичников взрослого типа мы совместно с А.В. Волковой и О.Ф. Чепиком предприняли клинико-морфологическое исследование [33, 53, 54]. Клинические факторы прогноза были изучены в отношении 62 первичных больных ГКО яичников взрослого типа I–IV стадий заболевания в возрасте от 21 до 77 лет, получавших хирургическое или комбинированное лечение в НИИ онкологии им. профессора Н.Н. Петрова с 1980 по 2002 г. Срок наблюдения за больными составил в среднем 129,4 ± 11,5 месяца (от 3 до 294 месяцев). I стадия заболевания была установлена 49 (79,1 %) пациенткам, II – 2 (3,2 %), III – 8 (12,9 %), IV стадия – 3 (4,8 %) больным. Только хирургическому лечению подверглись 16 пациенток с I стадией заболевания, 46 больным проведено комбинированное лечение, включившее операцию и химио- или лучевую терапию. Рецидивы заболевания возникли у 24 (38,7 %) больных. При этом опухоли I стадии рецидивировали в 12 (25 %) (Iа-стадии – в 9,1 %, Ib-cтадии – в 62,5 %), а III–IV стадий – в 11 (100 %) случаях.
Во время исследования был выполнен многофакторный анализ клинических, морфологических данных и результатов лечения ГКО яичников взрослого типа, полученных при детальном изучении историй болезни, протоколов операций, поликлинических карт, при пересмотре микропрепаратов и проведении иммуногистохимического исследования, а также в процессе динамического наблюдения за пациентками выполнен на основании анкеты, включившей 72 фактора. Оценено их влияние на прогноз заболевания. Помимо этого у 17 больных ГКО взрослого типа были изучены иммуногистохимические факторы (экспрессия антигена Ki-67, мутированного гена-супрессора р53, онкобелка HER2/neu и ингибина).
В результате проведенного исследования нами было установлено, что возраст больных, состояние их менструальной функции, срок наступления менархе и менопаузы, длительность симптомов заболевания, накопление асцитической жидкости, размеры, типы, варианты строения и гормональная активность опухолей, наличие в них патологических форм митозов и уровень сверхэкспрессии онкобелка HER2/neu не влияют на прогноз заболевания.
На прогноз ГКО яичников взрослого типа влияют такие факторы заболевания, как распространение опухоли за пределы капсулы, митотическая активность опухоли (число митозов), экспрессия антигена Ki-67, экспрессия мутированного гена-супрессора р53, экспрессия ингибина(см. таблицу).
При этом благоприятный прогноз ГКО ассоциировался с такими показателями, как I стадия заболевания, одностороннее поражение яичников, отсутствие распространения опухоли за пределы капсулы, низкий уровень митотической активности (≤ 3 митозов на 10 полей зрения), экспрессия антигена Ki-67 (≤ 10 %) и экспрессия мутированного гена-супрессора р53 (≤ 5,5 %), а также с высоким уровнем экспрессии ингибина (3 балла). Неблагоприятный прогноз, напротив, ассоциировался с распространенными стадиями заболевания (II–IV), двусторонним поражением яичников, распространением опухоли за пределы капсулы, высоким уровнем митотической активности опухоли (> 9 митозов на 10 полей зрения), экспрессией антигена Ki-67 (> 11 %) и мутированного гена-супрессора р53 (> 14 %), а также и низким уровнем экспрессии ингибина (≤ 2 баллов).
При этом минимальные ожидаемые показатели общей и безрецидивной выживаемости больных составили 144 и 118 месяцев соответственно у больных с благоприятным прогнозом и 84 и 36 месяцев соответственно у больных с неблагоприятным прогнозом.
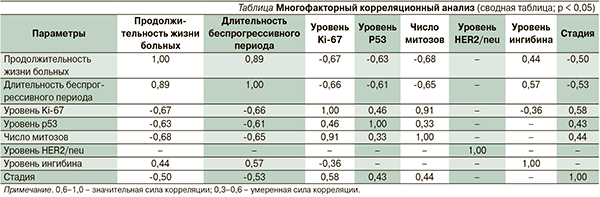
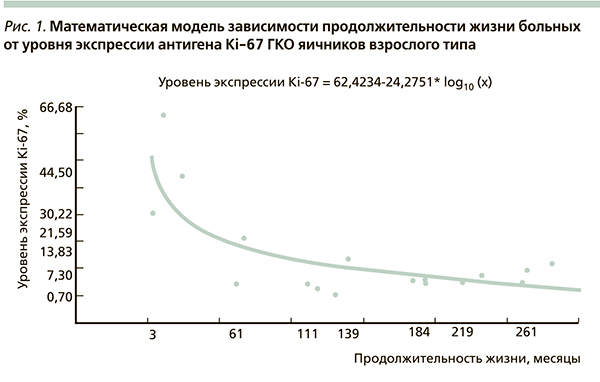
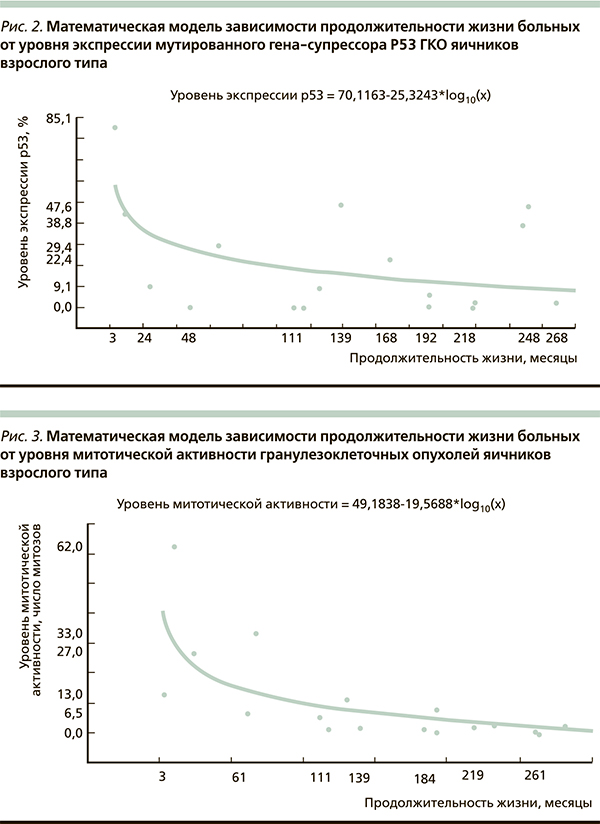
На основании проведенного исследования была предложена математическая модель зависимости продолжительности жизни больных и длительности беспрогрессивного периода заболевания от уровня экспрессии антигена Ki-67, мутированного гена-супрессора р53, митотической активности ГКО яичников взрослого типа (рис. 1–3), которая оказалась адекватной результатам клинических наблюдений с вероятностью р < 0,05.


