Несмотря на достижения в области изучения сахарного диабета (СД), хронические осложнения этого заболевания остаются серьезной проблемой для многих пациентов. Поражение нервной системы при СД приводит к развитию диабетической невропатии (ДН), частота которой варьируется от 30 до 90 %, прогрессивно нарастая по мере увеличения длительности диабета [1, 2]. Это одно из наиболее тяжелых осложнений СД, поскольку характеризуется ранней инвалидизацией пациентов и значительным ухудшением качества их жизни в целом. Тяжелые проявления ДН наблюдаются примерно у 10 % больных СД [3, 4].
Наиболее распространенной и хорошо известной формой ДН является дистальная невропатия (ДДН). В половине случаев она протекает бессимптомно, но в связи с утратой болевой чувствительности пациенты подвергаются высокому риску повреждения ног [1, 2, 5]. Известно, что ДДН лежит в основе развития 75 % случаев синдрома диабетической стопы, угрожающими проявлениями которого являются язвенно-некротические поражения, а наиболее тяжелым последствием – ампутация конечности [3, 6]. Частота последних у больных СД в 15–30 раз превышает таковую в общей популяции и составляет 50–70 % общего числа всех нетравматических ампутаций [1, 4, 7]. Вторая по частоте форма ДН – автономная невропатия, наблюдаемая среди 15–30 % больных СД 2 типа при постановке диагноза и у половины спустя 20 лет от начала заболевания. При этом существенно повышается смертность, особенно в случае нарушения иннервации сердца (рис. 1).
Проявления автономной невропатии крайне разнообразны и включают сердечно-сосудистые, желудочно-кишечные, урогенитальные нарушения и др. [8–10].
Центральная роль в патогенезе ДН принадлежит хронической гипергликемии, которая приводит к повреждению нервов и нарушению эндотелиальной функции. Известно, что риск развития ДН повышается на 10–15 % на каждый 1 ммоль/л подъема концентрации гликемии натощак или на 1 % уровня гликированного гемоглобина (HbA1c) [11]. Принято считать, что выраженные колебания концентрации глюкозы в крови с достижением высоких пиковых значений имеет большее повреждающее действие, чем постоянный высокий уровень гликемии.
Напомним, что утилизация глюкозы в нервной системе происходит по концентрационному градиенту независимо от уровня инсулина. В связи с этим нервная ткань, как, впрочем, и другие инсулиннезависимые ткани, не способна ограничивать поступление глюкозы при повышении ее концентрации в крови. Нервная ткань крайне уязвима в условиях внутриклеточной гипергликемии, т. к. при избытке глюкозы активируются альтернативные метаболические пути ее метаболизма, что способствует дегенерации и демиелинизации нервных волокон (рис. 2) [1]. Избыток глюкозы неизбежно используется по полиоловому пути (путь ее утилизации в инсулиннезависимых тканях), превращаясь в сорбитол. При этом внутриклеточное накопление сорбитола приводит к увеличению осмолярности межклеточного пространства, отеку нервной ткани, снижению скорости проведения импульса по миелиновым волокнам. Кроме того, подавляется синтез важного компонента миелина – миоинозитола, снижается активность Na+/K+-АТФазы. Накопление фруктозо-6-фосфата стимулирует гексозаминовый путь; повышение уровня дигидроксиацетонфосфата (DGAP) приводит к продукции глицеральдегид-3-фосфата, глицерин-3-фосфата и других метаболитов, активирующих путь протеинкиназы С [1, 2, 6]. Эти триозофосфаты являются предшественниками метилглиоксаля – основного вещества, приводящего к образованию конечных продуктов гликирования (КПГ). Внутриклеточная продукция КПГ, изменяя транскрипцию генов, структуру белков внеклеточного матрикса и циркулирующих белков крови, приводит к нарушению функции клеток, воспалению и сосудистым повреждениям. Последствием активации протеинкиназы C становится активация ядерного фактора κb (NFκb), что приводит к снижению продукции оксида азота, повышению уровней эндотелина-1, трансформирующего фактора роста β и ингибитора активатора плазминогена-1, нарушению кровотока и возникновению окклюзии капилляров.
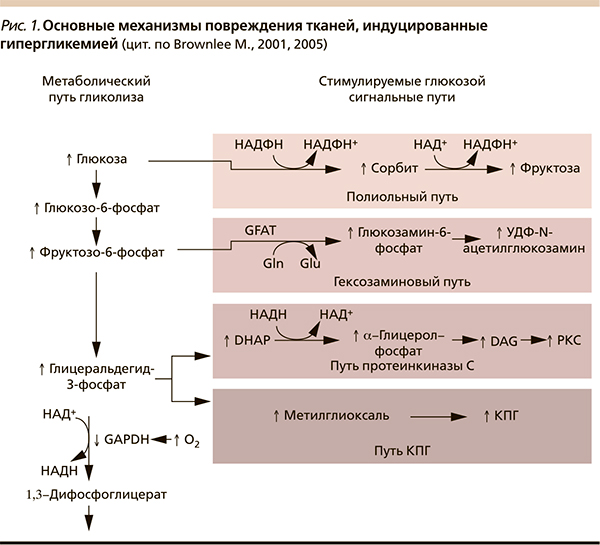
Несомненно, ведущая роль в развитии ДН принадлежит избыточному образованию активных форм кислорода в плазме крови, мембранах и цитоплазме клеток с последующим формированием оксидативого стресса. Известно, что патологические метаболические пути обмена глюкозы запускаются в ответ на повышенную продукцию супероксид-аниона в дыхательной цепи митохондрий (рис. 3) – процесс, вызванный хроническим избытком глюкозы [2, 6, 12]. Оксидативному стрессу способствует недостаточная эффективности антиоксидантной системы больных СД. Существуют и генетические предикторы развития ДН, которые активно изучаются.
Перечисленные механизмы приводят к сосудистым и метаболическим нарушениям, которые сначала проявляются обратимыми функциональными изменениями нервов, затем – тяжелым повреждением нервной ткани. Клинические проявления ДДН, как правило, возникают не ранее чем через 5 лет после манифестации СД 1 типа, а у части пациентов с СД 2 типа – одновременно с диагностикой заболевания [1, 7]. По данным исследования UKPDS, при постановке диагноза СД 2 типа ДДН обнаруживают в 30 % случаев [13]. Более того, в 11 % это осложнение выявляется и при нарушении толерантности к глюкозе [14]. Несмотря на то что ДДН встречается часто, осложнение чрезвычайно плохо диагностируется, особенно на ранних обратимых стадиях развития, когда своевременный диагноз особенно важен. Например, в исследовании GOAL A1c с участием 7892 больных СД 2 типа продемонстрировано, что правильный диагноз легких или умеренных форм ДДН был поставлен лишь трети пациентов [15]. Между тем при проведении комплексного электронейромиографического исследования латентные бессимптомные формы ДДН обнаруживаются у 90–100 % больных СД [7].
При ДДН могут быть поражены тонкие, толстые нервные волокна или те и другие, что и определяет особенности клинической картины. Как правило, ее симптоматика начинается с признаков поражения тонких сенсорных нервных волокон и проявляется снижением или потерей температурной и болевой чувствительности, в результате чего у больных СД возникают парестезии, покалывание, чувство зябкости, жжения и боли в конечностях [1, 2, 12]. При биопсии кожи голеней наблюдается снижение интраэпидермальной плотности нервных волокон и нарушение нейроваскулярного кровотока [7]. Возможна повышенная реакция на болевой раздражитель (гипералгезия) или прикосновение (гиперестезия), а также восприятие неболевого раздражителя как болевого (аллодиния), например болезненность от прикосновения простыни. В течение нескольких лет болезненные симптомы появляются преимущественно в покое, в ночное время – прежде всего в горизонтальном положении; затем упомянутые проявления становятся все более постоянными и интенсивными. Повреждение толстых сенсорных нервных волокон приводит к нарушению вибрационной и проприоцептивной (глубокой) чувствительности. Однако вовлечение в патологический процесс толстых волокон клинически проявляется не только сенсорным, но и моторным дефектом – наблюдаются гипо- и арефлексии, двигательные расстройства (нарушение тонуса сгибателей и разгибателей пальцев, атрофия мелких мышц стопы и межкостных мышц). Из-за снижения или полного отсутствия чувствительности ДДН часто протекает бессимптомно и остается незамеченной, однако предрасполагает к микротравматизации и последующему формированию язв нижних конечностей с длительным заживлением (11–14 недель) [1, 4, 6]. Одно из самых сильных страданий больных СД, трудно поддающихся терапии, – невропатическая боль, наблюдается у каждого десятого пациента с СД 1 типа и каждого третьего с СД 2 типа [1, 2, 15].
Автономная ДН во многих случаях выявляется на более поздних стадиях, т. к. даже при наличии нескольких функциональных нарушений часто не имеет никаких клинических симптомов [8]. Наиболее клинически важной ее формой является автономная кардиальная невропатия (АКН; «немая ишемия» и безболевой инфаркт миокарда) [9, 10]. В целях диагностики АКН разработаны и используются различные несложные функциональные тесты (см. таблицу).
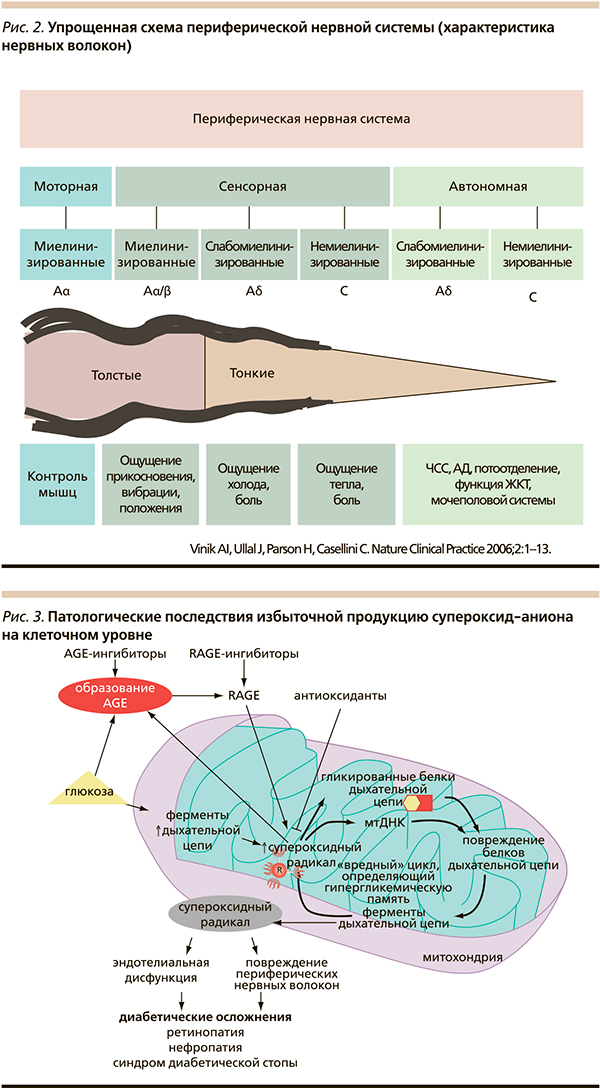
К другим проявлениям автономной ДН относят нарушение потоотделения, изменение цвета кожных покровов, нарушение функции желудочно-кишечного тракта, урогенитальную дисфункцию и т. д.
Ключевым направлением фармакотерапии ДДН остается комплексное воздействие на ведущее звено патогенеза – гипергликемию, тем не менее системный подход также предусматривает воздействие на все возможные патогенетические звенья этого осложнения [5, 11, 16]. В качестве фармакологических средств лечения ДДН в клинической практике широко используют жирорастворимое производное тиамина бенфотиамин [17, 18]. Дефицит тиамина сопутствует патогенезу ДДН [5, 19]. Проводя лечение этого осложнения СД, следует знать, что в отличие от водорастворимых препаратов витамина В1 бенфотиамин обладает гораздо большей биодоступностью. Так, бенфотиамин в 8–10 раз лучше всасывается в желудочно-кишечном тракте; кроме того, почти 100 % его дозы переходят в активную форму и легче проникают в нервную ткань. Бенфотиамин устойчив к действию тиаминаз-I и -II, что обеспечивает более высокую концентрацию тиамина в крови, чем при применении его традиционных препаратов. Важно, что после приема внутрь достаточно высокая концентрация бенфотиамина поддерживается в течение более длительного времени [5, 20]. Сравнительные исследования продемонстрировали, что в эквимолярных концентрациях биологическая эффективность бенфотиамина была в 10 раз выше, чем у традиционного препарата тиамина [17, 20].
Бенфотиамин вызывает значительный интерес как вещество, которое увеличивает активность транскетолазы – важнейшего фермента пентозофосфатного пути обмена глюкозы, и тем самым блокирует активацию патологических метаболических путей, активируемых в ответ на гипергликемию [21]. Низкое содержание тиамина в плазме больных СД приводит к снижению активности транскетолазы и, соответственно, пентозофосфатного пути утилизации промежуточных продуктов метаболизма глюкозы [5, 12, 19]. Принято считать, что кофактор транскетолазы – тиамина дифосфат, или тиаминпирофосфат, образуется путем фосфорилирования витамина B1. Проникая внутрь клетки и повышая концентрацию тиамина дифосфата, бенфотиамин вызывает рост активности транскетолазы до 400 %, таким образом устраняет «задержку утилизации» и эффективно блокирует аномальные пути метаболизма глюкозы: гексозаминовый путь, образование КПГ, активацию протеинкиназы С и NFκb [5, 18, 22]. Кроме того, бенфотиамин предотвращает эндотелиальную дисфункцию, вызванную КПГ [12, 19].
Активацию транскетолазы, согласно результатам недавних экспериментальных и клинических исследований, можно рассматривать как самостоятельную стратегию предупреждения микрососудистых осложнений СД, т. к. избыток метаболитов глюкозы при этом активно переходит в пентозофосфатный путь [5, 12, 19]. Плацебо-контролируемые исследования (BEDIP, BENDIP) продемонстрировали положительное влияние бенфотиамина на боль и сенсорные симптомы у больных ДДН [23, 24]. В двойном слепом исследовании BENfotiamine in DIabetic Polineuropathy приняли участие 165 пациентов с ДДН, которых разделили на 3 группы: 1-я группа принимала 600 мг бенфотиамина в день, 2-я – 300 мг этого препарата, 3-я – плацебо [24]. Невропатическая симптоматика (жалобы больных на боль, жжение, онемение и др.) почти в одинаковой мере уменьшались при использовании 300 и 600 мг бенфотиамина. В группах больных, получавших обе дозировки бенфотиамина, на 6-й неделе наблюдения по сравнению с исходным уровнем значительно улучшался неврологический статус (сила мышц, рефлексы, чувствительность), достоверно отличаясь от группы плацебо. Улучшение было более выражено в группе пациентов, принимавших бенфотиамин в более высокой дозе, и нарастало с продолжительностью лечения (p < 0,033). Наилучшие результаты по шкале TSS (Total Symptom Score) были получены для симптома «боль».
Следует подчеркнуть, что в обоих клинических исследованиях эффекты бенфотиамина были достигнуты без значительных изменений уровня HbA1c и содержания глюкозы в крови. Иначе говоря, отмечено влияние препарата на нарушенный метаболизм даже в условиях гипергликемии. Этот вывод особенно важен, ибо дает возможность использовать бенфотиамин как на стадии компенсации углеводного обмена, так и когда СД не компенсирован.
С учетом широкого спектра коморбидной патологии у большинства пациентов с диабетом и необходимости длительного лечения важным преимуществом бенфотиамина, отмеченным в клинических исследованиях, остается хорошая переносимость и низкая частота нежелательных эффектов препарата [12, 25–28].

Одним из наиболее широко используемых и хорошо изученных лекарственных средств, содержащих бенфотиамин в комплексе с другими витаминами группы В, является препарат Мильгамма композитум, драже которого содержат по 100 мг бенфотиамина и пиридоксина (витамин В6). Для внутримышечного введения используется препарат Мильгамма, каждая ампула которого содержит по 100 мг тиамина и пиридоксина, 1 мг цианокобаламина (витамин В12). Кроме этого в состав Мильгаммы входит местный анестетик лидокаин (20 мг), что наряду с небольшим (2 мл) объемом вводимого раствора делает инъекции практически безболезненными.
Компонент Мильгаммы пиридоксин – кофактор более чем для 100 ферментов. Благодаря способности регулировать метаболизм аминокислот пиридоксин влияет на структурно-функциональное состояние нервной ткани, за счет участия в синтезе ключевых нейромедиаторов обеспечивает синаптическую передачу, а также снижает концентрацию липопротеидов низкой плотности [27, 28]. Нейротропный эффект от витамина В6 дополняется активацией синтеза миелиновой оболочки нервов и транспортных белков в осевых цилиндрах нервных волокон, что способствует ускорению регенерации поврежденных нервов. Кроме того, пиридоксин увеличивает внутриклеточные запасы магния, играющего важную роль в метаболических процессах и деятельности нервной системы [27].
Установлено, что помимо повышения скорости проведения нервного импульса комбинация тиамина/бенфотиамина и пиридоксина оказывает антиноцицептивное действие. Частично этот эффект может быть опосредован модуляцией метаболизма серотонина и гамма-аминомасляной кислоты. Показано, что дефицит тиаминпирофосфата и пиридоксина может проявляться симптомами воспаления, способствующими сенсибилизации болевых рецепторов с формированием воспалительной гипералгезии [5, 29].
Эффекты цианокобаламина направлены на восстановление структуры миелиновой оболочки и уменьшение нейрогенной боли. Активируя синтез липопротеидов, необходимых для построения клеточных мембран и миелиновых оболочек, цианокобаламин ускоряет регенерацию нервов [29, 30].
Результаты клинических исследований свидетельствуют, что применение Мильгаммы композитум приводит к ослаблению боли спустя 2–3 недели лечения и увеличению скорости проведения возбуждения по нервным волокнам [12, 25, 27]. Этот аспект терапии крайне важен, поскольку регресс боли позволяет ожидать большей приверженности больных СД к рекомендованной терапии. Согласно данным двойного слепого плацебо-контролируемого исследования, парентеральное применение препарата Мильгамма больными ДДН приводит к увеличению скорости проведения по малоберцовому нерву и улучшению вибрационной чувствительности; эффект стойко сохраняется на протяжении не менее 9 месяцев [27].
В других клинических исследованиях отмечено улучшение функции автономной нервной системы под влиянием Мильгаммы композитум [31].
Алгоритм лечения больных ДДН зависит от стадии заболевания, наличия или отсутствия болевого синдрома. Пациентам с субклинической стадией целесообразно назначение пероральной формы – Мильгаммы композитум по 1 драже 3 раза в сутки на протяжении 6–8 недель. Повторные курсы лечения можно рекомендовать через 6–9 месяцев. Именно на ранней стадии ДДН, когда изменения периферической нервной системы обратимы, применение Мильгаммы композитум особенно эффективно. При наличии выраженных функциональных нарушений рекомендуется начать терапию с инъекционной формы Мильгаммы по 2 мл внутримышечно в течение 10 дней с последующим переходом на пероральный прием Мильгаммы композитум по 1 драже 3 раза в сутки в течение 6–8 недель.
Современные возможности фармакотерапии ДДН значительно облегчили ведение пациентов СД. Эффективность применения соли тиоктовой кислоты (Тиогамма) при ДДН определяется способностью препарата активно накапливаться в периферической нервной ткани, уменьшать гипоксии нервной ткани, улучшать кровоснабжение нервных волокон и увеличивать скорость проведения нервного импульса. Стандартом схемы применения сейчас является 2–4-х недельный курс лечения парентеральной лекарственной формы Тиогаммы с переходом на прием таблетированной формы в дозе 600 мг/сут. Следует отметить, что лекарственная форма Тиогаммы в виде раствора для инфузий во флаконах по 50 мл (600 мг тиоктовой кислоты) не требует разведения и полностью готова к использованию. Препарат производится в Германии и имеет традиционно высокое немецкое качество. Проводя терапию ДДН, следует помнить о возможности комбинации Мильгаммы® композитум и Тиогаммы, что позволяет максимально оптимизировать лечебный процесс и повысить качество жизни пациентов, страдающих этим тяжелым осложнением СД.
Важно помнить, что оптимальная эффективность патогенетического лечения ДДН обеспечивается на фоне достижения целевых показателей гликемии.
Подводя итоги, следует подчеркнуть, что ДДН остается частой клинической проблемой, с которой сталкиваются эндокринологи, неврологи и терапевты. Применение препаратов Мильгамма и Мильгамма композитум значительно повышает возможности фармакотерапии этого серьезного осложнения СД, способствует улучшению качества и прогноза жизни больных.



