Болезни печени относятся к одному из актуальных разделов внутренней патологии. Это связано с их широкой распространенностью, тяжестью течения и высокой летальностью. Этиологическими факторами хронических заболеваний печени могут являться различные агенты: токсины, гепатотропные вирусы, гипоксия, аутоиммунные реакции, холестаз, метаболические повреждения и т. д. [1].
Среди множества хронических заболеваний печени хотелось бы выделить основные группы:
- хронические вирусные заболевания печени;
- аутоимунные заболевания печени;
- метаболические заболевания печени;
- токсические поражения печени;
- лекарственные поражения;
- объемные образования печени;
- гельминтозы.
Механизмы повреждения печени многообразны и взаимосвязаны.
В настоящее время известно пять основных механизмов, ведущих к гибели печеночных клеток [2]:
Повреждения плазматической мембраны и нарушения цитоскелета. Это сопровождается нарушениями структуры с образованием разрывов мембраны и может непосредственно приводить к гибели клетки.
Дисфункция митохондрий. Неспецифическое повреждение внутренней митохондриальной мембраны, чаще всего вызывается активацией перекисного окисления липидов или действием фосфолипазы. Повреждения механизмов окислительного фосфорилирования в митохондриальной мембране ведут к уменьшению АТФ и затем к гибели клеток.
Утрата внутриклеточного ионного гомеостаза.
Активация ферментов деградации веществ.
Окислительный стресс в результате несоответствия про- и антиоксидантных ресурсов клетки. Свободнорадикальные формы кислорода образуются при стимуляции клеток Купфера и нейтрофилов. При действии свободных радикалов происходит изменение структуры и функции мембран, повышение их проницаемости, нарушение активности мембраносвязанных ферментов, повышается чувствительность клеток к другим агентам.
Несмотря на многообразие патогенетических механизмов повреждения, отмечены однонаправленные изменения, характеризующиеся развитием воспаления, нередко стеатоза и фиброза печени разной степени выраженности. В табл. 1 представлены основные патогенетические механизмы хронических заболеваний печени [3].
Независимо от характера патогенетических механизмов, приведших к развитию хронических заболеваний печени, выделяют два основных направления лечения [4].
Первое представляет этиотропную терапию, направленную на подавление патологического возбудителя, его элиминацию и санацию организма. В клинической практике этиотропную терапию применяют только при вирусных гепатитах с парентеральным механизмом заражения. Однако полный курс терапии недоступен большей части инфицированных ввиду своей дороговизны и имеет широкий спектр противопоказаний и побочных реакций. С другой стороны, было показано, что даже избавление больного от вируса не означает полного излечения: сохраняются фиброз, дистрофия клеток.

Второе направление соответствует патогенетической терапии, целью которой является фармакологическая коррекция многообразных звеньев патогенеза. При этом нужно отметить, что общность основных звеньев патогенеза различных поражений печени позволяет использовать достаточно близкую патогенетическую терапию, основу которой могут составлять лекарственные средства с направленным действием на печеночные клетки.
Таким образом, для фармакологической коррекции хронических заболеваний печени в зависимости от этиологических факторов, особенностей патогенеза и клинических проявлений используются лекарственные препараты, которые условно можно разделить на следующие группы [5]:
Средства, влияющие на процессы тканевого обмена;
Средства, повышающие дезинтоксикационную функцию печени и других органов;
Желчегонные средства;
Противовирусные и антимикробные средства;
Иммуномодуляторы;
Противовоспалительные препараты;
Ингибиторы и индукторы микросомальных систем, осуществляющих метаболизм ксенобиотиков;
Гепатопротекторы;
Антиоксиданты.
Среди такого многообразия лекарственных средств выделяют сравнительно небольшую группу препаратов, оказывающих избирательное действие на клетки печени, – гепатопротекторы [6, 7]. К гепатопротекторам относятся вещества, препятствующие повреждающему воздействию экзогенных или эндогенных факторов на печень, усиливающие ее функцию и способствующие репаративным процессам в гепатоцитах.
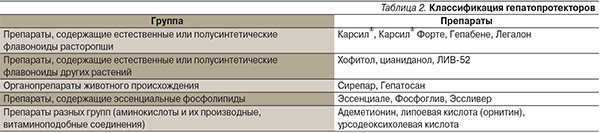
В табл. 2 представлены основные группы препаратов, используемых при лечении хронических заболеваний печени.
В целом в настоящее время преобладающее использование имеют средства растительного происхождения (до 54 %), в то время как на фосфолипидные препараты приходится 16 %, а на другие средства, в т. ч. синтетические, органо- и препараты аминокислот – 30 % от общего количества «истинных» гепатопротекторов.
В связи с вышесказанным особого внимания заслуживает препарат растительного происхождения Карсил® производства компании АО «Софарма». В его состав входит силимарин – смесь флавоноидов: силибинина, силидианина и силикристина, которые получают из плодов расторопши пятнистой (Silybum marianum L.). Гепатопротекторный эффект силимарина доказан в большом количестве экспериментальных (in vitro и in vivo) и клинических исследований во всем мире. В его основе лежат мембранопротективный, антиоксидантный, противовоспалительный и метаболический эффекты [8, 9].
Мембранопротективный эффект Карсила® реализуется за счет подавления реакции перекисного окисления липидов, устранения повышенной проницаемости митохондрий и нарушений митохондриального дыхания. Это восстанавливает трансмембранный потенциал, стабилизируя мембрану клеток печени и предотвращая гибель клетки [10].
Антиоксидантное действие силимарина считают одним из основных, способствующих реализации и других свойств препарата. В условиях окислительного стресса силимарин подавляет образование супероксидных анионных радикалов и оксида азота, повышает запасы АТФ за счет стимуляции фосфорилирования АДФ, поддерживает запасы восстановленного глютатиона [11]. При приеме Карсила® происходит связывание и подавление образования радикалов, повышается внутриклеточный запас молекул-антиоксидантов [12].
Противовоспалительное действие силимарина проявляется в угнетении NO-синтазы и циклооксигеназы-2, снижении интенсивности образования лейкотриенов в тромбоцитах, лейкоцитах и эндотелии. Силибинин подавляет активность протеинкиназ, участвующих в реализации провоспалительного действия цитокинов [13].
Метаболическое действие препарата достигается за счет влияния силибинина на некоторые механизмы действия инсулина; в частности, изменяется захват глюкозы адипоцитами за счет блокады инсулинзависимого транспортера глюкозы-4. Благодаря подавлению активности пируваткиназы силибинин снижает скорость глюконеогенеза в печени [14]. За счет торможения продукции реактивных форм кислорода в митохондриях флавоноид способствует снижению скорости окисления углеводов [15]. Силибинин подавляет глюконеогенез и гликогенолиз в условиях покоя и при стимуляции глюкагоном [16].
Таким образом, все перечисленные эффекты объясняют гепатопротекторное действие Карсила®, которое находит широкое применение в клинической практике среди пациентов с болезнями печени [17]. Взрослым препарат назначают по 1–2 драже 3 раза/сут. При необходимости суточная доза может быть увеличена до 12 драже (420 мг). Продолжительность курса лечения составляет не менее 90 дней. Производные силимарина целесообразно применять больным заболеваниями печени с клиническими и биохимическими признаками активности. Осторожность следует соблюдать больным холестазом, поскольку есть сведения, будто под воздействием препаратов холестаз может усиливаться.
В России появилась новая форма данного препарата – капсулы Карсил® Форте. Дозировка Карсил® Форте более комфортна для применения, поскольку в отличие от своего предшественника препарат содержит больше действующего вещества в одной капсуле (90 мг в пересчете на силимарин против 35 мг
«прежнего» Карсила®). Это позволяет оптимизировать прием препарата: ранее для лечения средних и тяжелых поражений печени следовало принимать по 12 драже в сутки, а теперь в этих случаях достаточно 3 капсул в день. Также Карсил® Форте обладает большей биодоступностью. В комплексе все эти факторы повышают эффективность лечения печени препаратом и делают применение лекарства более удобным для пациентов. Принимают Карсил® Форте внутрь целиком не разжевывая, запивая небольшим количеством жидкости. Препарат хорошо переносится больными, и при соблюдении рекомендуемой схемы приема побочные эффекты крайне редки.



