Болезни органов пищеварения входят в число 10 актуальных проблем, которыми занимаются педиатры общей практики и обусловливают, согласно данным Международного фонда по проблемам функциональных расстройств желудочно-кишечного тракта (IFFGD – International Foundation for Functional Gastrointestinal Disorders), от 3 до 5 % визитов к педиатру. Распространенность запоров среди детей варьируется от 3 до 49 %. По информации Университета системы здравоохранения Мичигана (UMHS – University of Michigan Health System), запорами страдают от 16 до 37 % детей школьного возраста, по данным Британского национального института здоровья и качества медицинской помощи (NICE – National Institute for Healthand Clinical Excellence) – от 5 до 30 % [1, 2]. Согласно данным M.M. Van den Berg и соавт., запорами страдают от 0,7 до 29,6 % детей и от 2 до 35 % взрослых [3]. Обращаемость по поводу запоров в Америке составляет 2,5 млн посещений в год, ежегодные расходы на диагностику одного случая заболевания достигают 2757 долл., а на лечение – до 3362 долл. в год. На основании данных Национальных обзоров амбулаторной (NAMCS) и госпитальной помощи (NHAMCS) за 1993–2004 гг. число амбулаторных посещений по поводу запоров увеличилось с 4 млн (95 % доверительный интервал [ДИ] – 3,3–4,7 млн) в год за 1993–1996 гг. до 7,95 млн (95 % ДИ – 6,6–9,4 млн) за 2001–2004 гг. Наибольший рост амбулаторных посещений отмечен среди детского населения [3–5]. Более низкой распространенностью запоров по сравнению с Северной Америкой (16 %), Европой (19,2 %) и Океанией (19,7 %) характеризуются азиатские страны (в среднем 10,8 %) [6]. Мета-анализ результатов 68 научных исследований [7], соответствующих требованиям доказательной медицины (из общего числа 1209 работ, посвященных изучению запоров и опубликованных в системе Medline с 1996 по 2010 г.), позволил установить, что различия эпидемиологических показателей в мире обусловлены влиянием таких факторов, как культурно-образовательный уровень [8, 9], характер питания [10, 11], генетический полиморфизм, отягощенная наследственность, экологические, социально-экономические условия и уровень развития системы здравоохранения [12, 13].
Запор является многофакторным заболеванием. К основным причинам его формирования относят непереносимость коровьего молока, низкий уровень потребления клетчатки, фруктов и овощей, недостаточный питьевой режим, некоторые хронические соматические заболевания и состояния (гипотиреоидизм, гиперкальциемия, гипокалиемия), прием ряда фармакологических препаратов (диуретиков, препаратов железа, алюмосодержащих антацидов), стресс и нарушение адаптации при поступлении в детское образовательное учреждение или школу, ожирение, нарушение режима питания и снижение физической активности [14–16]. Большую роль играют психосоматические, психофизиологические факторы: подавление позыва на дефекацию вследствие «боязни горшка» (при имевшей место ранее болезненной дефекации), отсутствие «комфортных условий» осуществления акта дефекации (в школе, детском саду), императивное воспитание туалетных навыков (у ребенка 1–2 лет) и др. [17, 18].
Согласно Римским критериям III (2006), к функциональным нарушениям, сопровождающимся затрудненным актом дефекации, у детей относятся затруднение дефекации у новорожденных (дисхезия – G6) и функциональный запор (G7) [19]. В последней редакции Римских критериев III (2006) сократилась длительность периода предъявления жалоб до 1 месяца (для детей в возрасте до 4 лет); число критериев, совокупность которых позволяет подтвердить диагноз, снизилось до 2; частота стула перестала считаться доминирующим признаком запоров [20].
У ребенка в возрасте до 4 лет диагноз «функциональный запор» (G7) устанавливается при наличии двух или более симптомов, регистрируемых в течение одного месяца:
- две или менее дефекаций в неделю;
- один или более эпизодов в неделю энкопреза у ребенка, имеющего навыки туалета;
- чрезмерная задержка стула в анамнезе;
- дефекации, сопровождающиеся болью и натуживанием в анамнезе;
- наличие множества каловых масс в прямой кишке, пальпируемых через брюшную стенку;
- большой диаметр каловых масс в анамнезе.
У ребенка старше 4 лет функциональный запор диагностируют только после исключения органической патологии, к клиническим критериям добавлены ощущение неполного опорожнения кишечника и изменение характера, а также консистенции кала (плотный, комочками или значительного диаметра). Симптомы у детей старше 4 лет должны отмечаться не реже одного раза в неделю в течение 2 месяцев при условии наблюдения за больным не менее 6 месяцев [21].
В настоящее время не установлено физиологической нормы частоты стула у здоровых детей. Частота стула у детей, находящихся на грудном вскармливании, составляет от 1 до 6–7 раз в сутки, а для детей на искусственном вскармливании стул должен быть не менее 1 раза в сутки. В период введения прикорма (4–6 месяцев) стул должен быть не менее 2 раз в сутки.
У детей до 3 лет нормальным считается стул не менее 6 раз в неделю, старше 3 лет – не менее 3 раз в неделю [22, 23]. Согласно другим литературным источникам, частота стула у практически здоровых детей может достигать 5–40 в неделю, в среднем 1,0–2,9 раза в сутки в зависимости от возраста и характера вскармливания [24]. В рекомендациях AAP (American Academy of Pediatrics) для детей первой недели жизни возрастной нормой считается частота стула более 4 раз в сутки, для детей от 4 месяцев до 4 лет –2, старше 4 лет – 1 раз в сутки. В 4 года у 96 % детей частота стула колеблется от 3 раз в сутки до 3 раз в неделю. Согласно Римским критериям III, для детей старше 3 лет можно говорить о наличии запора в том случае, если частота дефекаций составляет менее 3 раз в неделю [20].
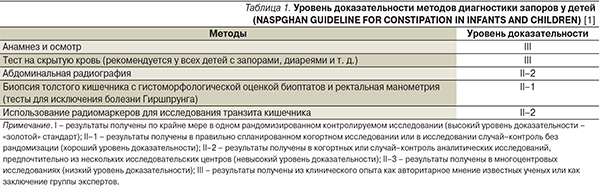
Согласно литературным данным, 90–95 % запоров у детей являются функциональными, в то время как 5–10 % имеют органическую природу [24]. При наличии т. н. красных флагов тревоги, а также в отсутствие у ребенка грудного возраста в течение 4 недель положительной клинической динамики на фоне адекватно проводимой терапии необходимо исключить такие заболевания, как врожденные аномалии и пороки развития кишечника (болезнь Гиршпрунга и другие формы нейрональной интестинальной дисплазии – дис- и гипоганглиоз; синдром Пайра; аномалии ротации и фиксации кишечника, идиопатический мегаколон и мегаректум; свищевые формы атрезии прямой кишки; изолированную гипертрофию внутреннего анального сфинктера, аномальную фиксацию толстой кишки эмбриональными тяжами), аноректальную патологию (геморрой; анальную трещину), опухоли, стриктуры, приводящие к нарушению проходимости толстой кишки, муковисцидоз, целиакию, расщелину позвоночника, синдром Дауна, умственную отсталость и церебральный паралич [26]. К симптомам «красных флагов тревоги» относятся длительность отхождения мекония более 48 часов, ленточный стул, отставание в физическом развитии, слабость в ногах, вздутие и рвота [1]. С целью установления органической природы запора используется широкий спектр современных инструментальных методов исследования: рентгенологическое исследование толстой кишки (обзорный снимок брюшной полости и костей таза, крестцово-копчикового отдела позвоночника, рентгено-контрастная ирригография); колоно- или ректоскопия с гистологической оценкой биоптатов слизистой оболочки толстой кишки (по показаниям) и гистохимическим исследованием тканевой ацетилхолинэстеразы, ультразвуковые методы визуализации кишечника. Применяются функциональные методы исследования: сфинктерометрия, баллонография, манометрия, миография, электроманометрия, фоновая и стимуляционная профилометрия анального канала, компьютеризированная многоканальная манометрия, электроколосцинтиграфия, сцинтидефекография и дефекография [27]. Наиболее высокой значимостью обладают такие методы диагностики, как биопсия толстого кишечника с гистоморфологической оценкой биоптатов и ректальная манометрия (для исключения болезни Гиршпрунга), рентгенографическое исследование желудочно-кишечного тракта, применение радиомаркеров для оценки скорости транзита каловых масс по толстому кишечнику (табл. 1) [1].
Лечение функционального запора осуществляется по определенному алгоритму:
- обучение ребенка и родителей;
- проведение коррекции питания и питьевого режима;
- устранение с помощью медикаментозных средств имеющегося копростаза;
- длительное (в течение нескольких лет) непрерывное медикаментозное лечение запора и подбор поддерживающей терапии «по требованию» [28].
Первостепенное значение в обучении ребенка и его родителей имеет устранение негативного отношения к запорам [29]. Необходимо контролировать посещение ребенком туалета после приема пищи (сидение на горшке или унитазе с подставкой для ног после еды в одно и то же время 5–10 минут, но не более 30); организовать систему поощрений и вознаграждений как за регулярное посещение туалета, так и за успешные акты дефекации; рекомендовать ведение дневника или календаря, в котором фиксируется частота дефекации, ее время, время приема медикаментов [30].
Лечение запора у ребенка грудного возраста обычно включает дополнительное выпаивание водой или фруктовыми соками, коррекцию питания (после оценки достаточности питания методом контрольного вскармливания). У детей старше года диетическая коррекция при запорах подразумевает ограничение в рационе таких продуктов, как коровье молоко, бананы, йогурт, сыр, вареная морковь, и других продуктов с низким содержанием клетчатки. Рекомендуются овощные супы, зерновые отруби, крекеры и хлеб из цельных зерен пшеницы. Американская педиатрическая академия рекомендует рассчитывать необходимую дозу клетчатки для детей по формуле 0,5 г/кг/сут (максимум 35 г/сут) [31].
В то же время большинство рекомендаций по диетической коррекции запоров не подтверждено в контролируемых исследованиях. Так, например, утверждение, будто введение в рацион соков, богатых клетчаткой, помогает уменьшить проявления запоров, имеет уровень доказательности ІІ-3; применение экстракта ячменя, кукурузного сиропа, лактулозы и сорбитола размягчают стул – уровень доказательности ІІІ; диета, содержащая фрукты и овощи, – уровень доказательности ІІІ [32].
Пищевые волокна входят в состав некоторых препаратов, используемых для лечения запоров. Например, средств на основе псиллиума (оболочки семян подорожника), декстрина пшеницы, метилцеллюлозы. Основным механизмом их действия является увеличение объема и размягчение каловых масс.
На фоне приема пищевых волокон для обеспечения адекватной гидратации организма ребенок в зависимости от возраста должен получать от 700 до 2000 мл воды или немолочного питья в сутки.
Для устранения каловых завалов используются очистительная или сифонная клизмы, суппозитории, растворы электролитов (солевых слабительных средств). Предпочтение отдается пероральным слабительным препаратам как неинвазивным и способствующим длительному контролю частоты стула (на поддерживающей терапии).
Полиэтиленгликоль – ПЭГ (действующее вещество макрогол) – линейный полимер, посредством водородных связей удерживающий молекулы воды. При этом он не абсорбируется и не метаболизируется, т. е. не обладает системным действием, а оказав слабительное действие, выводится из организма в неизмененной форме.
Целью исследования C. Dupont и соавт. [33] было определение точной дозы ПЭГ 4000 для лечения запоров у детей. Анализировали данные групп больных, которым случайным образом назначалась та или иная доза ПЭГ. Оптимальной оказалась доза 0,5 г на килограмм массы тела в сутки. При такой дозе стул нормализовался у 90 % пациентов, не только восстанавливалась консистенция стула, но и исчезали абдоминальные боли, улучшался аппетит.
В 2011 г. Cochrane Collaboration опубликовал сравнительный анализ эффективности ПЭГ и лактулозы [34]. По критериям нормализации стула и купированию абдоминальных болей у детей с запорами ПЭГ оказался достоверно более эффективным.
Использование ПЭГ в педиатрической практике у детей в возрасте до 8 лет в дозе 8 г/сут, старше 8 лет – 20 г/сут в течение 14 дней способствовало нормализации частоты стула и исчезновению клинических проявлений запора, но не влияло на электрическую активность толстой кишки [35].
Согласно материалам Педиат-рического общества Канады, 3-дневное применение ПЭГ 3350 из расчета 1,0–1,5 г/кг/сут успешно купировало копростаз у 95 % детей и хорошо ими переносилось [32].
Реже в педиатрической практике применяют минеральные масла. Существует теоретическое предположение, будто использование слабительных масел нарушает всасывание жирорастворимых витаминов в кишечнике ребенка. Этот эффект стараются минимизировать благодаря приему масляных слабительных средств в послеобеденное время и на ночь. Минеральные масла, особенно в больших количествах, имеют неприятные вкусовые качества. Их рекомендовано смешивать или взбивать с продуктами, которые также содержат жиры (йогурты, шоколадные сиропы и т. д.).
У грудных детей, детей с поражением нервной системы и детей с гастроэзофагеальным рефлюксом минеральные масла не применяют из-за возможности развития аспирационной пневмонии [1, 36].
В педиатрической практике в качестве эффективных и безопасных слабительных средств широко используются препараты лактулозы. Длительное применение данного препарата в рекомендованных дозах, часто необходимое прежде всего при хроническом запоре, не сопровождается такими нежелательными явлениями, как потеря электролитов или развитие толерантности. Лактулоза – синтетический дисахарид, не встречающийся в природе. Она не расщепляется и не всасывается в тонкой кишке, поэтому, достигнув толстой кишки, подвергается бактериальному разложению и распадается на короткоцепочечные жирные кислоты (молочную, уксусную, пропионовую и масляную), снижая рН содержимого толстой кишки и стимулируя перистальтику. Разложение лактулозы до короткоцепочечных жирных кислот повышает осмотическое давление в просвете кишки, задерживает воду, увеличивая объем химуса и снижая время его транзита. Лактулоза – питательная среда для сахаролитических бактерий, что оказывает благотворное воздействие на микрофлору кишечника.
Некоторые из стимулирующих слабительных средств иногда используются детьми раннего возраста для устранения повторных запоров [1]. Однако контролированных исследований по использованию этих средств в педиатрической практике недостаточно. В педиатрии используют стимулирующие слабительные средства как препараты резерва для детей при недостаточном ответе на осмотические слабительные.

Натрия пикосульфат зарегистрирован в РФ для детей с 4-летнего возраста.
Являясь слабительным средством местного действия, натрия пикосульфат после бактериального расщепления в толстом кишечнике оказывает стимулирующее действие на слизистую оболочку толстой кишки, увеличивая перистальтику, способствует накоплению воды и электролитов в толстой кишке. Это приводит к стимуляции акта дефекации, уменьшению времени эвакуации и размягчению стула. Препарат эффективен при запорах, обусловленных гипотонией и вялой перистальтикой толстой кишки. У детей грудного возраста эффективность препарата снижается вследствие незначительного количества бактериальной флоры, продуцирующей сульфатазы. В многоцентровом рандомизированном двойном слепом исследовании было продемонстрировано достоверное по сравнению с плацебо увеличение частоты стула в неделю, а также улучшение качества жизни пациентов [37].
Ректальное введение препаратов оказывает более быстрый и выраженный клинический эффект. Однако при использовании суппозиториев или клизм чаще, чем при приеме пероральных препаратов, могут возникать осложнения [38]. Клизмы назначаются небольшими по объему, после их введения раствор должен обязательно выйти из кишечника, вводить раствор следует вдоль стенки кишечника, а не в уплотненные каловые массы.
Дозу слабительного регулируют в зависимости от клинического эффекта. Снижение дозы начинают только после 6 месяцев стабильного состояния ребенка. Не рекомендуется отменять слабительные средства без консультации с педиатром. Родители должны быть обучены алгоритму действий на случай, если при отмене слабительных средств у ребенка вновь возникнет запор. Данный алгоритм включает очистительную клизму или ректальные суппозитории при одновременном повышении дозы используемого слабительного средства.
Неудачи в лечении запоров чаще всего связаны с недостаточной приверженностью лечению, неадекватным медикаментозным лечением и/или преждевременной отменой препарата. Лечение запора у детей, которое не приводит к позитивному результату при адекватной приверженности лечению, указывает на необходимость пересмотра диагноза и проведения дополнительных тестов для верификации точного диагноза.
Следует отметить, что многие слабительные средства имеют невысокий уровень доказательности клинической эффективности (табл. 2) [1].
Таким образом, лечение запора у детей грудного возраста может включать осмотические слабительные средства и/или периодическое применение глицериновых суппозиториев «по требованию». Большинство экспертов не рекомендуют использовать минеральные масла, клизмы и стимулирующие слабительные средства в лечении запора у младенцев в связи с небезопасностью этих методов (уровень доказательности 1С – результаты получены путем мета-анализа множества хорошо спланированных контролируемых исследований, но уровень рекомендаций невысокий) [1].
Клинический эффект при сочетании терапии слабительными средствами с изменением поведения (оптимизация пищевого рациона, двигательного режима, обучение) значительно выше, чем только от одного вида терапии (уровень доказательности 2В – результаты основаны на выводах не менее одного хорошо спланированного экспериментального исследования. По уровню рекомендаций – доказательства II, III или IV уровней, считающиеся в целом устойчивыми данными).
Устранение копростаза (калового завала) выполняется, как правило, в амбулаторных условиях с применением пероральных, ректальных препаратов или их комбинации. После ликвидации копростаза рекомендуется подбор дозы слабительного до получения мягкого стула один раз в сутки (уровень доказательности 2С основан на результатах не менее одного хорошо спланированного экспериментального исследования. Рандомизированные исследования с высоким уровнем ложнопозитивных и ложнонегативных ошибок. Доказательность II, III, IV уровней, но данные в целом неустойчивые).
Выбор слабительного средства является не столь важным, как соблюдение режима приема и дозы слабительного средства. Доза слабительного для детей определяется в зависимости от возраста, массы тела и тяжести запора у ребенка.
Одним из зарубежных руководств по лечению запоров у детей, опубликованным NICE в мае 2010 г., декларируется выполнение следующего терапевтического алгоритма действий:
- диетические мероприятия, в т. ч. достаточное потребление жидкости;
- увеличение физической активности;
- лечение слабительными средствами;
- поддерживающая терапия (осмотические и по показаниям стимулирующие слабительные);
- образование и психологическая коррекция;
- направление в специализированные гастроэнтерологические центры при неэффективности первичной терапии;
- предоставление информации и поддержки детям и их семьям [1].



