Открытие инфекции Helicobacter pylori в качестве этиологического фактора хронического гастрита и язвенной болезни привело к тому, что данные заболевания стали излечимыми путем применения антихеликобактерной (т. н. эрадикационной) терапии (АХТ). Помимо хронического гастрита и язвенной болезни значимость инфекции H. pylori на сегодняшний день доказана в патогенезе лекарственной гастропатии (ацетилсалициловая кислота, нестероидные противовоспалительные препараты, клопидогрел, варфарин), MALT-лимфомы и некардиального рака желудка [7]. Широкое распространение инфекции во всем мире (инфицированность превышает 50 % человеческой популяции) и связь с заболеваниями, опасными своими исходами (желудочно-кишечное кровотечение, перфорация и др.), ввело H. pylori-ассоциированную патологию верхнего отдела желудочно-кишечного тракта в ранг социально значимой. Действительно, в ряде стран Запада, Японии, Австралии методика тестирования инфекции H. pylori, а также проведение АХТ широко внедрены в практическое здравоохранение. Тактика выявления и тестирования инфекции H. pylori в качестве лечения язвенной болезни и функциональной диспепсии, а также профилактики лекарственной гастропатии и рака желудка поддерживается в ряде стран в виде государственных медицинских программ и/или является страховым случаем с полным погашением затрат больного на диагностику и лечение. В некоторых странах, несмотря на отсутствие убедительной научной базы проведения внутрисемейной профилактики инфекции H. pylori, тактика test-and-treat является легитимной, а издержки покрываются страховыми компаниями. Сложившаяся ситуация привела к тому, что инфицированность населения в западных странах, Австралии (см. таблицу) и Японии (рис. 1) значимо снизилась за последние годы, в то время как по развивающимся странам адекватной информации до сих пор нет [28]. При этом наблюдается четкая зависимость между снижением распространенности хеликобактерной инфекции и падением заболеваемости H. pylori-ассоциированной патологией [37, 38].


Как видно из рис. 1, распространенность инфекции в Японии существенно изменилась в лучшую сторону. По данным демонстрируемой работы, инфицированность населения достоверно снизилась, особенно в группе людей молодого возраста ([27] с доп.). Ситуация напоминает таковую в Австралии, США, странах Западной Европы.
Левая диаграмма демонстрирует снижение распространенности в разных возрастных группах, правая – совокупную динамику в популяции. Красные стрелки показывают снижение распространенности инфицированности населения (* p < 0,05; ** p < 0,000056).
Итак, почему во многих странах Западной Европы, США, Канаде, Японии и Австралии отмечена тенденция к уменьшению заболеваемости язвенной болезнью и некардиальным раком желудка, прямо коррелирующая со снижением распространенности инфекции H. pylori в популяции, на сегодняшний день абсолютно ясно [33, 37]. Однако два с лишним десятилетия практического применения эрадикационной терапии и сотни проведенных клинических исследований однозначно говорят нам об отсутствии гарантированного успеха вне зависимости от выбранной схемы лечения. Интерес ученых к проблеме недостаточной эффективности эрадикационных схем подчеркивается колоссальным числом публикаций, на сегодняшний день включившим более 100 мета-анализов контролируемых исследований, посвященных различным аспектам АХТ. Наибольшее число мета-анализов (более 25) касается оценки эффективности схем 1-й линии, традиционно включающих ингибитор протонной помпы (ИПП), кларитромицин и амоксициллин (или метронидазол). Сопоставимое число мета-анализов (22) посвящено выбору более эффективного ИПП или режимов их применения, включая использование нестандартных доз [8].

Действительно, интерес ученых, выраженный в сотнях контролируемых исследований и десятках метаанализов, вполне понятен, т. к. за последние годы эффективность тройной терапии 1-й линии прогрессивно снижается [18]. Уровень ее эффективности давно уже не дотягивает до рекомендованного известным Маастрихтским соглашением (Маастрихт-III, 2005) 80 %-ного уровня [22], а увеличение длительности тройной терапии – до 10–14 дней, по данным недавнего мета-анализа, уже не дает значимого эффекта – всего-то 3–5 % преимущества при потенциально неблагоприятных фармакоэкономических показателях [15]. Однако в рекомендациях Американской коллегии гастроэнтерологов, опубликованных вскоре после соглашения Маастрихт-III и допускающих применение тройной терапии 1-й линии, отмечено, что эффективность эрадикации при этом колеблется в пределах 70–85 % [11]. Подобная ситуация прослеживается и в не так давно опубликованном проекте рекомендаций “H. pylori-ассоциированная язвенная болезнь двенадцатиперстной кишки у взрослых: разработка схем лечения” Управления по контролю качества пищевых продуктов и лекарственных средств FDA США [20], где также отмечена необходимость применения стандартной терапии 1-й линии. Результаты последнего европейского консенсуса по проблемам инфекции H. pylori, известного как МаастрихтIV, увидели свет только в мае 2012 г. (конференция проходила 12–13 ноября 2010 г. во Флоренции, Италия) [24]. Таким образом, рекомендации, неоднократно ранее предварительно оглашенные на международных конгрессах, стали доступными в официальной форме, также свидетельствуя о возможности применения тройной терапии первой линии с кларитромицином в регионах, где резистентность H. pylori к этому антибиотику не выше 15–20 % [24]. Российская гастроэнтерологическая ассоциация в 2012 г. также рекомендует тройную терапию 1-й линии с кларитромицином в качестве конкурентоспособной схемы [2], вероятно опираясь на отдельные небольшие российские исследования по оценке резистентности H. pylori к кларитромицину, не превышающей 11,4 % [1, 4, 5, 21].
Как практикующему врачу найти правильный ответ в сложной ситуации, когда даже ведущие мировые эксперты разошлись во мнениях, говоря, что, с одной стороны, “имеются очевидные доказательства неприемлемо низкой эффективности схем АХТ 1-й линии” [18], указывая при этом, с другой, что “стандартная тройная терапия первой линии остается терапией выбора во всем мире” [23]? И это с учетом того, что увеличение ее длительности уже не дает никаких преимуществ (всего 5 %, согласно рекомендациям Маастрихт-IV [28]), повышение доз входящих в ее состав антибактериальных препаратов невозможно, применение квадротерапии с висмутом в России ограниченно ввиду отсутствия качественного тетрациклина. Как модифицировать тройную терапию не отклоняясь от логики экспертов и Маастрихта, а также Российской гастроэнтерологической ассоциации, обеспечив простоту и доступность схемы для врача и больного, высокую эффективность и прежнюю безопасность?
Для того чтобы разобраться в этой непростой ситуации, необходимо найти ответы на ряд важнейших вопросов: почему снижается эффективность стандартных схем 1-й линии, почему эти схемы до сих рекомендуются и что мы можем дать взамен?
Очевидно, что главной причиной снижения эффективности стандартной эрадикационной терапии 1-й линии является растущая резистентность к базовым антихеликобактерным средствам – метронидазолу и кларитромицину, поскольку проведенный еще в 2002 г. мета-анализ показал, что снижение эффективности тройных схем эрадикации с кларитромицином обратно коррелирует с ростом резистентности к этому антибиотику [14].
Однако тройная схема с кларитромицином до сих пор применяется наиболее широко. Только за 3 года после опубликования результатов Маастрихт-III (2007–2009) стали доступны результаты более 40 исследований, в которых свыше 60 % включенных пациентов получали стандартную тройную терапию 1-й линии с кларитромицином. Анализ данных литературы (более 100 исследований, метаанализов и систематических обзоров) за период с 1997 по 2009 г. показал, что в подавляющем большинстве случаев показатель эффективности стандартной терапии 1-й линии с кларитромицином только в 18 % случаев превышал 85 % и примерно в 60 % случаев даже не достигал 80 % [18].
Закономерно возникает вопрос: почему этот парадокс имеет место? Безусловно эксперты Маастрихт-IV рекомендовали не применять кларитромицин, если порог резистентности H. pylori к этому антибиотику достигает 15–20 %. Но мало кому известно, что данный тезис устраивал не только участников этого конгресса, но и компании – производителей препаратов для тройной терапии, особенно выпускающих комбинированные лекарственные средства для эрадикации 1-й линии(т.н.3 в 1).В тоже время такой тезис малопригоден для врачей не только России, но и для большинства практикующих врачей западных стран в связи с отсутствием общедоступной информации по частоте антибактериальной резистентности в различных регионах [22].
Причинами такого несоответствия могут быть:
1. В отдельных странах стандартная тройная терапия является единственной, официально разрешенной к применению в качестве лечения 1-й линии, не во всех странах разрешены к применению препараты висмута в качестве компонентов эрадикационных схем.
2. Стандартизация подхода к лечению инфекции H. pylori облегчает работу практикующих врачей (не нужно “держать в голове” различные комбинации).
3. Применение 3-, а не 4-компонентных схем с унифицированным приемом лекарств 2 раза в день упрощает режим лечения для пациента, что может влиять на комплаентность, а следовательно, и на эффективность терапии.
4. Важность кларитромицина в схемах эрадикационной терапии:
• специфическое действие на биопленки,
• преимущества перед всеми макролидами по минимальной ингибирующей концентрации в отношении H. pylori, способности проникать и накапливаться в слизистой оболочке желудка, эффективности в эрадикационных схемах в отсутствие целесообразности применения других макролидов из-за перекрестной резистентности [34],
• позитивное межлекарственное взаимодействие с ИПП (за счет метаболизма общим путем через CYP3A4 отмечается двукратное (!) повышение площади под кривой концентрация–время для омепразола, но не для пантопразола) [9], что может приводить к усилению антисекреторного эффекта омепразола и как следствие – к повышению эффекта АХТ.
5. Способность H. pylori приобретать резистентность к различным антибактериальным препаратам – не только к кларитромицину и метронидазолу, но и к новым препаратам схем резерва (левофлоксацин, моксифлоксацин); с другой стороны, у нас в резерве должны оставаться антибактериальные препараты в случае неудачи схем 1-й и 2-й линий либо в случае невозможности их применения.
Почему же схемы терапии, гарантирующие эрадикацию, отсутствуют в принципе?
К числу главных причин следует отнести следующие:
• причины, связанные с особенностями самого микроорганизма (антимикробная резистентность, формирование микст-штаммов, реже – полирезистентности одного штамма);
• ситуации, когда не достигается необходимая концентрация антибактериального препарата в желудке (выраженная гиперацидность, быстрый метаболизм ИПП и др.);
• вариабельность индивидуального ответа организма–хозяина на проводимое лечение (например, полиморфизм гена интерлейкина-1β);
• существование орально-орального пути передачи инфекции, что не исключает возможности реинфицирования и, вероятно, требует проведения внутрисемейной профилактики инфекции.
Биологические особенности инфекции H. pylori уникальны, что отражается и на способности бактерии приобретать антимикробную резистентность. Огромное количество бактерий в желудке человека, длительный период персистирования инфекции приводят к тому, что формируется микст-бактериальная популяции бактерий, когда часть субпопуляций, даже весьма малочисленных, может иметь резистентность к различным антибиотикам. Однако вероятность двойной резистентности у одного штамма H. pylori очень низка. Поэтому при использовании только одного препарата небольшая устойчивая к нему популяция бактерий может выжить и реколонизировать желудок. К числу методов, позволяющих решать эту проблему, относится одновременное использование нескольких антибиотиков (один из которых, скорее всего, уничтожит резистентный штамм) либо предварительная терапия препаратами, значительно снижающими колонизационную плотность (например, ИПП или препараты висмута), которая делает выживание мелких популяций менее вероятным, однако научной доказательной базы состоятельности такой тактики пока нет [18].
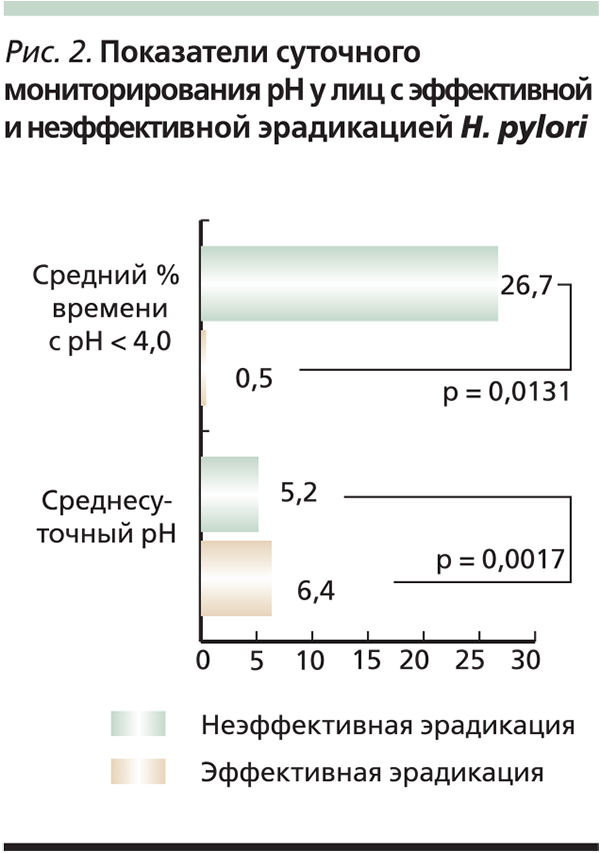
Внутренняя среда желудка определенно влияет на успешность эрадикации H. pylori, т. к. бактерия находится в нереплицирующемся, но жизнеспособном состоянии (т. е. становится фенотипически резистентной), когда окружающая ее среда имеет pH от 3 до 6 [29]. Повышение pH выше 6 дает бактериям возможность перейти в репликативное состояние, когда они становятся чувствительными к амоксициллину и кларитромицину. При аналогичных значениях рН отмечается наибольшая устойчивость (максимальный период полураспада) амоксициллина и кларитромицина [13]. Любопытно, что при условии наличия времени с внутрижелудочным рН < 4,0 менее 10 % в течение суток и/или при среднесуточном рН более 6,0 эрадикация H. pylori отмечается практически облигатно вне зависимости от резистентности к антибактериальным препаратам [31]. В пользу указанных выше наблюдений следует отнести и результаты суточного мониторирования рН в желудке лиц с эффективной и неэффективной эрадикацией (рис. 2) и преимущество в 5,4 % в эффективности АХТ для лиц с нормацидностью на момент начала приема эрадикационной схемы относительно пациентов с исходно избыточным кислотообразованием [10]. Из рисунка следует, что эффективность эрадикационной терапии напрямую зависит от подавления рН в желудке [31].
Таким образом, вышеизложенные факты стали теоретическим обоснованием для появления интереса к эрадикационным схемам с использованием двойных доз ИПП (2 или 4 раза в день), что является простым, безопасным и эффективным решением проблемы снижающейся эффективности стандартной терапии 1-й линии. Отметим, что в преддверии появления в мае 2012 г. официального документа Маастрихт-IV, имеющего среди прочих положений и постулат о преимуществе двойных доз ИПП в пределах 8 % [24], данный путь повышения эффективности АХТ был отмечен практически одновременно предшествующей нашей работой [3] и публикацией Российской гастроэнтерологической ассоциации [2].
Безусловно в основе состоятельности все шире признаваемой концепции о целесообразности удвоения доз ИПП лежат результаты массы доказательных исследований. Среди пионерских работ нужно вспомнить мета-анализ M. Vallve и соавт. (2002), показавший, что использование стандартных доз ИПП дает 6,2 (ITT)–8,0 % (анализ по протоколу) преимущества в эффективности эрадикации над половинными дозами ИПП первых генераций – омепразола, пантопразола, лансопразола и рабепразола [35] (рис. 3). С момента публикации этой работы применение ИПП в стандартных дозах (омепразол, эзомепразол и рабепразол 20 мг, лансопразол 30 мг и пантопразол 40 мг) 2 раза в день стало базой для всех эрадикационных схем.
С тех пор проведено около десятка контролируемых исследований [6, 12, 16, 19, 25, 30, 36], в которых была оценена эффективность двукратного увеличения доз ИПП в 7 дневных тройных схемах 1-й линии, давшая до 25 % преимущества относительно обычных доз [6]. Полученные результаты были подтверждены в экспериментальной работе, когда при использовании двойной схемы – амоксициллин в сочетании с ИПП 4 раза в день – эффективность эрадикации H. pylori была на 27 % выше, чем при использовании ИПП 2 раза в день (!) [17].
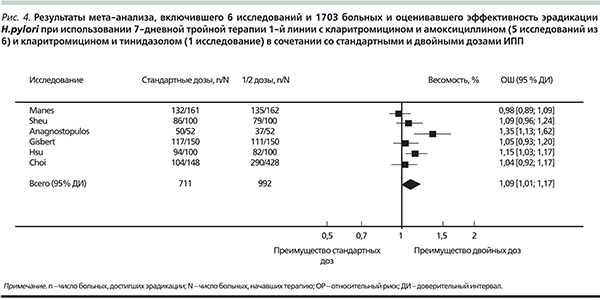
Данные приведенных выше отдельных рандомизированных исследований крайне показательны, особенно когда есть подтверждение обнаруженных фактов результатами мета-анализа, доказавшего, что двойные дозы ИПП дают в среднем 8 % преимущества над стандартными дозами ИПП [36] (рис. 4). Обоснованность концепции о необходимости более мощной кислотосупрессивной терапии для повышения уровня эрадикации нашла свое отражение и в последнем мета-анализе (35 исследований, 5998 пациентов), показавшем достоверные преимущества более мощных эзомепразола и рабепразола перед ИПП первых генераций в эрадикационных схемах на 4,7 и 4,1 % соответственно (отношение шансов – 1,32 [1,01–1,73] и 1,21 [1,02–1,42] соответственно) [26].
Таким образом, более выраженное антисекреторное действие двойных доз ИПП определяет значимое повышение эффективности схем эрадикационной терапии 1-й линии за счет различных факторов, среди которых наиболее важным можно признать повышение устойчивости кларитромицина и амоксициллина при слабокислых значениях рН. Действительно, ссылаясь на цитируемую выше работу, добиться 100 %-ной эрадикации инфекции H. pylori возможно только в случае, если среднесуточный рН в желудке достигает 6,4 (диапазон: 5,0–7,6), что достоверно выше среднего рН в желудке лиц с неэффективным лечением (5,2; диапазон: 2,2–6,2; p = 0,0131).
Стопроцентная эрадикация достигается только больными с рН в теле желудка выше 4 на протяжении 90 % и более времени в течение суток даже в присутствии кларитромицин-резистентных штаммов H. pylori [31]. Потрясающе, но факт преодоления резистентности к кларитромицину при увеличении рН в желудке был доказан и в упомянутом ранее исследовании G. Manes и соавт. (2005) [25], когда увеличение дозы омепразола до 80 мг в сутки давало 20 % преимущества лицам с кларитромицин-резистентными штаммами!
Следует признать, что сегодня практикующий врач в России нередко становится перед выбором назначения конкретной АХТ 1-й линии. К причинам подобных затруднений следует отнести амбивалентность имеющихся рекомендаций: с одной стороны, имеется отсутствие точной информации о реальной резистентности H. pylori к макролидам во всех регионах (не исключаем, что в некоторых областях она может быть высокой), с другой – существует приоритет выбора в отношении тройной терапии с кларитромицином, о чем было сказано выше. Впервые с момента появления Маастрихтских рекомендаций в последнем консенсусе появился путь модификации тройной терапии 1-й линии непосредственно врачом за счет не только увеличения длительности лечения до 10–14 дней (прирост эффективности – 5 % [24], что на 7 % ниже, чем в рекомендациях Маастрихт-III [22]), но и за счет удвоения доз ИПП (на 8 % при использовании 7-дневной схемы [24]).
Данная тактика поддерживается и Российской гастроэнтерологической ассоциацией (2012) [2], открывающей и другие перспективные пути модификации терапии 1-й линии с кларитромицином, в частности введение препаратов висмута в такие схемы 4-м компонентом. Эти рекомендации основаны на единичных рандомизированных исследованиях [32], показывающих дополнительный прирост эффективности эрадикации в пределах 10–15 % и потенциальное преодоление резистентности H. pylori к кларитромицину в случае увеличения длительности использования усиленной препаратом висмута тройной терапии 1-й линии с кларитромицином до 14 дней. В то же время в специально спланированном недавнем исследовании висмут-содержащая классическая квадротерапия не привела к приросту эффективности эрадикации при увеличении длительности с 7 до 14 дней (83,5 и 87,7 % соответственно (ITT; p > 0,05) [39]. Это предполагает специфическое повышение эффективности лечения именно за счет преодоления резистентности H. pylori к кларитромицину путем введения препарата висмута в схему 1-й линии 4-м компонентом аналогично тому, как это происходит при повышении доз ИПП в 2 раза. Нельзя не отметить, что к дизайну цитируемого исследования [32] есть некоторые вопросы – отсутствие группы контроля, получавшей тройную терапию без висмута, малое количество лиц с кларитромицинрезистентными штаммами (24 из 160), определяющие целесообразность продолжения изучения весьма перспективной тройной терапии I линии, усиленной висмутом, в других регионах мира и на больших выборках.
Итак, исходя из вышеизложенного, можно полагать, что наиболее простым для врача общей практики и одновременно наиболее научно обоснованным путем повышения эффективности тройной терапии 1-й линии с кларитромицином на сегодняшний день является модификация схемы лечения с использованием двойных доз ИПП. Такой подход позволяет существенно повышать (минимум на 8 %) эффективность АХТ, преодолев кларитромицин-резистентность H. pylori среди 20 % пациентов. Если мы вспомним рекомендации Маастрихт-III [22], когда весомым аргументом для увеличения длительности лечения в 2 раза (до 14 дней) был факт повышения эффективности всего на 12 %, намного более перспективным можно считать повышение эффективности 7-дневных схем за счет увеличения доз ИПП в 2 раза. Перспективность кроется не только в практически сопоставимой эффективности, но и в существенно меньшей токсичности, а также лучшей переносимости 7-дневных схем, что безусловно найдет свое отражение и в комплаентности, и в фармакоэкономической выгоде.
Таким образом, тройная терапия, несмотря на снижающуюся ее эффективность за счет растущей резистентности к кларитромицину, остается терапией выбора для первичного лечения больных, инфицированных H. pylori. Путем повышения эффективности 7-дневных схем 1-й линии с кларитромицином является применение двойных доз ИПП, дающих 8 % преимущества над схемами с ИПП в стандартных дозах.
Авторы сообщают об отсутствии конфликта интересов и финансовой заинтересованности в ходе написания данной статьи и не несут ответственности за наличие и содержание рекламных материалов, содержащихся на страницах журнала.



