История развития подходов к лечению пневмоний имеет волнообразный характер – от полного оптимизма до полного разочарования. Восторг по поводу эффективности антибиотиков сменялся унынием из-за возрастающей резистентности к ним, появление новых препаратов возвращало энтузиазм, сменявшийся очередным провалом и т. д. В то же время постоянно продолжался поиск дополнительных, неантибактериальных средств лечения, поскольку полного удовлетворения при терапии пневмоний антибиотики не приносили и не приносят. В настоящее время поиск таких подходов продолжается, выходя на новый уровень.
Эпидемиология внебольничной пневмонии (ВП)
Согласно официальной статистике (Центральный научно-исследовательский институт организации и информатизации здравоохранения МЗ РФ), в 2008 г. заболеваемость пневмонией среди взрослых составила 367,2 на 100 тыс. населения. Среди отдельных категорий населения показатель заболеваемости существенно выше. Например, среди солдат срочной службы он составляет 30–40 ‰.
Следует отметить, что в среднем в популяции лиц молодого и среднего возраста заболеваемость пневмонией достигает 1–12 ‰; в старших возрастных группах – 25-44 ‰.
Согласно данным Минздравсоцразвития РФ, в 2003 г. в нашей стране смертность от пневмонии составила 31 случай на 100 тыс. населения. Летальность при ВП среди лиц молодого и среднего возраста без сопутствующих заболеваний – 1–3 %. Среди пациентов старше 60 лет при тяжелом течении пневмонии, а также наличии коморбидных заболеваний (хроническая обструктивная болезнь легких [ХОБЛ], сердечная, печеночная, почечная недостаточность, сахарный диабет, алкоголизм, злокачественные новообразования) этот показатель достигает 15–30 % [1].
В настоящее время во многих странах разработаны национальные рекомендации по лечению ВП в зависимости от ее тяжести и предполагаемых этиологических агентов. Несмотря на это, смертность от пневмонии остается неоправданно высокой. В Испании в 2009 г. опубликовано исследование А. Rodrignez и соавт. по смертности от бактериальной ВП в отделении интенсивной терапии в случаях адекватной начальной антибактериальной терапии. Смертность среди иммунокомпетентных пациентов составила 20,7 % в случае пневмонии, вызванной Streptococcus pneumoniae, и 28 % при
непневмококковой пневмонии [2].
Этиологические факторы пневмонии
Тяжесть пневмонии и неэффективность стартовой адекватной антибактериальной терапии могут быть обусловлены резистентностью пневмококка и других возбудителей, вируснобактериальными ассоциациями.
По данным исследования Alexander Project, в 2000 г. в Гонконге удельный вес резистентных к пенициллину пневмококков достиг 75 %, в Мексике, Южной Африке и Японии превысил 50 %, в Сингапуре и США он оказался более 30 %, в Канаде и Бразилии – около 20 % и только в России составил лишь 3,2 % [3]. В Европе высокая резистентность регистрируется в Испании, Франции и Словакии – более 50 % [4]. Доля резистентных к эритромицину штаммов пневмококков состав-
ляет 50–80 % в странах Южной Азии и Японии, более 40 % во Франции и Италии, 25 % в США [3, 5]. Самый низкий уровень резистентности в 2000 г.
был отмечен в России и Бразилии (менее 4 %) [4].
Согласно результатам проспективного многоцентрового исследования ПеГАС-III (2006–2009) в России уровень устойчивости пневмококков к пенициллину остается стабильным и не превышает 10 %, при этом преобладают умеренно резистентные штаммы. Все пенициллинрезистентные пневмококки сохраняют чувствительность к амоксициллину и амоксициллину/клавуланату. Резистентность к цефтри-
аксону составляет 2,8 %. Устойчивость к макролидам в среднем не превышает 10 %, но отмечается рост резистентности к клиндамицину [6].
Наиболее высокий уровень резистентности Haemophilus influenzae к ампициллину наблюдается во Франции (34,8 %), США (31,1 %), Словакии (26 %) [7, 8]. В России уровень резистентных к пенициллинам штаммов H. influenzae в 2003–2005 гг. не превысил 5,4 % (по данным исследования
ПеГАС-II) [6].
В ряде исследований продемонстрирована роль вирусно-бактериальных ассоциаций возбудителей при ВП. В Испании M. Angeles Marcos и соавт. идентифицировали этиологию пневмонии в 57 % случаев: 13 % составили вирусы, 33 % – бактерии, 10 % – вирусы и бактерии. Превалировал пневмококк (29 %, 58 пациентов), на втором месте были респираторные вирусы (23 %, 46 пациентов) [9]. Аналогичные
данные опубликованы в Европейском респираторном журнале в 2008 г. M. Camps Serra и соавт. выявили вирусную и вирусно-бактериальную этиологию пневмонии у 12 и 13 % иммунодефицитных пациентов соответственно; не удалось выявить возбудитель в 34 % случаев [10].
Адъювантная терапия
Поскольку за последние годы рынок антибактериальных препаратов практически не изменился, взгляды ученых обращаются к поиску новых схем и комбинаций антибиотиков, а также к адъювантной терапии. Интересные данные опубликовали в 2008 г. I.I. Siempos и соавт. в систематическом обзоре,
посвященном адъювантной терапии ВП [11]. Авторы проанализировали уже опубликованные работы, в которых оценивалась эффективность различных препаратов, в частности глюкокортикостероидов (ГКС), активированного протеина С (дротрекогин альфа), антикоагулянтов, гранулоцитоколониестимулирующего фактора (ГКСФ), неинвазивной вентиляции легких при лечении тяжелой пневмонии; статинов, ингибиторов ангиотензинпревращающего фермента, β2-адреноагонистов, оксида азота в терапии нетяжелой ВП у иммунокомпетентных пациентов.
В табл. 1 представлены рекомендации по адъювантной терапии ВП Европейского респираторного общества (ERS) и Американского торакального общества (ATS).
Таблица 1. Рекомендации по адъювантной терапии ВП.
Роль ГКС в лечении тяжелой пневмонии, ОРДС, септического шока по-прежнему остается дискутабельной. В систематическом обзоре J.I. Salluh и соавт., опубликованном в 2008 г., проанализированы работы, посвященные данной проблеме [12]. В табл. 2 представлены сведения о четырех исследованиях применения ГКС при ВП.
Таблица 2. Исследования ГКС при ВП.
Только в двух исследованиях было показано положительное влияние ГКС на выживаемость пациентов.
В отечественной литературе в отношении ГКС имеются следующие рекомендации: возможно использование низких доз ГКС (гидрокортизон 100 мг 3 раза в сутки в течение 5–10 дней) при “рефрактерном” септическом шоке, подозрении на недостаточность надпочечников (больные с предшествующим приемом стероидов) [13].
Исследование PROWESS показало биологическую активность активированного протеина С (дротрекогин альфа) и его клиническую эффективность для больных тяжелым сепсисом со статистически достоверным снижением относительного риска летального исхода на 19,4 % и абсолютным снижением летальности на 6,1 % [14]; при ретроспективном анализе данных пациентов с пневмонией без сепсиса различий по смертности не получено. Патогенетические эффекты дротрекогина альфа связаны с его антитромботическим действием (ингибирование Va- и VIIIa-факторов свертывания крови), непрямым профибринолитическим действием (подавляет ингибитор активатора плазминогена-1 и ограничивает выработку тромбинактивируемого ингибитора фибринолиза), а также противовоспалительным действием, обусловленным подавлением фактора некроза опухолей, блокированием адгезии лейкоцитов к селектинам, ограничением тромбининдуцированной воспалительной реакции в эндотелии сосудов микроциркуляторного русла.
Антикоагулянты применяются в случаях тяжелой пневмонии, осложненной ДВС-синдромом, ОРДС: рекомендуется введение гепарина до 20 тыс. ЕД в сутки под кожу живота (4 раза в сутки по 5000 ЕД), или инфузаматом капельно, или ежечасными внутривенными инъекциями под контролем активированного частичного тромбопластинового времени (оно не должно увеличиваться более чем в 2 раза по сравнению с нормой) либо введение низкомолекулярных гепаринов в терапевтических дозировках.
В ряде небольших исследований изучалось применение ГКСФ в лечении ВП и сепсиса. Достоверной эффективности в отношении летальности и длительности госпитализации не было установлено ни в исследовании S. Nelson и соавт. (1998), ни в мультицентровом двойном слепом плацебоконтролируемом исследовании по использованию филграстима у пациентов с тяжелой пневмонией и сепсисом (R.K. Root и соавт., 2003). Первое исследование, однако, показало, что применение филграстима пациентами
с ВП, возможно, снижает риск осложнений (ОРДС, ДВС-синдром, эмпиема) [15, 16].
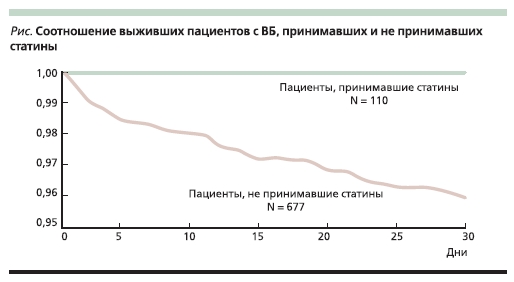
В отношении среднетяжелой ВП исследований еще меньше. E.M. Mortensen и соавт. опубликовали результаты двух исследований, в которых было продемонстрировано снижение 30-дневной летальности среди пациентов, принимавших до пневмонии ингибиторы ангиотензинпревращающего фермента и статины [17, 18]. На рисунке представлено соотношение выживших пациентов с ВБ, принимавших и не принимавших статины.
Есть некоторые данные, что N-ацетилцистеин – антиоксидант, применяемый при разнообразных воспалительных заболеваниях органов дыхания, может также использоваться в адъювантной терапии ВП, т. к. с патогенетической точки зрения основу воспалительных процессов различной этиологии составляет окислительный стресс. Наше внимание привлекла работа А.Л. Аляви и Г.А. Курбановой
(2007), в которой было проанализировано состояние обмена оксида азота при включении N-ацетилцистеина в комплексную терапию больных ВП. В исследование были включены 35 пациентов, половина из которых получала N-ацетилцистеин в стандартной дозировке 600 мг/сут. У всех пациентов в активную фазу заболевания в эритроцитах и конденсате выдыхаемого воздуха регистрировалось увеличение уровня оксида азота, пероксинитрита, активности нитратредуктазы на фоне выраженной депрессии фермента НАДФН-диафоразы. В группе больных, получавших N-ацетилцистеин, к 10-му дню лечения вышеуказанные показатели нормализовались, в то время как у остальных пациентов их уровень снизился, но не достиг показателей здоровых лиц. Таким образом,
N-ацетилцистеин способствует восстановлению внутриклеточного баланса оксида азота и улучшает течение пневмонии [19].
В отношении эффекта N-ацетилцистеина при лечении ОРДС существует много зарубежных публикаций, в которых не отмечено различий по летальности в группах без N-ацетилцистеина и при применении высоких доз препарата, но в ряде случаев снижались время респираторной поддержки и частота мультиорганной недостаточности. В 2010 г. опубликованы результаты исследования,
проведенного в НИИ пульмонологии под руководством С.Н. Авдеева и А.Г. Чучалина, в котором пациентам с ОРДС на фоне вирусной пневмонии N-ацетилцистеин вводился в течение 7 дней в дозе 70 мг на 1 кг массы тела в сутки.
И хотя различий по летальности получено не было, была отмечена тенденция к уменьшению длительности респираторной поддержки и времени пребывания больных в отделении реанимации и интенсивной терапии и в стационаре за счет более быстрого и значительного улучшения показателей
оксигенации (через 1 сутки PaO2/FiO2 253 ± 29 против 178 ± 24 мм рт. ст.; р = 0,05), повышения сердечного индекса (от 2,52 ± 0,11 до 2,66 ±0,13 л/мин/м2; р = 0,034) и ударного объема левого желудочка (прирост от 50 ± 6 до 58 ± 8 мл; р = 0,041). Также отмечалась тенденция к уменьшению числа случаев полиорганной недостаточности (23,1 против 64,3 %; р = 0,077) [20].В заключение следует отметить, что хотя адъювантная терапия ни в коем случае не заменяет антибактериальную терапию, при ряде патологических состояний (в частности, ОРДС) она может улучшать прогноз. В
настоящее время продолжается поиск оптимальных адъювантных препаратов лечения ВП и режимов их дозирования.



