Легочная гипертензия
Легочная гипертензия (ЛГ) является грозным осложнением бронхолегочной дисплазии (БЛД). Частота
развития ЛГ при БЛД до настоящего времени достоверно не определена, зависит от популяции и возраста пациентов, конкретной нозологической формы, а частота выявляемости – от используемого метода диагностики. На первом году жизни у этих пациентов частота ЛГ составляет 21 %, легочного
сердца (ЛС) – 6 % [1]. Таким образом, в настоящее время ЛС у детей с БЛД регистрируется гораздо реже по сравнению с ее частотой при первоначальном описании заболевания [2], что можно связать с патоморфозом БЛД.
Выраженная ЛГ является единственным независимым предиктором неблагоприятного прогноза и смерти детей с БЛД [3]. С ЛГ связаны некоторые случаи относительно поздней смерти (после шести месяцев) детей с БЛД даже при улучшении симптомов паренхиматозного заболевания легких.
Патогенез легочной гипертензии
Патогенез ЛГ заключается в прогрессирующем сужении просвета мелких и средних ветвей легочной артерии (ЛА), развитии воспаления мышечного слоя с последующим его разрушением. В результате в ЛА постепенно повышается давление в малом круге кровообращения. Критерием наличия ЛГ при хронических заболеваниях легких является повышение среднего давления в ЛА в условиях покоя
выше 25 мм рт. ст. (в норме данный показатель находится в пределах 9–16 мм рт. ст.). Постоянный рост давления в ЛА передается правому желудочку, вызывая утолщение его стенки (гипертрофию). Со временем правый желудочек перестает справляться с прогрессирующей ЛГ, что приводит к
снижению его сократительной (насосной) функции (правожелудочковая недостаточность).
Классификация
Общепринятой классификации вторичной ЛГ, связанной с гипоксемией, не существует. Различные
классификации учитывают тяжесть и этиопатогенетические признаки. Легочная гипертензия, связанная с патологией дыхательной системы и гипоксией, входит в современную классификацию повышенного давления в малом круге кровообращения, разработанную группой экспертов ESC (European Society of Cardiology) и ERS (European Respiratory Society) [4]. В новой Панамской классификации ЛГ (PVRI – Pulmonary vascular resistance index, 2011) педиатрической рабочей группы Института изучения заболеваний сосудов легких ЛГ, обусловленная заболеваниями легких и гипоксемией, представлена рядом категорий заболеваний (табл. 1).
Таблица 1. Место легочной гипертензии, обусловленной заболеваниями легких и гипоксемией,
в классификации гипертензионной сосудистой болезни легких у детей (PVRI).
Данная классификация подчеркивает еще одно принципиальное отличие ЛГ у детей от таковой у взрослых – возможность развития заболевания в процессе онтогенеза легких и их сосудов, в особенности в перинатальном периоде. Любые влияния на сосуды легкого в пре- и постнатальном
периодах могут приводить к нарушению адаптации, дефектам развития и задержке роста. Проявлениями альтерированного онтогенеза являются легочная гипоплазия, БЛД, альвеолярноапиллярная дисплазия [5, 6]. Помимо этого данная классификация подчеркивает многофакторный генез ЛГ у пациентов детского возраста даже при конкретных нозологических формах. Например, при БЛД или интерстициальных заболе-ваниях легких развитие ЛГ возможно
на почве гипоплазии легких и/или задержки развития сосудов легких, генетических синдромов. У пациентов с БЛД может иметь место ЛГ,
связанная с задержкой роста сосудов, перемежающейся хронической гипоксией, гиперкапнией из-за
повреждения ткани легкого и воздухоносных путей, с диастолической дисфункцией, стенозом легочных вен, врожденными пороками сердца (ВПС), с системно-легочным шунтом [3, 7, 8].
Лечение
В лечении ЛГ используются следующие препараты: кислород, диуретики, дигоксин (при прогрессировании недостаточности кровообращения), антикоагулянты, вазодилататоры (при положительном тесте на вазореактивность), антагонисты эндотелина, простагландины и их аналоги, ингибиторы фосфодиэстеразы, хирургические методы лечения (межпредсердное шунтирование, трансплантация легкого, легочно-сердечная трансплантация). Среди антагонистов эндотелиновых рецепторов А и В выделяют препарат бозентан. По результатам последних исследований, бозентан рекомендован для лечения ЛГ II функционального класса в США и Европе у детей с 2 лет, что делает его единственным, разрешенным в педиатрии препаратом. В России бозентан используется в лечении легочной артериальной гипертензии у детей с 3-летнего возраста. Необходимо отметить, что бозентан – единственный зарегистрированный препарат специфической терапии легочной артериальной гипертензии, имеющийся в данный момент на территории России. Детям бозентан назначают с учетом массы тела (100 мг/кг/сут).
Бронхолегочная дисплазия
Бронхолегочная дисплазия (БЛД) – это полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом глубоко недоношенных детей, в результате интенсивной терапии респираторного дистресс-синдрома и/или пневмонии.Протекает с преимущественным поражением бронхиол и паренхимы легких, развитием эмфиземы, фиброза и/или
нарушением репликации альвеол; проявляется зависимостью от кислорода в возрасте 28 суток жизни и старше, бронхообструктивным синдромом и симптомами дыхательной недостаточности. Характеризуется специфичными рентгенографическими изменениями в первые месяцы жизни и регрессом клинических проявлений по мере роста ребенка [9].
Диагностика
Критерии диагностики:
• искусственная вентиляция легких (ИВЛ) на первой неделе жизни и/или респираторная терапия с постоянным положительным давлением в дыхательных путях через носовые катетеры (NCPAP – nose continious positive airway pressure);
• терапия кислородом более 21 % в возрасте 28 дней и старше (кислородозависимость);
• дыхательная недостаточность, бронхообструктивный синдром в возрасте 28 дней и старше, зависимость от кислорода, развивающаяся при проведении кислородотерапии (ИВЛ, NCPAP);
• интерстициальный отек, чередующийся с участками повышенной прозрачности легочной ткани,
фиброз, лентообразные уплотнения на рентгенограмме грудной клетки. Диагноз “бронхолегочная дисплазия” правомерен в качестве самостоятельного только для детей до 3-летнего возраста. В более старшем возрасте БЛД указывается лишь как заболевание, имевшее место в анамнезе.
Основным методом диагностики заболевания считается рентгенологический (рентгенография и компьютерная томография грудной клетки). Для объективной оценки степени выраженности рентгенографических изменений Г.В. Яцык, И.В. Давыдова, О.В. Кустова в 2010 г. предложили и
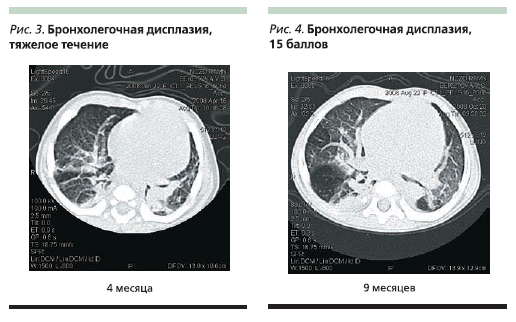
запантентовали шкалу, по которой каждый диагностический признак оценивался от 0 до 3 баллов, причем оценка в 0 баллов означала отсутствие признака [10, 11]. Баллы суммировались: при сумме баллов от 1 до 5 диагностировалось легкое течение, при сумме баллов от 6 до 10 – среднетяжелое течение, а при сумме баллов от 11 до 15 – тяжелое течение БЛД (табл. 2).
Таблица 2. Рентгенографическая шкала балльной оценки степени тяжести БЛД, по данным МСКТ.
Лечение
Детям со сформировавшейся БЛД показана длительная (до 6–12 месяцев) базисная терапия кортикостериодами, в настоящее время предпочтение отдается ингаляционным глюкокортикостероидам (будесонид) 500–100 мкг/сут через компрессионный небулайзер. Критерием отмены будесонида служит отсутствие бронхообструктивного синдрома при очередной острой респираторной вирусной инфекции (ОРВИ). В остром периоде показано применение диуретиков (фурасемид 2 мг/кг), бронхолитиков (Беродуал 1 капля на 1 год жизни через небулайзер 3–4 раза/сут),
кардиотрофиков, антибиотикотерапия по показаниям. При необходимости дополнительной оксигенации желательна сатурация SaO2 ≥ 92–95 % у детей, формирующих cor pulmonale до
96 %. [11, 12].
Клинический случай
В отделение восстановительного лечения детей с сердечно-сосудистыми заболеваниями поступила девочка В. в
возрасте 4 лет 9 месяцев (22.01.08 г. р.) с жалобами на одышку в покое, быструю утомляемость, слабость. При сборе анамнеза стало известно, что ребенок от первой беременности, протекавшей
с респираторной инфекцией на 33-й неделе. Роды у матери самостоятельные, на 39-й неделе, воды при рождении мекониальные. Девочка родилась доношенной с массой тела 3140 г, длиной 55 см. Состояние при рождении было оценено как крайне тяжелое за счет мекониальной аспирации, дыхательной недостаточности и неврологической симптоматики, проводились реанимационные мероприятия. До 3,5 месяцев жизни находилась в реанимационном отделении ДКБ Люберец с
диагнозом “внутриутробная пневмония неясной этиологии”. В течение 51 суток проводили ИВЛ. С возраста 3,5 месяцев ребенок наблюдается в Научном центре здоровья детей РАМН с диагнозом “БЛД доношенных, тяжелое течение, период обострения. Врожденный порок сердца: Открытый
артериальный проток. Дефект межжелудочковой перегородки. Дефект межпредсердной перегородки. Легочная гипертензия. Сердечно-легочная недостаточность 1–2 А. Врожденный порок зрительного анализатора – аниридия”.
Отмечена длительная кислородозависимость, девочка нуждалась в постоянной подаче О2 с помощью кислородного концентратора через носовые канюли с рождения до 3 лет, после 3 лет –в периоды ОРВИ. Ингаляционную терапию препаратом будесонид получала в дозе 250 мкг 2 раза в сутки до
2 лет непрерывно в связи с тяжестью состояния, после 2 лет – в периоды ОРВИ. С 3,5 месяцев проводили терапию препаратами: каптоприл, дигоксин, Триампур композитум, фуросемид. Лекарственные препараты давались нерегулярно и самостоятельно были отменены мамой в июне 2011 г. в связи с недооценкой тяжести состояния ребенка. Ребенок поступил на очередное обследование после 6 месяцев отсутствия поддерживающей терапии в возрасте 4 лет 9 месяцев (рис. 1)
Рисунок 1. Внешний вид больной.
Состояние при поступлении тяжелое. Вынужденное положение тела с приведенными вперед плечами. Масса тела ребенка – 13,5 кг, рост – 102 см, физическое развитие ниже среднего, акроцианоз, фенотип по кушингоидному типу. Деформация левой половины грудной клетки, формирование “сердечного горба”. Аускультативно в легких дыхание ослаблено, проводится неравномерно, хрипов нет. Одышка в покое до 40 дыханий в минуту с участием вспомогательной мускулатуры. Аускультативно выслушивается грубый систолический шум, проводящийся по всей грудной клетке, акцент второго тона на основании слева. Перкуторно границы относительной сердечной тупости (левая – +1,5 см от
среднеключичной, правая – +1 см от края грудины, верхняя – 3-е межреберье). Печень и селезенка пальпаторно не увеличены. При лабораторном обследовании в общем анализе крови от 26.10.12: эритроциты – 5,68 (3,9–5,3) млн, гемоглобин – 162 (115–140) г/л, гематокрит – 50 (34–40) %, тромбоциты – 295 тыс., лейкоциты – 7,34 тыс., сегментоядерные – 52 %, лимфоциты – 33 % (35–55), моноциты – 6,7 %, СОЭ – 4 мм/ч, SaO2 – 88–87 % без дополнительной подачи кислорода в покое, изменения характерны для гипоксии ткани.
На электрокардиограмме резкое отклонение электрической оси сердца вправо, миграция водителя ритма из синусового узла в миокард правого предсердия, выраженная аритмия, признаки гипертрофии миокарда правого желудочка, неспецифическая внутрижелудочковая блокада. По данным эхокардиографии (ЭхоКг), открытое овальное окно, мышечный дефект межжелудочковой перегородки; умеренная дилатация правого желудочка (23 мм); тотальная недостаточность клапана легочной артерии, выраженная дилатация ствола (до 35 мм) и ветвей (правая 17 мм, левая 17,5 мм);
дилатация легочных вен, митральная регургитация 1-й степени, дилатация восходящей аорты (14 мм), незначительный стеноз аортального клапана, глобальная и локальная систолические функции левого желудочка удовлетворительные, насосная функция сердца достаточная, легочная гипертензия
2-й степени (давление в малом круге кровообращения оценить в абсолютных значениях не представлялось возможным, давление в ЛА равно или выше системного, артериальное давление (АД) ребенка – 95/55 мм рт. ст.), явных данных за патологическийсброс в проекции бифуркации ствола
ЛА не получено. По данным ЭхоКг, в динамике на фоне терапии каптоприлом и фуросемидом отмечена нормализация экскурсии передней стенки правого желудочка (было 4,5 мм, стало 6 мм), уменьшение размеров правого желудочка (было 23 мм, стало 19 мм). Измерение давления в ЛА с помощью
инвазивных поднаркозных методик не проводили в связи с тяжелым состоянием ребенка и эпизодами апноэ во время наркоза в анамнезе.
Для подтверждения наличия у ребенка открытого артериального протока (ОАП) и диагностики характера поражения легких ребенку неоднократно проводилась компьютерная томография органов грудной полости с применением внутривенного болюсного контрастирования, результаты оценены в динамике с возраста 4 месяцев. Компьютерная томограмма подтвердила наличие сосудистого сообщения между ЛА и аортой, легочное устье которого расположено непосредственно слева от бифуркации ствола ЛА, аортальное по переднелатеральной стенке аорты, дистально от начала левой
подключичной артерии (топографоанатомическое расположение соответствует ОАП). Прослеживается нарастание калибра ОАП на фоне нерегулярного приема препаратов и полной отменой мамой всей терапии в ворасте 3,5 лет. ОАП нарастало с 9 мм в 4 месяца до 19 мм в настоящее время (рис. 2). Прогрессивно увеличивался ствол ЛА – с 17 мм в 4 месяца до 35 мм в настоящее время.
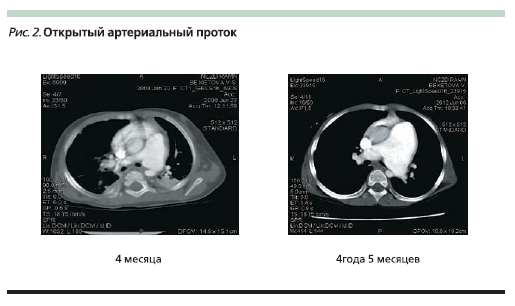
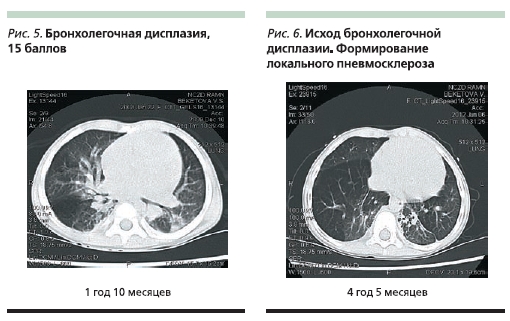
Картина в легких, по данным компьютерной томографии в 4 месяца, представляла собой тяжелое двустороннее поражение легких, соответствующее БЛД с максимальной суммой 15 баллов по оценочной шкале (табл. 2, рис. 3). С 9 месяцев до 1 года 10 месяцев отмечено увеличение объема здоровой легочной ткани. Улучшалась пневмотизация легочной ткани. Сохранялась неравномерность пневмотизации с участками повышенной воздушности и множественными транспульмональными тяжами, деформирующими листки костальной плевры (рис. 4–5). Объем нижней доли левого легкого
был несколько уменьшен, сформирован локальный пневмосклероз S10 нижней доли левого легкого (рис. 6).
На основании данных анамнеза, проведенных лабораторных и инструментальных методов исследования ребенку выставлен клинический диагноз “врожденный порок сердца: ОАП. Дефект межпредсердной перегородки. Дефект межжелудочковой перегородки, гемодинамически незначимый мышечный дефект. Тотальная недостаточность клапана ЛА. Недостаточность митрального клапана. Незначительный стеноз аортального клапана. Высокая ЛГ. Облитерирующий бронхиолит.
Бронхолегочная дисплазия в анамнезе. Локальный пневмосклероз S10 нижней доли левого легкого. Сердечно-легочная недостаточность II степени. Врожденный порок зрительного анализатора – аниридия.
Ребенку возобновлена терапия каптоприлом в дозе 1 мг/кг/сут (15 мг/сут) в три приема. В настоящее
время получает эналаприл 0,3 мг/кг/сут. Продолжена терапия фурасемидом в дозе 1/8 таблетки в сутки, утром. Однозначного мнения о возможном введении в терапию препарата бозентана на данный момент нет. Кислородотерапия и ингаляционная терапия будесонидом рекомендованы в периоды ОРВИ”.
В настоящее время ЛГ у ребенка является вторичной на фоне сочетанного поражения кардиореспираторной системы. Кислородотерапия и ингаляционная терапия будесонидом способствовала регрессу первоначальных изменений в легких с исходом в облитерирующий бронхиолит и локальный пневмофиброз. Отмена мамой кардиальной терапии способствовала декомпенсации состояния ребенка. Вопрос о сроках и целесообразности закрытия ОАП для этого ребенка остается открытым, т. к. на данном этапе ОАП, вероятно, является единственным компенсаторным сосудистым сообщением, предотвращающим резкое ухудшение состояния ребенка.



