Введение
Болезнь Крона (БК) – это хроническое рецидивирующее заболевание желудочно-кишечного тракта, характеризующееся воспалением всех его слоев с развитием местных и системных осложнений. Этиология болезни Крона многофакторна, и некоторые аспекты до сих пор остаются неясными. Во всем мире заболеваемость воспалительными заболеваниями кишечника (ВЗК) составляет 5–8 случаев на 100 000 человек в год. Основной пик заболеваемости приходится на возраст 20–40 лет, меньший — на 50–70 лет. Среди больных болезнью Крона 15–20% составляют пациенты моложе 20 лет, что говорит о социальной значимости ВЗК [1].
При БК характерно поражение от ротовой полости до анального отверстия, выраженность патологического процесса может варьироваться от случая к случаю. Согласно современным наблюдениям, большой процент пациентов с БК не обходится без оперативного лечения [2], т.к. полного излечения заболевания не наступает.
Долгое время терапия БК была ограничена глюкокортикостероидами (ГКС) и иммуномодуляторами, а хирургическое лечение являлось единственным альтернативным вариантом для этих пациентов. С открытием генно-инженерных биологических препаратов (ГИБП), в т.ч. ингибиторов фак-тора некроза опухоли альфа (ФНО-α), появилась возможность консервативного ведения пациентов и контроля активности БК [3, 4].
Количество лекарственных средств из группы ГИБП с различными механизмами действия постоянно увеличивается. Однако, несмотря на это разнообразие препаратов, подходы к терапии, доступные в настоящее время, случаи развития первичной неэффективности (15–30%), потери ответа (вторичная неэффективность у 46%) не всегда способны обеспечить стойкую ремиссию у более чем 50% пациентов с хроническим течением ВЗК [5–7]. На первый ингибитор ФНО-α, согласно исследованиям, со временем снижается клинический ответ: в течение года ответ теряют около 20% пациентов с ВЗК, в 50% случаев пациенты с БК и более 60% пациентов с ЯК имеют как минимум один показатель недостаточной эффективности терапии в течении 2 лет [8–11].
Поэтому вопросы оптимизации и подбора наиболее эффективных препаратов остаются актуальными. Необходимо учитывать индивидуальные особенности каждого пациента, постоянно оценивать результаты терапии для выбора наиболее подходящего лекарства, с учетом баланса между эффективностью и безопасностью. Также важно проводить дальнейшие исследования с целью разработки новых лекарств, совершенствование маршрутизации для своевременного оказания помощи и улучшения имеющихся методов лечения воспалительных заболеваний кишечника.
Клиническое наблюдение
Пациентка В. наблюдается в МКНЦ им. А.С. Логинова с июня 2021 г. Из анамнеза известно, что с 2015 г. пациентка наблюдается в РДКБ, где впервые был выставлен диагноз «болезнь Крона». С декабря 2015 г. получала ГИБП инфликсимаб (Ремикейд) 400 мг по схеме каждые 8 недель. Чувствовала себя хорошо. В октябре 2019 г. зарегистрирована первичная неэффективность инфликсимаба, в связи с чем больная переведена на препарат адалимумаб (Хумира) 40 мг каждые 8 недель с положительным эффектом, чувствовала себя хорошо, рекомендации соблюдала. В ноябре 2020 г. амбулаторно при плановом обследовании в НМИЦК им. А.Н. Рыжих, по данным мультиспиральной компьютерной томографии (МСКТ) и энтерографии брюшной полости, контрастным усилением выявлена болезнь Крона с поражением терминального отдела тонкой кишки, активная фаза. При колоноскопии (КС) выявлены признаки болезни Крона в фазе обострения, рубцово-воспалительное сужение (до 0,6 см) илеоцекального клапана, эрозия (до 0,5 см) в зоне клапана.
К терапии добавлен топический ГКС будесонид 9 мг–6 мг–3 мг с последующей отменой, продолжена терапия адалимумабом (Хумира) 40 мг, п/к.
В июне 2021 г. находилась на плановом стационарном лечении в отделении гастроэнтерологии МКНЦ им. А.С. Логинова. При ультразвуковом исследовании (УЗИ) органов брюшной полости и кишечника выявлены признаки воспалительных изменений стенки терминального отдела подвздошной кишки с сужением просвета кишки, умеренно-выраженных, скудного количества свободной жидкости в полости малого таза. При КС – эндоскопическая картина болезни Крона в форме терминального илеита, оценка активности по шкале SES-CD, 9 баллов, с деформацией и сужением просвета илеоцекального клапана и терминального отдела подвздошной кишки. При мультиспиральной компьютерной томографии (МСКТ) и энтерографии брюшной полости контрастным усилением: МСКТ – картина утолщения стенок подвздошной кишки, вероятно воспалительного характера, с сужением ее просвета (может соответствовать стриктуре).
В показателях крови отмечено снижение гемоглобина и железа. По совокупности проведенных исследований у пациентки зафиксирована вторичная неэффективность препарата адалимумаб. Рекомендована смена ГИБП с другим механизмом действия. Назначена консервативная терапия антибактериальными препаратами, препаратами 5-АСК, препаратами железа, иммунодепрессантами (Азатиоприн), системными ГКС внутривенно капельно с последующим снижением дозы препарата и переходом на пероральную форму. На фоне проводимой терапии состояние с положительной динамикой – улучшение общего самочувствия, стул 1–2 раза в сутки без примесей; боли в животе не беспокоили. Однако при снижении дозы ГКС пациентка отметила учащение стула, в последующем самочувствие постепенно ухудшилось, появились боли в животе.
В сентябре 2021 г. пациентка вновь госпитализирована в МКНЦ им. А.С. Логинова. 10.09.2022 проведена 1-я индукционная инфузия препарата Устекинумаб 390 мг в/в капельно без осложнений. Уже после первого введения Устекинумаба состояние пациентки улучшилось: стул уредился до 3 раз в сутки, боли в животе уменьшились. Далее амбулаторно продолжила введение Устекинумаба 90 мг п/к каждые 12 недель и прием азатиоприна 100 мг в сутки, препаратов 5-АСК 4 г в сутки.
В апреле 2022 г. пациентка отметила спастические боли и пальпируемое уплотнение в правой подвздошной области. Госпитализирована в отделение гастроэнтерологии МКНЦ им. А.С. Логинова ДЗМ. По данным УЗИ органов брюшной полости и кишки выявлены эхопризнаки скудного количества свободной жидкости в полости малого таза, выраженные воспалительные изменения терминального отдела подвздошной кишки, мезентериального панникулита. При эзофагодуоденоскопии (ЭГДС) – очаги гиперплазии слизистой оболочки двенадцатиперстной кишки (вероятно, полностью эпителизированные эрозии). Результат экспресс-теста на H. pylori «-» отрицательный. При КТ-энтерографии брюшной полости с контрастным усилением: КТ – картина соответствовала проявлениям активного терминального илеита с поражением баугиниевой заслонки, прилежащих отделов слепой кишки, а также с перифокальным отеком жировой клетчатки брыжеек с формированием воспалительного инфильтрата, с реактивной лимфаденопатией указанной локализации. Спленомегалия. По данным КС, КТ-энтерографии, у пациентки выявлена стриктура илеоцекального клапана с перифокальным отеком жировой клетчатки брыжеек с формированием воспалительного инфильтрата. На фоне проведенной консервативной терапии азатиоприном, препаратом Устекинумаб, положительного эффекта не получено. Таким образом, у пациентки зарегистрировано «ускользание» эффекта от терапии устекинумабом и с учетом данных инструментальных исследований, неэффективности базисной консервативной терапии и риска развития хирургических осложнений принято решение о проведении хирургического лечения в плановом порядке. Также проведена оптимизация терапии устекинумабом: введение подкожно по 90 мг каждые 8 недель.

В условиях отделения общей хирургии МКНЦ им. А.С. Логинова ДЗМ 20.04.2022 выполнено оперативное вмешательство – лапароскопическая илеоцекальная резекция. Формирование илеоасцендоанастамоза. Дренирование брюшной полости. Выписана с улучшением. После выписки пациентка продолжила прием препаратов 5-АСК 4 г в сутки, азатиоприна 100 мг в сутки, введение устекинумаба 90 мг подкожно по оптимизированной схеме каждые 8 недель.
Последнее обследование пациентки было в ноябре 2022 г. По данным КС: осмотр 40 см тонкой кишки после анастомоза – без воспаления, состояние после лапароскопической илеоцекальной резекции от 04.2022. Эндоскопическая картина ремиссии БК в форме илеококолита. По лабораторным данным, признаков воспаления не отмечено (СРБ, СОЭ, лейкоциты, тромбоциты в пределах референсных значений). В дальнейшем пациентка чувствовала себя хорошо, рекомендации соблюдала. Контрольное обсле-дование запланировано через 12 месяцев.
Обсуждение
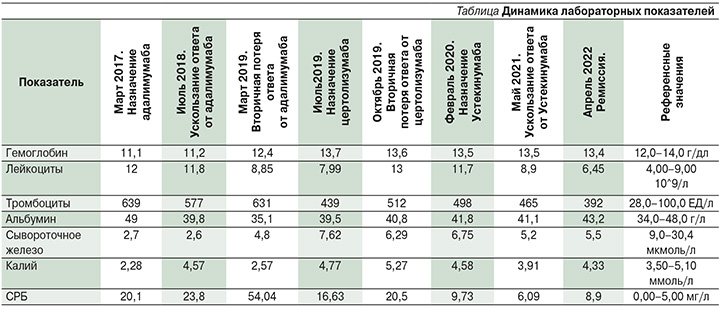
Рецидивирующий характер течения болезни Крона, высокая вероятность поражения любого отдела ЖКТ требует проведения длительной консервативной терапии и контроля клинических данных, лабораторных показателей (гемоглобин, лейкоциты, СОЭ, СРБ, альбумин, железо, электролитный баланс, кальпротектин кала, копрограмма) см. таблицу, эндоскопической картины регулярно для оценки тяжести течения и уровня воспалительной активности заболевания. Вышеуказанные данные позволяют своевременно выявлять отсутствие эффекта ГИБП и принимать меры по оптимизации или смене ГИБП. Согласно современным данным, в отсутствие эффекта от терапии через 8–12 недель (после окончания индукционной фазы) от момента начала регистрируется первичная неэффективность ГИБП, а потеря эффекта от ранее успешно проводимой терапии по клиническим, лабораторным, эндоскопическим, рентгенологическим данным регистрируется как вторичная неэффективность ГИБП. Также существует понятие «ускользание эффекта» от терапии ГИБП, которая характеризуется отсутствием достижения ремиссии или сохраняющейся минимальной или умеренной активностью ВЗК по данным клинико-лабораторных и инструментальных методов исследования [12].
Руководствуясь клиническими рекомендациями Европейского общества касательно таких заболеваний, как ЯК и БК (ЕССО), нужно отметить, что в случае развития неэффективности от двух биологических препаратов группы ингибиторов ФНО-α рекомендован переход на ГИБП с другим механизмом действия.
С 2019 г. в Российской Федерации для лечения больных БК зарегистрирован и начал широко применяться ГИБП Устекинумаб. В 2020 г. препарат начал применяться и для лечения ЯК. Устекинумаб представлен полностью человеческим моноклональным антителом IgG1κ, специфично связывающимся с общей единицей белка p40 интерлейкина 12 (ИЛ-12) и ИЛ-23 человека. Препарат ингибирует биоактивность ИЛ-12 и -23 человека, тем самым предотвращая связывание p40 с рецептором ИЛ-12Rβ1, который экспрессирует на поверхности иммунных клеток. ИЛ-12 или -23 на поверхности клеток связан с рецепторами ИЛ-12Rβ1, соответственно, связывания с ними устекинумаба не происходит. Повлиять на клиническое течение БК и ЯК возможно путем прерывания выработки цитокинов Th1 и -17, играющих основную роль в патогенезе этих заболеваний, что и делает устекинумаб, связывая общую субъединицу p40 ИЛ-12 и -23. Биологическая терапия Устекинумабом пациентов с БК и ЯК показала положительный результат в виде улучшения общего самочувствия пациентов, а также снижения уровней воспалительных маркеров (СОЭ, СРБ, фекального кальпротектина) [13].
Данный клинический случай демонстрирует своевременное назначение и подбор биологической терапии, диагностику потери ответа на биологический препарат, оптимизацию схемы лечения ГИБП и смену ГИБП на биологический препарат с другим механизмом действия (ингибитор интерлейкинов 12/23 – устекинумаб) у пациентки с БК.
Применение устекинумаба у данной пациентки с БК, несмотря на прогрессирующее и трудноконтролируемое течение заболевания, привело к достижению быстрого клинического ответа и высокой эффективности терапии, что не противоречит данным предшествовавших многоцентровых исследований, проведенных во всем мире [14–16].
В 2021 г. нами опубликованы данные исследований касательно пациентов, ранее получавших один или несколько анти-ФНО-α-препаратов, у которых была зарегистрирована тенденция в необходимости уменьшения интервала введения устекинумаба до 8 недель с целью повышения эффективности проводимой терапии. Данный клинический пример также демонстрирует эту тенденцию [17].
Заключение
Своевременное назначение ГИБП и оптимизация терапии данной пациентки позволили на протяжении длительного времени избегать развития хирургических осложнений и замедлить прогрессирование основного заболевания.
Возможность оказания своевременной и высокотехнологичной медицинской помощи с применением современных ГИБП и смены биологических препаратов при необходимости возра-стает благодаря динамическому наблюдению больных ВЗК ежеквартально (каждые 3 месяца) с оценкой клинической симптоматики, лабораторных данных (СРБ, СОЭ, лейкоциты в крови, кальпротектин кала), проведением УЗИ кишечника (оценка толщины стенки) и выполнением КС по показаниям.



