Актуальность
К настоящему времени убедительно доказана эффективность гиполипидемической терапии в снижении риска атеросклеротических сердечно-сосудистых заболеваний (ССЗ) и связанной с ними смертности, что находит отражение в современных клинических рекомендациях. Причем снижение риска заболеваемости и смертности происходит пропорционально абсолютному снижению уровня холестерина липопротеидов низкой плотности (ЛПНП): на каждый 1 ммоль/л снижения уровня ЛПНП риск серьезных сердечно-сосудистых событий снижается на 22% и риск общей смертности на 10% [1, 2].
Вместе с тем в клинической практике около 80% пациентов не достигают оптимального уровня снижения уровня ЛПНП вследствие недостаточной эффективности терапии, низкой приверженности лечению или побочных эффектов [3]. В связи с этим клинические руководства по контролю уровня холестерина предусматривают комбинированную терапию для пациентов, которые не достигают целевого уровня ЛПНП при монотерапии статинами, что может помочь снижать риск неблагоприятных исходов [4, 5]. Дополнительные или альтернативные методы лечения включают эзетимиб, ингибиторы PCSK9 и секвестранты желчных кислот, которые в рандомизированных плацебо-контролируемых исследованиях снижают уровень ЛПНП и число сердечно-сосудистых событий.
Бемпедоевая кислота (БК) представляет собой новый пероральный ингибитор аденозинтрифосфат-цитратлиазы (adenosine triphosphate-citratelyase). БК в дозе 180 мг/сут одобрена FDA (Food and Drug Administration) в феврале 2020 г. и рекомендована в США и Европейском Союзе (ЕС) в качестве адъюванта к максимально переносимой терапии статинами для снижения уровня холестерина ЛПНП у пациентов с атеросклеротическими ССЗ и семейной гиперхолестеринемией, а также в случаях непереносимости или противопоказаний к применению статинов или в комбинации с эзетинибом [6].
Механизм действия и фармакодинамика
БК подавляет биосинтез холестерина, ингибируя фермент аденозинтрифосфат-цитратлиазу (АТФ-цитратлиаза), который работает выше уровня ГМГ-КоА-редуктазы – мишени действия статинов [7]. На рисунке показан путь биосинтеза холестерина, на который влияет БК. Избыток глюкозы в печени активирует митохондриальный цикл трикарбоновых кислот с образованием промежуточных продуктов пути биосинтеза холестерина и жирных кислот (оксалоацетата и ацетил-КоА). Фермент АТФ-цитратлиаза связывает энергетический метаболизм от углеводов до продукции жирных кислот, катализируя синтез ацетил-КоА, основного субстрата для синтеза жирных кислот и холестерина. БК ингибирует АТФ-цитратлиазу и тем самым ограничивает биосинтез холестерина, что приводит к снижению уровня общего холестерина и ЛПНП.
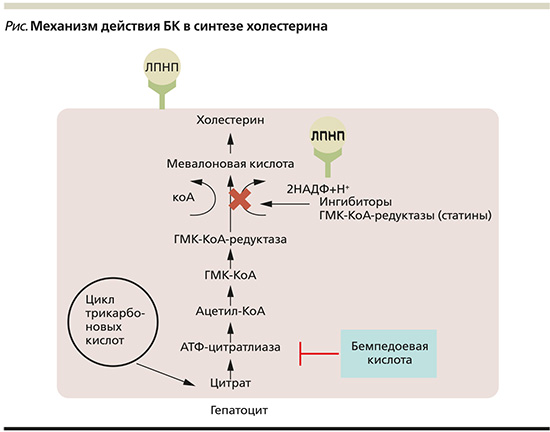
БК является пролекарством, требующим преобразования в активную форму – бемпедоил-КоА – под действием фермента ацил-КоА-синтеазы в печени [8, 9].
Липидоснижающие эффекты бемпедоил-КоА опосредованы ингибированием цитоплазматического фермента АТФ-цитратлиазы, который превращает цитрат в ацетил-КоА в процессе синтеза холестерина, что приводит к усилению регуляции ЛПНП. Ингибируя синтез холестерина в печени, бемпедоил-КоА индуцирует активацию рецептора ЛПНП и стимулирует поглощение частиц ЛПНП печенью, что в свою очередь способствует снижению уровня ЛПНП в крови. Фермент ацил-КоА-синтеаза экспрессируется в печени и почках, но не в скелетных мышцах, поэтому активность БК ограничена почти исключительно печенью. Напротив, активность статинов в мышцах потенциально способствует развитию мышечных симптомов, которые могут приводить к плохой переносимости и/или ограничению использования статинов.
Фармакокинетика
БК всасывается в тонком кишечнике [7]. После многократного введения 180 мг БК средняя максимальная концентрация в плазме (Cmax) составила 20,6 мкг/мл, а площадь под кривой (AUC) – 289,0 мкг×ч/мл. Среднее время достижения максимальной концентрации (Тmax) БК составляет 3,5 часа, при этом равновесное состояние достигается через 7 дней. Пища не влияет на пероральную биодоступность БК, а ее фармакокинетические свойства не зависят от возраста, пола или массы тела. БК на 99% связана с белками плазмы, имеет объем распределения 18 л, соответствующий минимальному внепеченочному распределению. Период полувыведения составляет от 15 до 24 часов [7]. Основными метаболитами БК являются глюкурониды и бемпедоил-КоА. Глюкуронидация происходит с помощью фермента UDP-глюкуронозилтрансферазы-2B7 в печени, почках и нижних отделах желудочно-кишечного тракта. Выведение БК происходит преимущественно почками (клиренс 11,2 мл/мин), при этом 70% выводится с мочой и 30% – с калом. Изменения фармакокинетики у пациентов с почечной и печеночной недостаточностью не являются клинически значимыми и не влияют на профиль эффективности или безопасности БК, коррекции дозы не требуется [10].
БК и ее активный метаболит бемпедоил-КоА не метаболизируются и не взаимодействуют с ферментами цитохрома Р-450, включая CYP3A4 и CYP2C9. В результате не наблюдается лекарственных взаимодействий с препаратами, метаболизирующимися этим путем.
Вместе с тем глюкуронид БК является субстратом для переносчика органических анионов OAT3 и ОАТ2, которые переносят гидрофильные органические анионы, и слабо ингибирует эти транспортеры в концентрациях, намного превышающих клинически значимый диапазон. Слабое ингибирование OAT2 является вероятным механизмом, ответственным за незначительное повышение уровней креатинина и мочевой кислоты в сыворотке, наблюдаемое у пациентов, получавших БК [10].
Наиболее важным лекарственным взаимодействием БК является взаимодействие с симвастатином. Совместный прием симвастатина 20 мг с БК 240 мг или симвастатина 40 мг с БК 180 мг у здоровых добровольцев приводил приблизительно к 2- и 1,5-кратному увеличению AUC и Cmax симвастатина соответственно [9]. Хотя механизм данного взаимодействия остается неясным, следует избегать комбинации БК с дозой симвастатина >20 мг.
Клиническая эффективность
Клинические исследования 1-й фазы показали безопасность и переносимость одно- и многократных доз БК у здоровых людей, а также у лиц с легкой дислипидемией. Результаты по гиполипидемической эффективности продемонстрировали снижение уровня холестерина ЛПНП на фоне лечения в диапазоне от 17 до 36% [7].
В 10 клинических исследованиях 2-й фазы изучалась безопасность и эффективность БК на больших когортах пациентов с гиперхолестеринемией, а также в специфических субпопуляциях, включая пациентов с непереносимостью статинов, пациентов, получающих низко- или высокоинтенсивную терапию статинами, пациентов, одновременно принимающих эзетимиб или эволокумаб, пациентов с сахарным диабетом 2 типа (СД2), артериальной гипертензией – АГ (табл. 1). По результатам данных исследований, применение БК в монотерапии пациентов с гиперхолестеринемией приводит к дозозависимосму снижению уровня ЛПНП в диапазоне 18–32%, а также общего холестерина, аполипопротеина B и высокочувствительного С-реактивного белка, не отмечено изменений уровней триглицеридов и липопротеидов высокой плотности [11, 12]. Применение БК в комбинации со статинами и эзетимибом дополняет гиполипидемический эффект [13–17]. В одном исследовании 2-й фазы оценивались липидоснижающие эффекты БК у пациентов с гиперхолестеринемией и СД2 и наблюдалось значительное снижение уровня холестерина ЛПНП (43 против 4% в группе плацебо; p<0,0001); гликемический контроль не ухудшался в группе БК [19]. У пациентов с гиперхолестеринемией и сопутствующей АГ не отмечено гипотензивной реакции на фоне применения БК [20].

В клинических исследованиях 3-й фазы (серия CLEAR) оценивали безопасность и эффективность БК отдельно или на фоне терапии статинами или эзетимибом. Были изучены различные популяции пациентов с гиперхолестеринемией, включая пациентов с атеросклеротическими ССЗ, гетерозиготной семейной гиперхолестеринемией, с непереносимостью статинов (табл. 2).
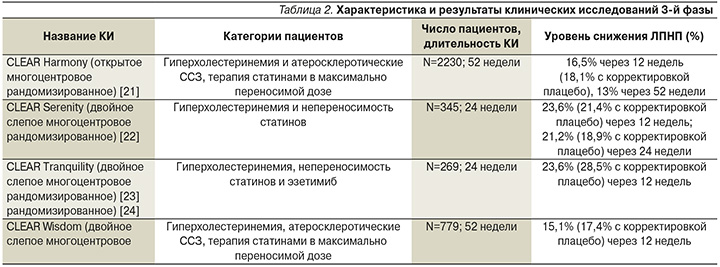
В первом крупном исследовании CLEAR Harmony оценивали безопасность по частоте побочных эффектов, возникающих при лечении БК в дозе 180 мг в дополнение к гиполипидмической терапии статинами пациентов с высоким риском, которые не достигли целевого уровня холестерина ЛПНП, и степень снижения уровня ЛПНП через 52 недели [21]. Частота побочных эффектов составила 78% и не отличалась от группы плацебо, степень снижения уровня ЛПНП составила через 12 недель 16,5%, через 52 недели – 13% (p<0,001).
Исследование CLEAR Serenity проводилось на пациентах с высоким сердечно-сосудистым риском и гиперхолестеринемией, у которых в анамнезе была непереносимость двух статинов, при этом разрешалось участие пациентов, переносивших очень низкие дозы статинов (n=29,8%) на протяжении всего исследования, и оценивалась гиполипидемическая эффективность БК в дозе 180 мг по сравнению с плацебо [22]. Через 12 недель лечения в группе БК отмечалось значимое снижение уровня ЛПНП на 21,4% (р<0,001), а также снижение уровня общего холестерина (-14,8%), аполипопротеина В (-15,0%) и высокочувствительного С-реактивного белка (-24,3%; р<0,001 для всех показателей).
В исследовании CLEAR Tranquility оценивали эффективность БК в дозе 180 мг у пациентов с гиперхолестеринемией и непереносимостью статинов в анамнезе, получавших стабильную гиполипидемическую терапию (т.е. низкие дозы статинов, 31% пациентов) и терапию эзетимибом на протяжении всего исследования [23]. В группе БК дополнительное снижение уровня ЛПНП составило 23,5% (p<0,001), в т.ч. у пациентов, не получавших фоновую терапию статинами и получавших низкие или очень низкие дозы статинов (-34,7% и -20,5% соответственно). На фоне терапии БК также отмечено снижение уровня общего холестерина (-18,0%), аполипопротеина B (-19,3%) и высокочувствительного С-реактивного белка – СРБ (-31,0%; p<0,001 для всех показателей).
Еще в одном исследовании CLEAR Wisdom с участием пациентов с высоким сердечно-сосудистым риском и гиперхолестеринемией, которые не достигли целевого уровня холестерина ЛПНП на фоне липидснижающей терапии статинами проводили оценку эффективности БК в дозе 180 мг по сравнению с плацебо [24]. БК приводила к снижению уровня ЛПНП значительно больше, чем плацебо через 12 недель (-15,1 против 2,4% соответственно; р<0,001). Значительное снижение уровня общего холестерина (-9,9%; р<0,001), аполипопротеина В (-9,3%, р<0,001) и высокочувствительного С-реактивного белка (-18,7%; р=0,04) в группе БК по сравнению с плацебо наблюдалось на 12-й неделе.
После завершения клинических исследований 2-й и 3-й фаз был проведен ряд объединенных мета-анализов клинической эффективности БК, а также побочных эффектов. Так, в мета-анализе 10 РКИ (n=3788) проведена оценка гиполипидемического действия БК [25]. Установлено, что БК приводит к снижению уровня общего холестерина на 14,94% (р<0,001), ЛПНП – на 22,94% (р<0,001), аполипопротеина В – на 15,18% (р<0,001), высокочувствительного СРБ – на 27,03% (р<0,001).
В другом мета-анализе (6 РКИ; n=3956) проводилась оценка риска серьезных неблагоприятных сердечно-сосудистых исходов (МАСЕ) и сердечно-сосудистой смертности и не было получено достоверных различий в группе БК (отношение рисков [ОР]=0,86 и ОР=1,66 соответственно), кроме положительной тенденции в снижении несмертельного инфаркта миокарда (ОР=0,57, доверительный риск [ДИ]: 0,32–1,00) [26]. На фоне терапии БК выявлен более низкий риск новых случаев или ухудшения СД (ОР=0,68, ДИ: 0,49–0,94), но более высокий риск подагры (ОР=3,29, ДИ: 1,28–8,46) и ухудшение функции почек (ОР=4,24, ДИ: 0,98–18,39).
По результатам четырех исследований CLEAR проведено несколько дополнительных анализов по оценке вопросов безопасности применения БК. Так, обобщенная оценка основных побочных эффектов БК (n=3621, среднее время воздействия препарата 363 дня) показала частоту 87,1/100 против 82,9/100 пациенто-лет для плацебо и частоту прекращения приема из-за побочных эффектов – 13,4/100 и 8,9/100 пациенто-лет соответственно [27]. Наиболее частой причиной была миалгия, которая возникала реже при применении БК по сравнению с плацебо (1,5/100 по сравнению с 2,0/100 пациенто-лет). БК была связана с умеренным увеличением уровней азота мочевины в крови, креатинина и мочевой кислоты, а также с снижением уровня гемоглобина, которые проявлялись на 4-й неделе и были обратимыми после прекращения лечения. Частота подагры составила 1,6/100 против 0,5/100 пациенто-лет в группах БК и плацебо. Новые случаи диабета/гипергликемии возникали реже при применении БК по сравнению с плацебо (4,7/100 против 6,4/100 пациентолет) [27].
Более детальное внимание было уделено изучению влияния БК на гликемический обмен. Этот интерес связан с существующими проблемами некоторых гиполипидемических препаратов, в частности статинов, которые могут ухудшать гликемический контроль и увеличивать риск развития новых случаев СД в зависимости от по интенсивности статинов (на 12%, по данным мета-анализа) [28]. Был проведен объединенный анализ 4 исследований CLEAR для оценки изменений гликемии в течение года лечения БК в зависимости от исходного гликемического статуса (диабет, преддиабет или нормогликемия) [29]. Результаты анализа показали, что частота новых случаев СД у пациентов с нормогликемией на исходном уровне (n=618) при применении БК составила 0,3% (против 0,8% в группе плацебо), а у пациентов с преддиабетом на исходном уровне (n=1868) – 4,7% (против 5,9% в группе плацебо). У пациентов с диабетом или преддиабетом в группе БК отмечалось значительное снижение показателя гликированного гемоглобина на -0,12 и -0,06% соответственно (р<0,0001 и р=0,0004) и не было повышения уровня глюкозы натощак по сравнению с плацебо. Таким образом, сделан вывод: БК не ухудшала гликемических параметров и не повышала частоты новых случаев СД по сравнению с плацебо в течение среднего периода наблюдения 1 год.
В объединенном мета-анализе исследований CLEAR дополнительно изучалась эффективность БК у пациентов с метаболическим синдромом (МС) [30]. Пациенты были распределены в 2 группы: с МС (n=936) и без него (n=1573), пациенты с СД были исключены. Значительное с поправкой на плацебо снижение уровня ЛПНП наблюдалось в группе БК (p<0,0001), с более выраженным снижением у пациентов с МС по сравнению с пациентами без МС (-22,3% против -18,4% соответственно; p=0,0472). По сравнению с плацебо БК значительно снижала уровни общего холестерина, аполипопротеина B и высокочувствительного СРБ (p<0,0001), и результаты были сопоставимыми в группе с и без МС. Кроме того, БК способствовала небольшому достоверному снижению уровня гликированного гемоглобина (-0,07%; p<0,0001) и уровня глюкозы натощак (-2,4 мг/дл; p=0,002) у пациентов с МС, тогда как в отсутствие МС влияние было незначимым. Эти данные свидетельствуют, что БК является подходящей терапией для пациентов с МС, которым требуется дополнительное снижение уровня липидов.
В 2023 г. опубликованы результаты нового крупного двойного слепого РКИ (CLEAR Outcomes) по оценке отдаленных сердечно-сосудистых исходов при длительной терапии БК [31]. Были включены 13 970 пациентов, которые не могли принимать статины из-за непереносимости побочных эффектов и имели высокий риск ССЗ. Пациенты принимали БК в дозе 180 мг/сут при средней длительности приема 40,6 месяца. Первичной конечной точкой была комбинация основных неблагоприятных сердечно-сосудистых исходов, включая сердечно-сосудистую смертность, нефатальный инфаркт миокарда, нефатальный инсульт или коронарную реваскуляризацию. Исходный уровень ЛПНП составлял 139,0 мг/дл в обеих группах, а через 6 месяцев снижение уровня ЛПНП было больше в группе БК на 29,2 мг/дл (21,1%). Частота возникновения первичной конечной точки была достоверно меньшей при приеме БК (11,7 против 13,3% на плацебо; ОР=0,87; р=0,004). По вторичным исходам отмечено достоверное снижение частоты случаев фатального и нефатального инфаркта миокарда (3,7 против 4,8% на плацебо; ОР=0,77; р=0,002) и коронарной реваскуляризации (6,2 против 7,6%; ОР=0,81; р=0,001), но не было влияния на частоту инсульта и смертность.
Заключение
БК дополнила арсенал липидснижающих препаратов, что важно в аспекте наличия категорий пациентов с непереносимостью статинов. В проведенных исследованиях БК показала выраженный гиполипидемический эффект как при монотерапии, так и в качестве дополнительного средства у пациентов, принимающих низкие дозы статинов или эзетимиб, которые не достигают целевого уровня ЛПНП. Особенностью гиполипидемического эффекта БК является достоверное снижение уровня высокочувствительного СРБ, что предполагает возможность наличия противовоспалительного действия. Кроме того, в крупном исследовании CLEAR Outcomes БК снижала частоту сердечно-сосудистых исходов преимущественно инфаркта миокарда и реваскуляризации.
БК можно рассматривать для нескольких клинических сценариев:
- Пациенты с атеросклеротическими ССЗ, которые принимают максимально переносимую терапию статинами с эзетимибом или без него, но у которых остается высокий уровень холестерина ЛПНП (показания для США и ЕС) [5, 6].
- Пациенты с атеросклеротическими ССЗ, которые в анамнезе не могут принимать высокие дозы статинов и не желают или не могут получать лечение ингибитором PCSK9 (показания ЕС) [5].
- Пациенты с высоким уровнем холестерина ЛПНП или атеросклеротическими ССЗ, но не принимающие статины, могут быть кандидатами на комбинацию БК и эзетимиба (показания ЕС) [5].
БК хорошо переносится, может применяться пациентами с нарушенной функцией почек и печени без коррекции дозировки. В то же время требуется проведение мониторинга по контролю уровня мочевой кислоты. БК не вызывала симптомов со стороны мышечной системы и не усиливала мышечные симптомы на фоне терапии статинами (включая миалгию и мышечную слабость). В исследованиях 3-й фазы с участием более 3000 пациентов не было зарегистрировано ни одного случая миопатии или рабдомиолиза. Отсутствие дополнительных мышечных симптомов при применении БК при добавлении к статинам может быть объяснено специфичностью действия для печени и отсутствием воздействия активного метаболита бемпедоил-КоА в мышечной ткани. БК не оказывает влияния на риск СД и не ухудшает гликемического контроля у пациентов с СД, что отличает ее от статинов. Ингибирование АТФ-цитратлиазы вызывает снижение печеночного глюконеогенеза, что приводит к лучшему гликемическому контролю.
Заключение
Таким образом, БК в свете существующей доказательной базы может иметь широкое применение при атеросклеротических заболеваниях с возможностью достижения более низких целевых значений ЛПНП.



