Введение
С увеличением продолжительности жизни и улучшением качества медицинской помощи растет бремя сердечно-сосудистых заболеваний (ССЗ), в частности таких, как фибрилляция предсердий (ФП) и ишемическая болезнь сердца (ИБС) [1]. ФП – наиболее часто встречающаяся клинически значимая аритмия как во всем мире [2], так и в популяции пациентов в России [3]. Распространенность всех форм ФП составляет 2–5% среди взрослого населения, однако с возрастом она увеличивается в разы – до 9,6–17,8% у лиц 80 лет и старше [3–5]. ИБС в свою очередь является одним из самых распространенных ССЗ [6], а ее наличие служит значимым фактором риска возникновения и прогрессирования ФП, ассоциировано с утяжелением течения данного заболевания [1, 7]. Это нашло отражение в шкале для прогнозирования тромбоэмболических событий CHA2DS2-VASc, где ИБС выступает дополнительным фактором риска в виде наличия инфаркта миокарда (ИМ) в анамнезе (постинфарктного кардио-склероза – ПИКС) [8]. Пациенты с любым типом ФП (ранее существовавшая, впервые выявленная) и перенесенным ИМ подвержены более высокому риску развития повторного ИМ, инсульта, сердечной недостаточности и внезапной сердечной смерти [9]. Таким образом, два этих заболевания тесно связаны и взаимно ухудшают течение и прогноз друг друга.
Пожилые люди часто имеют сразу несколько клинически значимых заболеваний, как связанных патогенетически, так и не связанных, что говорит о полиморбидности, которая увеличивает риск присутствия ФП, особенно при наличии четырех/пяти сопутствующих заболеваний [3]. Наличие нескольких сочетанных заболеваний требует применения большего числа лекарственных препаратов для контроля симптомов и улучшения прогноза заболеваний [10]. Увеличение числа назначаемых лекарственных средств (ЛС) составляет суть полипрагмазии, обычно определяемой как одновременное назначение пяти и более ЛС и часто встречающейся среди пожилых пациентов с ФП [11]. Известно, что полипрагмазия связана с повышенным риском развития побочных эффектов, поскольку возрастает частота лекарственных взаимодействий, и как следствие – с ухудшением клинических исходов [12].
Помимо полиморбидности и полипрагмазии при лечении пациентов пожилого возраста современная медицина сталкивается с рядом других проблем. Например, возрастные изменения и особенности пожилого организма (замедленный обмен веществ, недостаточное питание, нарушение проницаемости гематоэнцефалического барьера и др.) влияют на фармакокинетику и фармакодинамику ЛС, что приводит к возрастанию риска развития побочных эффектов [13]. Немаловажным является и тот факт, что данные доказательной медицины об эффективности и безопасности применения многих ЛС и их комбинаций у пожилых пациентов отсутствуют или резко ограниченны, в т.ч. в условиях непрерывного роста фармацевтического рынка и появления новых групп препаратов [14].
Уже не одно десятилетие для оптимизации фармакотерапии и борьбы с потенциально нецелесообразными назначениями пациентам 65 лет и старше применяются различные критерии. Впервые инструмент для оценки качества назначения лекарств пожилым людям в 1991 г. ввела группа ученых во главе с врачом-гериатром M.H. Beers [15]. С тех пор появилось несколько обновленных версий Beers Criteria (критериев Бирса), а также критериев, разработанных в отдельных странах [16]. Так, в Ирландии в 2008 г. опубликованы STOPP (Screening Tool of Older Person’s potentially inappropriate Prescriptions) и START (Screening Tool of Alert doctors to the Right Treatment) критерии, разработанные не только с целью выявления нецелесообразных назначений, но и для определения потенциально необходимых и, возможно, упущенных при назначении ЛС [17]. Основным плюсом этих критериев явилось удобство в использовании из-за деления по физиологическим системам органов, что привело к широкому применению этого инструмента как в европейских странах, так и за их пределами [16]. В настоящее время STOPP/START-критерии рекомендованы к использованию Британским национальным формуляром, а также реализованы в Голландском междисциплинарном руководстве по полипрагмазии у пожилых людей и в некоторых методических пособиях в России [16, 18, 19]. Второе издание от 2015 г. включает 80 STOPP-критериев и 34 START-критерия [20].
Исходя из представленных выше сведений, целью настоящего исследования стал анализ структуры сопутствующих заболеваний и соответствия назначенной фармакотерапии критериям STOPP/START у госпитализированных пациентов 65 лет и старше с сочетанием ФП и ИБС в зависимости от наличия ПИКС.
Методы
Протокол настоящего исследования был одобрен Этическим комитетом ФГБОУ ДПО РМАНПО Минздрава РФ (протокол № 10 заседания от 18.09. 2023).
Было проведено ретроспективное когортное исследование, в ходе которого осуществлен ретроспективный анализ историй болезни пациентов кардиологического отделения многопрофильного стационара Москвы. Были отобраны истории болезни 342 пациентов в возрасте 65 лет и старше с сочетанием ФП и ИБС, проходивших стационарное лечение в кардиологическом отделении в период с 1 июля 2018 г. по 30 июня 2019 г.
Критериями включения являлись:
1) наличие ФП (любой формы: пароксизмальной, персистирующей, постоянной, а также пациенты с клапанной патологией и обратимыми причинами ФП), согласно выставленному заключительному диагнозу; 2) наличие ИБС, согласно выставленному заключительному диагнозу; 3) возраст пациентов на момент поступления в стационар ≥65 лет.
Включенные в исследование пациенты были разделены на 2 группы в зависимости от наличия/отсутствия перенесенного ИМ в анамнезе: группа 1 – 214 пациентов с отсутствием ПИКС в анамнезе и группа 2 – 128 пациентов с ПИКС в анамнезе. Исходная сравнительная характеристика групп пациентов, включенных в анализ, представлена в табл. 1.
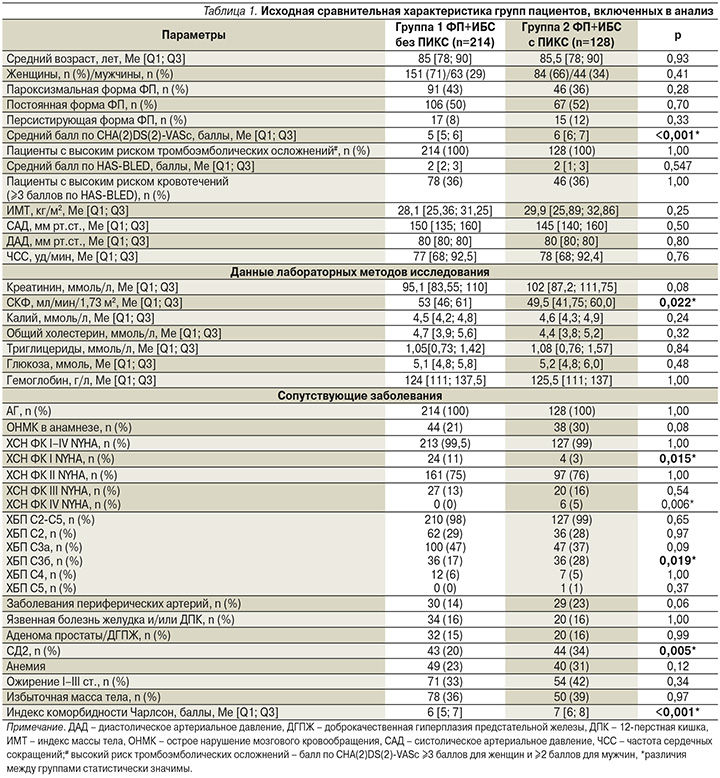
Медиана возраста пациентов группы 1 составила 85 [78; 90], группы 2 – 85,5 [78; 90] лет (р=0,934).
В обеих группах преобладали женщины (71 и 66% женщин в группах 1 и 2 соответственно; р=0,405). Наиболее часто встречающейся формой ФП как в группе 1, так и в группе 2 была постоянная форма (50% пациентов группы 1, 52% пациентов группы 2), затем пароксизмальная (43% пациентов группы 1, 36% пациентов группы 2) и наконец персистирующая (8% пациентов группы 1, 12% пациентов группы 2). Обращает на себя внимание, что в группе пациентов с ПИКС по сравнению с группой без такового средний балл по шкале CHA(2)DS(2)-VASc был статистически значимо больше, чем у пациентов без ПИКС: 6 [6; 7] и 5 [5; 6] баллов соответственно (р<0,001).
Среди показателей лабораторных данных только расчетный уровень скорости клубочковой фильтрации (СКФ) статистически значимо различался в группах: 53,0 [46; 61] мл/мин/1,73 м2 и 49,5 [41,75; 60,0] мл/мин/1,73 м2 для групп 1 и 2 соответственно (р=0,022).
Анализ сопутствовавших заболеваний в группах с ФП и ИБС с наличием/отсутствием ПИКС показал, что 100% пациентов в обеих группах имели сопутствовавшую артериальную гипертензию (АГ), а 99% всех пациентов – хроническую сердечную недостаточность (ХСН), причем в группе 1 с ФП и ИБС без ПИКС статистически значимо чаще встречалась ХСН I функционального класса (ФК) по классификации NYHA (New York Heart Association) – у 11% пациентов в группе 1 и у 3% больных в группе 2 (р=0,015), а в группе 2 с ФП и ИБС с ПИКС, напротив, статистически значимо чаще встречалась ХСН IV ФК по NYHA (5% пациентов в группе 2; в группе 1 пациенты с IV ФК по NYHA отсутствовали; р=0,006). Также в группе 2 статистически значимо чаще встречались сахарный диабет 2 типа (СД2) (20% пациентов в группе 1 и 34% пациентов в группе 2; р=0,005) и хроническая болезнь почек (ХБП) 3б-стадии (17% пациентов в группе 1 и 28% в группе 2; р=0,019). ХБП была третьей по частоте встречаемости сопутствующей патологии, ею страдали 98% пациентов группы 1 и 99% пациентов группы 2.
При оценке индекса коморбидности Чарлсон у пациентов с ФП и ИБС были выявлены статистически значимо большие его значения в группе с ПИКС – 7 [6; 8] баллов, чем в группе без ПИКС – 6 [5; 7] баллов (р<0,001).
Проводили анализ соответствия лекарственных назначений по STOPP/START-критериям (2-я редакция, 2015) [12]. Статистическую обработку результатов выполняли в программном пакете IBM SPSS Statistics 27. Нормальность распределения полученных параметров оценивали посредством критерия Шапиро–Уилка. Описание выборки для ненормально распределенных переменных проводили в виде расчета медианы (Ме) и интерквартильного размаха в виде 25 и 75 процентилей (С25 и С75), для нормально распределенных переменных путем определения среднего значения (М) и стандартного отклонения (SD). Категориальные переменные оценивали с помощью точного критерия Фишера. Оценка различий ненормально распределенных показателей проводили с помощью U-критерия Манна–Уитни, различия между переменными, распределение которых подчинялось нормальному распределению, анализировали с использованием t-критерия Стьюдента. Статистически значимыми считали значения р<0,05.
Результаты
Максимальное число одновременно назначенных препаратов в группе 1 составило 7 [6; 8], в группе 2 – 8 [6; 9] (р=0,002). Подробнее анализ максимального числа назначаемых препаратов представлен на рисунок. Пять и более препаратов одновременно, что соответствует критерию полипрагмазии, получали 199 (93%) пациентов в группе 1 и 124 (97%) в группе 2 (различия между группами статистически не значимы, р=0,203). Более того, существенная часть пациентов получали 10 и более препаратов одновременно: 26 (12%) пациентов в группе 1 и 24 (19%) в группе 2 (р=0,130). В группе 2 максимальное число одновременно назначенных препаратов оказалось статистически значимо выше: 8 [6; 9] против 7 [6; 8], р=0,002.

При детальном рассмотрении назначений обращает на себя внимание тот факт, что антикоагулянтную терапию не получали 44 (20,5%) пациента в группе 1 и 33 (26%) в группе 2 (р=0,325) (табл. 2).

Самым часто назначаемым антикоагулянтом был ривароксабан – 131 (61%) пациент получал его в группе 1 и 73 (57%) в группе 2 (р=0,516).
При анализе лекарственных назначений на соответствие STOPP/START-критериям, было выявлено всего 722 START-критерия (433 для группы 1 и 289 для группы 2) и 250 STOPP-критериев (142 для группы 1 и 108 для группы 2). При этом 197 (92%) пациентов в группе ФП и ИБС без ПИКС и 122 (95%) в группе ФП и ИБС с ПИКС имели хотя бы один START-критерий (р=0,347), а 87 (41%) и 67 (52%) пациентов соответственно группам имели хотя бы один STOPP-критерий (р=0,047).
Наиболее часто встречающимися STOPP-критериями (более 5% от общего числа пациентов в группе) являлись назначения препаратов с антихолинергической активностью при хроническом запоре: 41 (19,2%) и 34 (26,6%) пациентов групп 1 и 2 соответственно (р=0,143), нестероидных противовоспалительных средств (НПВС) при ХСН: 15 (7,0%) и 7 (5,5%) пациентов групп 1 и 2 соответственно (р=0,738) и НПВС в комбинации с антагонистом витамина К, прямым ингибитором тромбина или ингибитором фактора Ха: 11 (5,2%) и 5 (3,9%) пациентов групп 1 и 2 соответственно (р=0,796). При сравнительном анализе частоты встречаемости STOPP-критериев статистически значимых различий между группами не обнаружено.
Напротив, при анализе START-критериев нами обнаружено 2 критерия со статистически значимыми различиями в частоте встречаемости между группами. Это второй по частоте встречаемости критерий «Клопидогрел у пациентов с ишемическим инсультом или заболеванием периферических сосудов в анамнезе» (24,8 и 36,7% пациентов групп 1 и 2 соответственно; р=0,026); а также критерий «Регулярный прием ингаляционных кортикостероидов при среднетяжелой бронхиальной астме (БА) или хронической обструктивной болезни легких (ХОБЛ), когда объем форсированного выдоха за 1-ю секунду (ОФВ1) отклоняется от должной величины и с повторяющимися обострениями, требующими лечения пероральными кортикостероидами», обнаруженный у 1,9% пациентов в группе 1 и у 8,6% пациентов в группе 2 (р=0,008) (табл. 3).

Наиболее распространенным в обеих группах являлся START-критерий «Отсутствие назначения статинов пациентам, имеющим в анамнезе коронарные, церебральные или периферические сосудистые заболевания» (79,4 и 82,0% пациентов групп 1 и 2 соответственно; р=0,657). Другие наиболее распространенные START-критерии (более 5% от общего числа пациентов в группе) приведены в табл. 3.
Обсуждение
В этом исследовании изначальная выборка пациентов с наличием сразу двух патологий – ФП и ИБС – предполагает коморбидность у каждого участника. Однако стоит обратить внимание на то, что в действительности при анализе сопутствующей патологии как минимум у 98% пациентов в обеих группах имеется сочетание сразу пяти заболеваний (ФП, ИБС, АГ, ХБП, ХСН). По разным данным, распространенность полиморбидности при ФП колеблется от 69,5 до 98% в зависимости от условий исследования и популяции [21–23]. Шведское исследование с участием 272 186 пациентов с ФП (средний возраст – 72,3±10,9 года) выявило, что у 69,5% лиц присутствовало по крайней мере еще одно какое-либо сопутствовавшее заболевание [21]. Исследование, проведенное в Бельгии, показало, что 92% пациентов с ФП (n = 1830, средний возраст – 77,5 ± 7,3 года) имели 3 или более сопутствовавших заболевания [22]. Схожие результаты демонстрируют ученые из США, где анализ данных NHWS (National Health and Wellness Survey) показал, что 98% участников с ФП (n=1297, средний возраст – 64,9±12,2 года) имели по крайней мере одно дополнительное сопутствовавшее заболевание [23]. В исследовании 500 пациентов с ФП (средний возраст – 75,2±6,7 года) в Китае распространенность полиморбидности также оставалась на уровне 98% [24]. Как правило, число сопутствующих заболеваний у пожилых людей увеличивается с возрастом [25]. В нашем исследовании медиана возраста для группы 1 составила 85 [78; 90], а для группы 2 – 85,5 [78; 90] лет, что выше, чем в перечисленных ранее исследованиях, и позволяет объяснить значимое бремя сопутствующих заболеваний у этих пациентов.
Нельзя не отметить, что пациенты группы с наличием ПИКС имели достоверно бóльшую распространенность некоторых заболеваний, таких как ХСН IV ФК по NYHA, СД2, ХБП 3б-стадии. Такая тяжесть течения ХСН может быть объяснена снижением сократительной способности миокарда за счет некротизированных участков после перенесенного ИМ [26]. С другой стороны, известно, что снижение фракции выброса левого желудочка ассоциировано с последующим развитием ИМ [27]. СД повышает не только риск развития ИБС примерно в 2 раза, но и частоту развития ИМ, причем больше фатального, что говорит о тяжелых формах коронарной патологии у пациентов с СД [28]. S.M. Haffner et al. [29] обнаружили, что за 7-летний период наблюдения у пациентов с СД без ПИКС уровень смертности составил 15,4%, тогда как среди пациентов с СД и ПИКС в анамнезе – 42,0%. ХБП также имеет двунаправленную связь с ИМ, с одной стороны, выступая значимым фактором риска его развития, с другой – увеличивая риск последующих сердечно-сосудистых событий у пациентов с ПИКС, причем чем более выражено снижение почечной функции, тем хуже прогноз у пациентов [30]. В нашем исследовании не только стадия ХБП, но и расчетный уровень СКФ статистически значимо различались в группах: 53,0 [46; 61] и 49,5 [41,75; 60,0] мл/мин/1,73 м2 для групп 1 и 2 соответственно (р=0,022).
Бремя полиморбидности и худший прогноз у пациентов группы 2 подтверждаются более высоким значением индекса коморбидности Чарлсон: 6 [5; 7] баллов в группе 1 и 7 [6; 8] в группе 2 (р<0,001), а также баллов по шкале CHA(2)DS(2)-VASc: 5 [5; 6]баллов в группе 1 и 6 [6; 7] в группе 2 (р<0,001). В каждой из этих шкал наличие перенесенного ИМ прибавляет пациенту 1 балл, что означает уменьшение предполагаемой продолжительности жизни и повышение риска тромбоэмболических событий [31, 32]. Так, при значении индекса коморбидности Чарлсон 7 10-летняя выживаемость составляет 0%, при значении 6 – 2%, что подчеркивает небольшую, но значимую для конкретного пациента разницу [32]. В целом данный индекс среди наших групп пациентов значительно выше по сравнению с другими цитируемыми выше исследованиями [22, 23]. Так, при анализе данных NHWS (США) всего 20,5% пациентов с ФП имели баллы 3 и выше по шкале Чарлсон [23], в бельгийском исследовании определялся модифицированный индекс коморбидности Чарлсон и его среднее значение составляло 5 ± 2 [22]. По-видимому, ключевым фактором здесь выступает возраст исследуемых, во-первых, как самостоятельный предиктор, во-вторых, с точки зрения развития возраст-ассоциированных заболеваний.
В исследовании 29 341 пациента с ФП (средний возраст – 71 год) изучали шкалу риска развития тромбоэмболических событий CHA(2)DS(2)-VASc (ХСН, АГ, возраст 75 лет и старше, СД, инсульт или другие эмболические осложнения, сосудистое заболевание, возраст от 65 до 74 лет, женский пол) как предиктор развития повторного ИМ [27, 31]. Средний балл CHA2DS2-VASc оказался выше у группы пациентов с ФП, перенесших ИМ, чем у группы пациентов без ПИКС (3,56±1,92 против 3,32±1,81; p<0,001), что соответствует данным, полученным в настоящем исследовании. Анализ Каплана–Мейера показал, что высокие показатели CHA2DS2-VASc ассоциированы с более высокой частотой развития ИМ (p<0,001). Более того, показатель CHA2DS2-VASc был значимым предиктором ИМ, согласно результатам множественного регрессионного анализа [27]. Схожие результаты наблюдались и в исследовании 21 129 пациентов с неклапанной ФП, где более высокий показатель CHA(2)DS(2)-VASc был ассоциирован со статистически значимо большим риском развития ИМ (7,8; 14,9; 23,9 и 35,3 случая на 1000 человеко-лет для пациентов с показателем CHA(2)DS(2)-VASc от 1 до 2, от 3 до 4, от 5 до 6 и от 7 до 9 соответственно; р<0,001) [33]. Это позволяет подчеркнуть значимость взаимного влияния ФП и ИБС, особенно при перенесенном ИМ.
Бремя перечисленных выше заболеваний, одновременно сосуществующих у одного пациента пожилого возраста (т.е. у 98% пациентов в нашей выборке), создает определенные трудности в подборе лекарственной терапии, когда зачастую каждый узкий специалист назначает препараты согласно клиническим рекомендациям нозологии, но не опирается на совместное принятие решений или не способствует созданию мультидисциплинарной команды [34]. Важные факторы, такие как когнитивный статус или астенизация, недостаточно учитываются при оценке потенциальной пользы или потенциального вреда от лекарственного средства [35]. В таком случае назначение препаратов в стационаре, на наш взгляд, ведет к более комплексному подходу к лечению пациента. Однако, несмотря на это, подавляющее большинство пациентов в нашем исследовании получали 5 и более препаратов одновременно, что соответствует критерию полипрагмазии (93% пациентов в группе 1 и 97% в группе 2; р=0,203). Более того, существенная часть пациентов получали 10 и более препаратов одновременно (12% пациентов в группе 1 и 19% в группе 2; р=0,130). Ожидаемо, в группе у 2 пациентов с ПИКС показатель максимального числа одновременно назначенных препаратов оказался статистически значимо выше: 8 (6–9) против 7 (6–8), р=0,002.
Распространенность полипрагмазии среди пациентов с ФП в других исследованиях составила 40–77% при различных схемах назначения препаратов и критериях включения и исключения [24, 36–38]. Некоторые исследования показали, что полипрагмазия является фактором риска, ассоциированным с кровотечениями и тромбоэмболическими осложнениями у пациентов с ФП [36, 37].
В исследуемой нами популяции также широко распространено ненадлежащее назначение ЛС, т.е. несоответствие терапии STOPP/START-критериям. По полученным данным, почти в 2 раза чаще встречается неназначение препаратов, показанных пациенту (START-критерии), чем назначение потенциально опасных для данного пациента ЛС (STOPP-критерии). Это является скорее положительным моментом, однако не позволяет полностью бороться с полипрагмазией.
Наличие по крайней мере одного START-критерия встречается у 22,7–74,0% пациентов в других исследованиях [39, 40], тогда как в нашем чаще – у 197 (92%) пациентов в группе 1 и у 122 (95%) в группе 2. Так, около 80% пациентов в обеих группах не получали статинов при наличии в анамнезе коронарных, церебральных или периферических сосудистых заболеваний. Этот критерий является часто встречающимся и в других исследованиях [39–41], хотя в настоящее время уже не остается сомнений в пользе статинотерапии при многих сердечно-сосудистых, метаболических патологиях, что находит отражение в клинических рекомендациях, в частности, по стабильной ИБС (2020), также в руководстве по ведению пациентов с периферическим атеросклерозом [42, 43].
Клопидогрел при наличии ишемического инсульта или заболевания периферических сосудов в анамнезе статистически значимо чаще не назначался пациентом группы 2: 53 (24,8%) и 47 (36,7%) пациентов групп 1 и 2 соответственно (р=0,026). Эту разницу можно объяснить большей распространенностью запущенного процесса атеросклероза у таких пациентов, критическим проявлением которого явился ИМ. Следует сказать, что действующие клинические рекомендации налагают ограничение на применение этого критерия в Российской Федерации, т.к. пожилым пациентам с наличием ФП в данной клинической ситуации рекомендуется применение только антикоагулянтной терапии [8].
Стоит рассмотреть подробнее еще один критерий со статистически значимым различием между группами: «Регулярный прием ингаляционных кортикостероидов при среднетяжелой БА или ХОБЛ, когда ОФВ1 отклоняется от должной величины и с повторяющимися обострениями, требующими лечения пероральными кортикостероидами»: 4 (1,9%) и 11 (8,6%) пациентов в группах 1 и 2 соответственно (р=0,008). Ухудшение ОФВ1 связано не только с субклиническим атеросклерозом и возникновением ИБС, но и с большей частотой развития ФП независимо от СН или других ССЗ [44]. В исследовании NHANES (National Health and Nutrition Examination Survey) в возрасте 40–60 лет худший квинтиль ОФВ1 (средний процент прогнозируемого ОФВ1 – 63%) был ассоциирован с более чем 2-кратным увеличением случаев госпитализаций или смерти от ССЗ (отношение рисков [ОР]=2,44, 95% доверительный интервал [ДИ]: 1,37–4,33) по сравнению с лучшим квинтилем ОФВ1 (средний процент прогнозируемого ОФВ1 – 109%) [45]. В последнее время все чаще обсуждается связь хронической патологии легких (ХОБЛ и БА) с ССЗ не только через общие факторы риска (курение, АГ, ожирение), но и как единый механизм патогенеза, реализующийся через хроническое системное воспаление [44]. Итак, контроль ХОБЛ и БА и назначение максимально эффективной, научно обоснованной терапии крайне необходимы пациентам с сопутствующей сердечно-сосудистой патологией, что в случае нашего исследования выполнено ненадлежащим образом.
При анализе STOPP-критериев около 50% пациентов как группы 1, так и группы 2 имели хотя бы один критерий, однако статистически значимой разницы между группами обнаружено не было. Данные других исследований говорят о распространенности STOPP-критериев от 21,4 до 79,0% [39, 40], что соотносимо с нашими результатами. Препараты для лечения психических патологий, бензодиазепины и нейролептики, часто становятся проблемой из-за ненадлежащего назначения в других странах [24, 41]. В нашем исследовании чаще встречалось применение препаратов с антихолинергической активностью при наличии запора и НПВС при ХСН (ухудшение течения) или в комбинации с антикоагулянтами, что повышает риск желудочно-кишечных кровотечений.
Применение ЛС с антихолинергической активностью часто встречается среди пожилых пациентов, хотя именно эта группа наиболее подвержена побочным эффектам, таким как снижение когнитивных функций, падения, кишечная непроходимость, задержка мочи, усугубление течения ИБС, ФП, ХСН, глаукомы и др. [12]. Осведомленность практикующих врачей и рутинное использование в клинической практике шкалы антихолинергической нагрузки помогут решить данную проблему в пользу улучшения качества жизни наблюдаемых пациентов.
Препараты группы НПВС зачастую принимаются пациентами без назначения врача, это также большая проблема, на одной чаше весов которой хронический болевой синдром, встречающийся у 27–86% пациентов старше 65 лет и существенно снижающий качество жизни [46], на другой – ухудшение течения сопутствующей патологии, что может приводить к частым госпитализациям или неблагоприятным клиническим исходам [47]. К сожалению, решение этой проблемы не лежит на поверхности. Согласно действующим клиническим рекомендациям по лечению хронического болевого синдрома у пожилых пациентов, стоит делать упор на немедикаментозных методах лечения, налаживании коммуникации с пациентом, разделении ответственности по управлении болью.
А медикаментозная терапия необходима при отсутствии желаемого эффекта от немедикаментозных методов, при этом врач должен учитывать полипрагмазию и STOPP/START-критерии при назначении анальгетиков [46].
Заключение
Среди включенных в настоящее исследование госпитализированных пациентов пожилого и старческого возраста с сочетанием ФП и ИБС широко распространена полиморбидность с наличием одновременно как минимум 5 заболеваний. ХСН IV ФК по NYHA, СД, ХБП 3б-стадии статистически значимо чаще встречались среди группы пациентов с ФП, ИБС и ПИКС, чем без наличия последнего. Тяжесть состояния пациентов этой группы подчеркивает более высокий балл индекса коморбидности Чарлсон, балл по шкале прогнозирования риска тромбоэмболических событий CHA(2)DS(2)-VASc и число максимально назначенных одновременно препаратов. Полипрагмазия и ненадлежащее использование лекарственных назначений (STOPP/START-критерии) зарегистрированы у подавляющего числа пациентов в обеих группах.
Полученные данные диктуют необходимость более тщательного ведения, контроля заболеваний, выбора ЛС у пациентов старше 65 лет с наличием ФП и ИБС, в особенности у лиц с перенесенным ИМ ввиду высоких рисков неблагоприятных исходов. Для контроля лекарственных назначений пожилым пациентам стоит использовать STOPP/START-критерии – в большей степени не для выявления нежелательных назначений, а для выбора оптимальной стратегии лечения в совокупности факторов конкретного клинического состояния.



