Острые кишечные инфекции (ОКИ) являются одними из наиболее частых инфекционных заболеваний у детей. Ежегодно официально на территории России регистрируется около полумиллиона диарейных заболеваний среди детей, большая часть которых приходится на пациентов раннего возраста (Покровский В.И., 1996, Учайкин В.Ф. и соавт., 2003, Онищенко Г.Г., 2005). Среди причин летальности, связанных с инфекционной патологией, эта группа заболеваний стойко занимает второе-третье места. При этом заболеваемость кишечными инфекциями среди детей в возрасте до 14 лет в несколько раз выше, чем у взрослых, и основная масса летальных исходов также наблюдается именно в этой возрастной группе (The World Health Report 2003: Shaping the Future Geneva WHO 2003, Иванова В.В.,2005).
Длительное время ОКИ называли “болезнью грязных рук”, объясняя их высокий удельный вес и повсеместное распространение низкой санитарно-гигиенической культурой населения. Можно согласиться со справедливостью этого утверждения в отношении экономически слаборазвитых стран. Однако ОКИ сохраняют свою актуальность и в экономически благополучных странах. Несмотря на развитие пищевой промышленности, индустрии общественного питания, ежегодно в различных регионах регистрируются крупные вспышки ОКИ бактериальной этиологии, факторами передачи инфекции в которых выступают пищевые продукты промышленного производства.
В качестве этиологического фактора ОКИ могут выступать как вирусы (рота-, нора-, астра-, сапо-, аденовирусы), так и бактерии (шигеллы, сальмонеллы, эшерихии, условно-патогенные микроорганизмы, иерсинии, кампилобактеры и др.), а также некоторые простейшие. Несмотря на полиэтиологичность данной группы заболеваний, клиническая картина их во многом схожа и складывается из сочетания симптомов дисфункции желудочно-кишечного тракта (ЖКТ) в виде рвоты, диареи, метеоризма, абдоминальных болей, а также интоксикационного синдрома и симптомов обезвоживания. Безусловно это существенно затрудняет установление этиологического диагноза, имеющего определяющее значение в выборе этиотропной терапии. Дополнительные трудности вызывает большая длительность лабораторного цикла – 3–5 дней, главным требованием которого является получение материала от больного до начала этиотропной терапии.
Лечение кишечных инфекций должно быть комплексным и включать как патогенетическую (регидратацию и дезинтоксикацию), так и этиотропную терапию, направленную на элиминацию возбудителя и его токсинов, а также диетотерапию и коррекцию нарушений микрофлоры кишечника.
В качестве неадсорбируемых топически активных антисептиков широко известны нитрофурановые препараты (фуразолидон, фуразидин, нитрофурантоин, нифуроксазид и др.) Нитрофураны проявляют антимикробную активность в отношении как грамположительных, так и грамотрицательных бактерий. Они конкурируют с флавиновыми ферментами, нарушают синтез нуклеиновых кислот, угнетают метаболизм пирувата, активность дегидрогеназ, альдолаз и транскетолаз, что в целом изменяет энергетический обмен микробной клетки, тем самым блокируя ее рост и размножение. В отличие от антибиотиков нитрофураны стимулируют иммунитет за счет повышения фагоцитарной активности лейкоцитов, усиления комплементсвязывающей способности сыворотки крови, повышения содержания антител в крови, увеличения адсорбционно-поглотительной способности ретикулоэндотелиальной системы печени и селезенки.
Фармакоэпидемиологические исследования свидетельствуют, что в России остается широко распространенной практика назначения фуразолидона, к которому наблюдается высокий уровень резистентности основных патогенных микроорганизмов. В последних клинических исследованиях доказано, что санирующая эффективность фуразолидона в отношении шигелл составляет всего 57,2 %, сальмонелл – 33,3 %; клебсиеллы пневмонии и энтеробактер практически не чувствительны к препарату. Кроме того, известно, что практически во всех экономически развитых странах применение фуразолидона строго ограничено в связи не только с высоким уровнем устойчивости, но и с низкой безопасностью, особенно для детей и лиц пожилого возраста.
Одним из современных представителей производных нитрофурана, содержащим в качестве активного вещества нифуроксазид, является Энтерофурил (АО “Босналек”, Босния и Герцеговина), который активно используется в последние годы благодаря ряду положительных свойств.
Энтерофурил является местно действующим кишечным антисептиком и из просвета ЖКТ не всасывается. В результате интенсивного изучения Энтерофурила было доказано, что в терапевтических дозах препарат оказывает бактериостатическое, а в высоких дозах – бактерицидное действие. Предположительно ингибирует активность дегидрогеназ и синтез определенных белков в клетках бактерий, в результате нарушаются процессы роста и деления бактериальной клетки. Прямой антимикробный эффект установлен в отношении ряда возбудителей кишечных инфекций и активных условно-патогенных микроорганизмов: Salmonella typhimurium,Yersinia enterocolitica, Shigelladysenteriae, Escherichiacoli, Clostridiumdifficile, Klebsiellapneumoniae, Enterobacterspp., Campylobacterspp., Citrobacterspp., Streptococcuspyogenes, Staphylococcuspyogenes.
Такой широкий спектр антимикробного влияния обосновывает применение Энтерофурила как антидиарейного и антисептического средства при ОКИ (в качестве разумной альтернативы антибиотикам), а также дисбактериозе кишечника. Положительными качествами препарата считается его хорошая переносимость при минимуме побочных эффектов, что представляет значительный практический интерес, ибо безопасность Энтерофурила позволяет использовать его детям раннего возраста, а также беременным и кормящим женщинам. С учетом существующих рекомендаций, созданных ведущими специалистами в области клинической фармакологии, важно напомнить, что недоношенным и детям до месяца жизни все препараты нитрофуранового ряда, в т. ч. Энтерофурил, противопоказаны, поскольку вследствие незрелости глюкозо-6-фосфатдегидрогеназы они могут вызвать гемолиз.
Энтерофурил является одним из наиболее доступных антимикробных препаратов, выпускаемых в детской форме (суспензии), которая обеспечивает легкость предписанного режима его дозирования в зависимости от возраста ребенка. Среднесуточные дозы препарата в суспензии составляют для детей от 2 до 6 месяцев 7,5 мл при трехкратном приеме, до 2 лет – 10,0 мл при четырехкратном приеме, старше 2 лет – 15,0 мл при трехкратном приеме. Детям с 6 лет и взрослым назначают по 2 капсулы 3–4 раза в сутки.
Цель исследования: оценить эффективность применения препарата Энтерофурил в комплексном лечении детей раннего возраста, больных ОКИ “инвазивного” типа.
Материал и методы
В специализированной клинической детской инфекционной больнице Краснодара проведена работа по изучению эффективности применения препарата Энтерофурил в комплексном лечении больных бактериальным гастроэнтероколитом.
На стационарном лечении с мая 2011 по декабрь 2011 г. находились 62 ребенка (34 мальчика и 28 девочек), больных ОКИ “инвазивного” типа. С помощью комплекса бактериологических и серологических методов шигеллез был верифицирован у 24 (38,7 %), а сальмонеллез у 14 (22,6 %) пациентов. ОКИ стафилококковой этиологии были подтверждены у 8 (12,9 %), эшерихиоз выявлен у 10 (16,2 %), клебсиеллез – у 5 (8,0 %), кампилобактериоз – у 1 (1,6 %) из обследованных пациентов. Из них у 5 (8,0 %) детей отмечено тяжелое течение болезни, у 57 (91,9 %) – среднетяжелое. Возрастная структура обследованных была следующей: до года – 17 (27,4 %) детей, из них до 6 месяцев – 5 (8,1 %) и старше 6 месяцев – 12 (19,3 %); от года до 2 лет – 20 (32,3 %) детей; от 2 до 3 лет – 18 (29,0 %); старше 3 лет – 7 (11,3 %) детей. Бoльшая часть обследованных, а именно 55 (88,7 %) пациентов, были в возрасте первых трех лет жизни. Среди больных грудного возраста было больше детей второго полугодия жизни.
Результаты и обсуждение
Наблюдаемых больных распределили в две группы. В первую (контрольную) группу вошли 30 детей, которые при поступлении в стационар получали базисную терапию, включавшую диетическое низколактозное питание, сорбенты (Неосмектин, Смекта, Энтеросгель), ферменты (препараты панкреатина), эубиотики (Бифиформ, Йогулакт, Линекс), препараты для пероральной регидратации (Регидрон, ОRS-200). Во вторую (основную) группу вошли 32 ребенка, которые кроме базисной терапии получали Энтерофурил. Препарат применяли с первого дня госпитализации в соответствии с возрастом: с 2 до 6 месяцев по 2,5 мл 3 раза в сутки, от 6 месяцев до 2 лет – 2,5 мл 4 раза в сутки, старше 2 лет – по 5 мл 3 раза в сутки, старше 6 лет – по 2 капсулы 3 раза в сутки. Продолжительность применения препарата колебалась от 3 до 5 суток. Препарат отменили через 2 суток после нормализации стула.
Исследуемые группы сравнения были сопоставимыми по возрасту и тяжести состояния.
Эффективность назначенных схем лечения оценивали по регрессу основных клинических симптомов ОКИ (лихорадки, рвоты, признаков токсикоза и эксикоза), нормализации аппетита, динамике нормализации стула, а также по данным копроцитограммы и продолжительности применения интенсивной терапии (см. таблицу).
Сравнительный анализ клинической эффективности предложенных схем лечения показал, что у детей основной группы быстрее, чем у детей контрольной группы, исчезали симптомы интоксикации, признаки диспепсического и диарейного синдромов. Так, среди детей основной группы повышение температуры тела имело место на протяжении 2,60 ± 0,87 суток, тогда как у детей контрольной группы температурная реакция сохранялась в течение 4,20 ± 1,11 суток. У больных, получавших Энтерофурил, рвота исчезла на сутки раньше, чем у детей контрольной группы (1,90 ± 0,67 против 2,90 ± 0,77). Кроме того, кратность рвоты значительно уменьшилась уже в первые сутки приема препарата у 78,1 % больных, в то время как в контрольной группе такие изменения наблюдались только среди 36,7 % пациентов. У большинства (75 %) детей основной группы уже на третьи сутки лечения наблюдались нормализация аппетита и восстановление адекватной оральной регидратации, в то время как у детей контрольной группы только у 13 (43,3 %) больных наблюдалась подобная динамика. Средняя продолжительность эксикоза для больных основной группы составила 2,10 ± 0,46 против 3,60 ± 0,69 суток у пациентов контрольной группы, что на 1,5 суток меньше. Признаки интоксикации у больных основной группы исчезли на двое суток быстрее по сравнению с пациентами контрольной группы (2,40 ± 0,54 против 4,10 ± 0,63 суток; р < 0,05). Обращает на себя внимание то, что средняя продолжительность диарейного синдрома на фоне приема Энтерофурила с высокой достоверностью (р < 0,01) сократилась почти в 2 раза у пациентов основной группы по сравнению с больными контрольной группы. Она составила 3,10 ± 0,68 суток для больных основной группы против 6,2 ± 0,84 суток в контрольной.
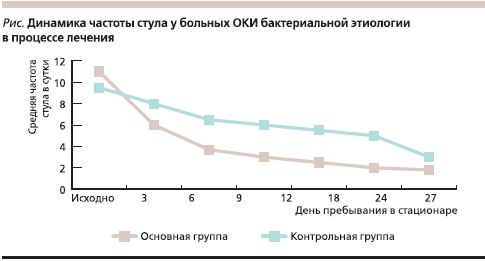
Для больных основной группы на протяжении первых трех суток лечения Энтерофурилом частота стула значительно уменьшилась и составила 4 раза в сутки по сравнению с контрольной группой, в которой количество испражнений уменьшалось постепенно и составляло 7–8 раз в сутки. На шестые сутки пребывания в стационаре у детей основной группы частота стула нормализовалась и составила 2 раза в сутки, тогда как у больных контрольной группы нарушения частоты испражнений наблюдались еще и на седьмые сутки лечения (см. рисунок).
Параллельно с улучшением клинических проявлений наблюдалась динамика лабораторных показателей. Так, при оценке копроцитограммы в первые сутки госпитализации у больных с ОКИ “инвазивного” типа отсутствовали признаки воспалительного процесса, но имели место признаки ферментативной недостаточности, такие как повышенное содержание крахмала, непереваренной клетчатки и нейтрального жира. Для 22 (68,8 %) пациентов, получавших Энтерофурил, нормализация показателей копроцитограммы была отмечена к четвертым суткам лечения, в то время как показатели ферментативной недостаточности в контрольной группе нормализовались лишь у 12 (40 %) детей.
Сравнительный анализ эффективности предложенных схем лечения показал, что лишь к 11 (34,3 %) больным основной группы применяли инфузионную терапию, продолжительность которой составила 1,45 ± 0,51 суток, в то время как в контрольной группе инфузионную терапию получали 50 % детей, при этом продолжительность ее составила 3,2 ± 0,71 суток (р < 0,05). Использование препарата Энтерофурил в комплексном лечении детей раннего возраста с ОКИ “инвазивного” типа позволило уменьшить срок их пребывания в стационаре с 7,4 ± 2,4 суток в контрольной группе до 5,2 ± 1,6 в основной (см. таблицу). Препарат хорошо переносятся больными, удобен в дозировании; побочных эффектов при его использовании наблюдаемыми нами больными не выявлено.
Выводы
1. Установлено, что включение препарата Энтерофурил в базисную терапию больных ОКИ “инвазивного” типа приводит к более быстрому улучшению их общего состояния, нормализации аппетита, сокращению продолжительности лихорадки, рвоты, интоксикации и диарейного синдрома, а также к 2-кратному уменьшению продолжительности инфузионной терапии по сравнению с контролем. Это позволило сократить сроки пребывания в стационаре на 2,3 суток по сравнению с группой детей, получавших базисную терапию.
2. Препарат хорошо переносился больными, удобен в дозировании и применении, отказов от приема или различных нежелательных эффектов при использовании не наблюдалось.
3. Результаты исследования применения препарата Энтерофурил в составе базисной терапии детей с ОКИ “инвазивного” типа свидетельствуют о его клинической эффективности, что позволяет рекомендовать его к применению при данной патологии.



