В последние годы произошли значительные изменения в подходах к системному противоопухолевому лечению распространенных злокачественных новообразований: у практикующих онкологов и химиотерапевтов появился целый арсенал т. н. таргетных препаратов – агентов направленного воздействия на опухоль, позволяющих добиваться устойчивой стабилизации течения заболевания и длительно лечить пациентов, для которых число терапевтических опций ранее было ограниченным. Применявшиеся ранее цитокины, попытки терапии с использованием химиопрепаратов или тамоксифена позволяли достигать кратковременного эффекта менее чем у 5–10 % пациентов с метастатическим раком почки, но с появлением таргетных препаратов, таких как сунитиниб, сорафениб, бевацизумаб, рак почки перестал восприниматься врачами как неизлечимое заболевание, а у пациентов появились шансы получать эффективное лечение. Таргетная терапия при почечно-клеточном раке направлена на основной патогенетический механизм прогрессирования – новообразование сосудов, или ангиогенез, а мишенью воздействия являются рецепторы сосудисто-эндотелиального фактора роста (VEGFR – Vascular endothelial growth factor receptor) или циркулирующие в крови лиганды этих рецепторов.
Многолетние исследования позволили ученым изучить, какие пути передачи сигналов имеют значение при различных видах рака, а также привели к разработке новых лекарственных препаратов. В историческом аспекте представляет интерес вещество, обнаруженное в микроорганизмах, обитающих в почве острова Пасхи, – рапамицин. Само вещество впервые было выделено в 1965 г., а десятилетиями позже в клетках большинства живущих на Земле организмов была выявлена и описана система внутриклеточной передачи сигналов, получившая название по действующему на нее агенту: мишень рапамицина, TOR (target of rapamycin). Рапамицин обладает антипролиферативным действием и используется в трансплантологии как иммунодепрессант для подавления реакции отторжения пересаженных органов (сердца и почки).
В конце 1990-х гг. обнаружена серин-треониновая протеинкиназа молекулярной массой 250 кДа, которая является мишенью действия рапамицина у млекопитающих (mammalian target of rapamycin – mTOR). В последующем было выявлено, что протеинкиназа представляет собой регуляторный белок, участвующий в регуляции клеточного цикла, пролиферации и ангиогенеза [1]. В результате фосфорилирования эффекторных белка 4ЕВР1 и киназы p70S6 (киназы рибосомального белка S6 – S6К) mTOR участвует в инициации трансляции мРНК на рибосомах. Таким образом, mTOR задействована в синтезе белков, необходимых для пролиферации клеток, регуляции клеточного цикла и клеточного метаболизма [2].
mTOR является основным регулятором роста злокачественных клеток, обеспечивая их питательными веществами, в частности аденозинтрифосфатом (АТФ), глюкозой, аминокислотами, холестерином и железом. Она взаимодействует с путями сигнальной передачи факторов роста через PI3K/AKT/TSC-путь (PI3K – фосфатидилинозитол-3-киназа, TSC – комплекс туберозного склероза) и участвует в ангиогенезе опосредованно через PI3K-киназу. Кроме того, mTOR регулирует трансляцию двух белков: 4ЕВР1 (eucariotic translation initiation factor 4E-binding protein) и рибосомальной киназы S6K.
Активация киназы mTOR усиливает действие следующих нисходящих эффекторов, стимулирующих клеточный рост и ангиогенез, а также регулирующих клеточный метаболизм:
• mTOR усиливает трансляцию белков, ответственных за рост и деление клеток, таких как циклин D1, который входит в состав комплекса циклин-зависимых киназ, запускает и стимулирует процесс клеточного роста через контрольные точки G1 и S фаз клеточного цикла – влияние на рост и пролиферацию;
• mTOR усиливает трансляцию индуцируемых гипоксией факторов HIF-1/HIF-2, эти транскрипционные факторы управляют экспрессией генов, отвечающих за реакцию на гипоксический стресс, в т. ч. таких факторов роста сосудов, как сосудисто-эндотелиальный фактор VEGF, тромбоцитарный фактор роста PDGF (platelet-derived growth factor) и трансформирующий фактор роста TGF-α (transforming growth factor α), – влияние на ангиогенез;
• mTOR усиливает экспрессию транспортеров питательных средств на поверхности клеток, повышенный доступ к питательным веществам; поддерживает рост и выживание злокачественных клеток – влияние на клеточный метаболизм [3, 4].
В настоящее время не вызывает сомнений, что нарушение работы путей сигнальной передачи играет важную роль в патогенезе многих злокачественных опухолей, в т. ч. рака почки. С учетом широкого спектра регуляции жизненно важных процессов, необходимых для пролиферации клеток и метастазирования, ингибиторы mTOR проходят клинические исследования эффективности и безопасности при многих опухолях (рис. 1).
Наибольший интерес для онкологов представляют данные об использовании эверолимуса (АфинитораR) при почечно-клеточном раке (ПКР). Заболеваемость ПКР постоянно увеличивается. Так, в США заболеваемость ПКР увеличивается на 2 %, в России в 2008 г. выявлены 17 563 больных раком почки, при этом от метастатического рака почки умерли 8370 человек. По темпам прироста онкологической заболеваемости в Российской Федерации ПКР занимает второе место, уступая лишь раку предстательной железы [6].
При первичной диагностике у 70 % больных раком почки обнаруживают локализованную форму опухоли. После радикальной нефрэктомии у 30–50 % пациентов диагностируют метастазы в отдаленные органы и ткани в различные сроки наблюдения [7, 8]. Медиана общей выживаемости больных метастатическим ПКР составляет 10–12 месяцев [9]. В гистологической классификации ПКР выделяют три подтипа, среди которых светлоклеточный рак встречается у 80–90 % больных, значительно реже выявляют папиллярный (10–15 %) и хромофобный (4–5 %) подтипы ПКР.
До внедрения в практику таргетных препаратов ПКР рассматривали как заболевание, резистентное к лекарственному и лучевому видам лечения. Применение цитокинов (интерферона и интерлейкина-2) позволяет добиваться ответа на лечение у 10–15 % пациентов, в основном при метастазах в легкие, размеры которых не превышают 2 см [10]. За последние десять лет были достигнуты значительные успехи в расшифровке молекулярно-генетических механизмов патогенеза ПКР, что позволило не только добиться непосредственного лечебного эффекта, но и увеличить продолжительность жизни у большинства больных. Эти достижения стали возможными с внедрением в химиотерапевтическую практику таргетных препаратов, относящихся к классу ингибиторов ангиогенеза: сунитиниба (Сутента), сорафениба (Нексавара), темсиролимуса (Торисела), эверолимуса (Афинитора), бевацизумаба (Авастина) и др. [11, 12].
В настоящее время не вызывает сомнений тот факт, что нарушение функции каскада сигнальных путей играет очень важную роль в патогенезе злокачественных опухолей, в т. ч. ПКР. В патогенезе рака почки ведущую роль играет путь сигнальной передачи с участием фактора, индуцируемого гипоксией (HIF – Hypoxiainducible factor) и VEGF. Патогенез светлоклеточного ПКР в 75 % случаев связан с утратой функции гена-супрессора VHL (von Hippel Lindau). Потеря функции этого гена ведет к накоплению белка HIF-1α, который контролирует экспрессию генов – регуляторов ангиогенеза и регулирует выработку VEGF. Киназа mTOR контролирует экспрессию HIF-1α: подавление активности сигнального пути mTOR препятствует накоплению HIF-1α в клетках с потерей функции гена VHL. Кроме того, наблюдается избыточная экспрессия инсулиноподобного фактора роста (IGF-1 – Insulin-like growth factor). Было отмечено, что выживаемость больных IGF-1-R-позитивным светлоклеточным ПКР значительно ниже, чем у пациентов, опухоли которых не содержат рецепторы к IGF-1. При ПКР наблюдается также гиперэкспрессия TGF-α и -β, которые участвуют в стимуляции роста патологических сосудов в опухоли. Схематичное изображение каскада сигналов HIF представлено на рис. 2.
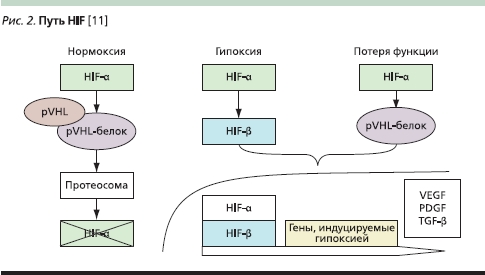
Оказалось, что при ПКР имеет место угнетение функции белка PTEN (phosphatase and tensin homolog, фосфатаза и гомолог тензина). Этот белок функционирует в клетке как фермент фосфатаза и подавляет активность киназы mTOR. Исследования экспрессии белка PTEN при ПКР показали, что в гистологических препаратах нормальной почечной ткани экспрессия PTEN высокая, а при ПКР экспрессия снижается до 10 %. Опухолевые клетки с дефицитом PTEN имеют повышенную чувствительность к ингибированию сигнального пути mTOR [13, 14].
Важным для патогенеза ПКР нарушением в системе передачи сигналов является также потеря комплекса TSC1/TSC2, который в норме подобно белку PTEN препятствует избыточной активации mTOR. Роль сигнального пути mTOR в патогенезе ПКР дополнительно подтверждается потерей комплекса TSC1/TSC2 при синдроме туберозного склероза. Наследственные или приобретенные мутации в генах туберозного склероза приводят к повышению риска развития ряда опухолей, в т. ч. ПКР. При ПКР киназа PI3K стимулирует АКТ, активация которой в свою очередь приводит к ингибированию комплекса TSC1/TSC2 и повышению активности mTOR. Таким образом, в норме PTEN и TSC1/TSC2 являются негативными регуляторами активации киназы mTOR, а любые затрагивающие их нарушения, часто встречающиеся при опухолях, приводят к повышенной и нерегулируемой активности фермента mTOR, а также “запуску” патологической клеточной пролиферации и ангиогенеза.
Патогенез светлоклеточного рака почки связан с утратой гена-супрессора VHL, что приводит к накоплению фактора HIF-1 и гиперэкспрессии белков, кодируемых активированными этим фактором генами, например VEGF. Фактор HIF-1 индуцирует увеличение выработки факторов, регулирующих ангиогенез и способность опухоли к росту и метастазированию, таких как VEGF и др. Активация mTOR в свою очередь также приводит к повышенной экспрессии HIF-1 [16]. Представленные выше данные свидетельствуют о том, что сигнальный путь mTOR следует рассматривать как мишень для лечебного воздействия при ПКР. На рис. 3 представлена схема воздействия различных факторов на сигнальный путь mTOR и возможности блокирования этого пути направленным воздействием на него препаратом эверолимус.
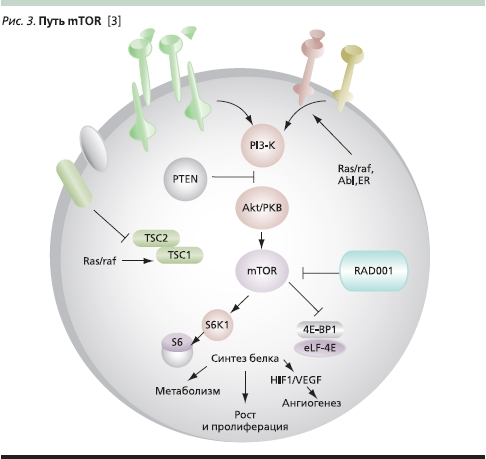
До недавнего времени метастатический ПКР рассматривали как заболевание с плохим прогнозом. Лечение больных этой группы ограничивалось применением цитокинов, а медиана продолжительности жизни не превышала 13 месяцев [17]. В настоящее время для лечения метастатического рака почки у больных, ранее не получавших системного лекарственного лечения, с успехом применяют различные таргетные препараты – ингибиторы ангиогенеза: бевацизумаб, сунитиниб, сорафениб, а также mTOR ингибитор – темсиролимус. До недавнего времени оставался нерешенным вопрос о продолжении лечения пациентов при неэффективности терапии ингибиторами тирозинкиназы рецепторов VEGF.
Эверолимус (АфиниторR) – первый пероральный препарат, относящийся к группе mTOR ингибиторов. Эверолимус представляет собой аналог рапамицина, выделенного из микроорганизмов Streptomyces hygroscopicus и обладающего иммуносупрессивной, противомикробной и противоопухолевой активностью. Эверолимус направленно воздействует на мишень рапамицина млекопитающих – серин-треониновую киназу mTOR. На первом этапе эверолимус был зарегистрирован в трансплантологии для подавления реакции отторжения органов после пересадки почки или сердца. В клинических исследованиях I и II фаз эверолимуса у больных различными злокачественными новообразованиями было показано, что оптимальным режимом лечения является ежедневный прием эверолимуса в дозе 10 мг однократно, прием препарата – непрерывный до прогрессирования или непереносимой токсичности [18, 19].
Результаты клинического исследования II фазы по применению эверолимуса у 37 больных метастатическим ПКР, ранее получавших сунитиниб или сорафениб, были представлены Jac J. И соавт. в 2007 г. [20]. Непосредственный эффект в виде частичного регресса или стабилизации опухолевого процесса продолжительностью более 3 месяцев был отмечен у 70 % больных. Медиана выживаемости составила в исследовании более 11,5 месяцев. В 2008 г. на ежегодной конференции американского общества клинической онкологии ASCO (American Society of Clinical Oncology) исследователи сообщили обновленные результаты, согласно которым частичный эффект зарегистрирован у 3 (16 %) больных, стабилизация продолжительностью 3 и более месяцев – у 14 (74 %). Медиана времени до прогрессирования у больных, получавших эверолимус, составила 5,5 месяцев, а общая выживаемость – 8,0 месяцев. Наиболее частыми нежелательными явлениями I–II степени тяжести были: гипертриглицеридемия (73 %), гипергликемия (59 %), гиперхолестеринемия (64 %), стоматит (45 %), сыпь (32 %), тошнота (27 %), диарея (18 %). Наиболее грозным осложнением был пневмонит III–IV степени тяжести, зарегистрированный у 27 % больных [21].
Исследовательская группа под руководством Motzer R. в 2008 г. сообщила результаты международного многоцентрового рандомизированного исследования III фазы RECORD-1 по изучению эффективности эверолимуса при лечении метастатического ПКР [22]. В исследование были включены 410 пациентов с ПКР после прогрессирования на фоне или в течение 6 месяцев после завершения терапии сунитинибом, сорафенибом или обоими препаратами. Допускалось включение в исследование пациентов, получавших также терапию цитокинами (интерфероном α или интерлейкином-2), бевацизумабом. Больных случайным образом рандомизировали в группы лечения или плацебо в соотношении 2 : 1. В группе лечения (272 пациента) больные получали эверолимус в дозе 10 мг ежедневно внутрь и наилучшее поддерживающее лечение, в группе сравнения (138 пациентов) – плацебо и наилучшее поддерживающее лечение. В обеих группах лечение продолжали до прогрессирования заболевания или развития непереносимых нежелательных явлений. Дизайн исследования предусматривал для пациентов, получавших плацебо, в случае прогрессирования перейти в группу активного лечения эверолимусом. В случае развития у пациентов клинически значимых гематологических или других нежелательных явлений, которые могли быть связанными с приемом эверолимуса, лечение прерывали или снижали дозу эверолимуса до 5 мг в сутки.
После получения результатов второго промежуточного анализа руководящий комитет по независимому мониторингу данных принял решение досрочно прервать исследование, т. к. была достигнута заранее установленная пороговая величина эффективности и получены результаты, соответствующие положительному результату исследования. Медиана продолжительности лечения в группе эверолимуса составила 95 (12–315) дней, в группе плацебо – 57 (21–237) дней. К дате досрочного прекращения клинического исследования лечение продолжали 140 (51 %) пациентов в группе эверолимуса и 30 (22 %) – в группе плацебо.
К моменту досрочного прекращения исследования, согласно независимой централизованной оценке, установлено, что применение эверолимуса снижало риск прогрессирования метастатического ПКР на 70 % (отношение рисков – 0,30, 95 % доверительный интервал – 0,22–0,40; р < 0,0001). Медиана времени до прогрессирования была более продолжительной в группе больных, получавших эверолимус, и составила 4 (3,7–5,5) месяца по сравнению с 1,9 месяца в группе больных, получавших плацебо пациентов (р < 0,0001). Вероятность отсутствия прогрессирования ПКР через 6 месяцев для больных группы эверолимуса составила 26 % (14–37 %), в контрольной группе – лишь 2 % (0–6 %).
Motzer R. и соавт. в 2009 г. на заседании ASCO представили окончательные результаты двойного исследования 410 больных, включенных в клинический протокол. Медиана времени до прогрессирования составила 4,9 месяца в группе эверолимуса по сравнению с 1,9 месяца в контрольной группе (р < 0,0001). Непосредственный объективный эффект (частичный регресс) зарегистрирован у 3 (1 %), стабилизация – у 171 (63 %) пациента. В группе плацебо частичных ответов на лечение не было, а стабилизация имела место у значительно меньшего числа пациентов – 44 (32 %). Итоговый анализ показал, что частичный ответ наблюдался у 5 (2 %) больных, стабилизация – у 185 (67 %) получавших эверолимус, тогда как в контрольной группе стабилизация была зарегистрирована у 45 (32 %) больных [23].
В исследовании не было установлено значимого различия между сравниваемыми группами по показателю общей выживаемости, который составил 14,7 и 14,3 месяца в группах эверолимуса и плацебо соответственно (р = 0,177). Отсутствие различий в общей выживаемости можно объяснить тем, что у больных группы плацебо увеличение выживаемости наблюдалось за счет перехода пациентов в группу активного лечения: при констатации прогрессирования заболевания 79 (81 %) больным группы плацебо был назначен эверолимус.
Побочные эффекты, регистрировавшиеся в ходе исследования, представлены в табл. 1.
1 Сумма явлений III–IV степени в группе лечения эверолимусом статистически значимо отличалась от этого показателя в группе плацебо (двусторонний точный критерий Фишера): стоматит – p = 0,03; инфекции – p = 0,03; гиперхолестеринемия – p = 0,03; гипергликемия – p < 0,0001; лимфопения – p = 0,002; гипофосфатемия – p = 0,01. Поправки для множественного сравнения не применяли.
2 Включает афтозный стоматит, изъязвление слизистой оболочки рта и стоматит.
3 Все инфекции.
4 Интерстициальное поражение легких, инфильтративные изменения в легких, пневмонит, кровоизлияния в альвеолы, легочная токсичность.
В ходе исследования наиболее часто регистрировали побочные эффекты I–II степени выраженности. Чаще всего отмечалось развитие стоматита, сыпи, утомляемости, астении, диареи. Токсические осложнения III–IV степени выраженности регистрировались в целом редко. В ходе исследования частота их развития составила менее 10 %. Однако следует подчеркнуть, что в группе эверолимуса чаще регистрировали выраженные степени стоматита, инфекций, неинфекционного пневмонита. Пневмонит III степени развился у 8 больных, из них 6 человек прекратили лечение эверолимусом. Явления пневмонита были полностью купированы у 4 больных, у 3 отмечено уменьшение степени выраженности до I–II степени. В группе больных, получавших эверолимус, также чаще регистрировали случаи развития лимфопении, гипергликемии, гипофосфатемии и гиперхолестеринемии III–IV степени выраженности. Из-за развития побочных эффектов в группе эверолимуса прекратили лечение 28 (10 %) больных, наиболее частыми причинами прекращения терапии были: пневмонит, одышка, дыхательная недостаточность, утомляемость. В группе плацебо было 5 (4 %) таких больных. Перерывы в лечении в связи с развитием побочных эффектов делали 92 (34 %) больных в группе эверолимуса и 20 (15 %) – в группе плацебо. Снижение дозы препарата потребовалось 14 (5 %) больным в группе эверолимуса и 1 (менее 1 %) – в группе плацебо. Один пациент в группе эверолимуса умер в связи с развитием кандидозного сепсиса, осложненного острой дыхательной недостаточностью.
Результаты исследования позволяют сделать заключение, что развитие резистентности к ингибиторам тирозинкиназы рецепторов VEGF не является противопоказанием к назначению другого таргетного препарата; у таких пациентов можно рассчитывать на успех лечения при применении ингибитора mTOR-пути сигнальной передачи эверолимуса (АфинитораR).
Механизм действия препаратов данной группы принципиально отличается от группы антиангиогенных препаратов прежде всего тем, что mTOR ингибиторы, в частности АфиниторR, оказывают антипролиферативное действие непосредственно на клетки опухоли и угнетают новообразование сосудов. Препарат зарегистрирован для лечения пациентов с распространенным и/или метастатическим ПКР при прогрессировании заболевания после проведения антиангиогенной терапии. В 2009 г. препарат АфиниторR одобрен для широкого клинического применения в США и странах Европы, в 2010 г. – в России. К сегодняшнему дню АфиниторR применяют более чем в 50 странах мира.
В настоящее время изучаются эффективность эверолимуса в 1-й линии терапии у больных, ранее не получавших лечения как в монотерапии, так и в комбинации с другими препаратами; последовательная терапия сунитинибом; альтернирующие режимы лечения; адъювантная терапия. Кроме того, запланированы исследования эверолимуса во 2-й линии терапии больных ПКР, получавших только одну линию терапии ингибиторами тирозинкиназы VEGF.
В 2008 г. Whorf R. и соавт. опубликовали данные исследования II фазы, в котором проводили изучение эффективности и безопасности комбинированной терапии бевацизумабом и эверолимусом у 59 больных метастатическим ПКР, из них 30 пациентов ранее не лечились (1-я группа), 29 больных ранее получали сунитиниб или сорафениб в качестве терапии 1-й линии (2-я группа) [24]. Пациентам назначали бевацизумаб в дозе 10 мг/кг внутривенно 1 раз в 2 недели и эверолимусом в дозе 10 мг ежедневно непрерывно внутрь. Эффективность комбинированной терапии представлена в табл. 2.
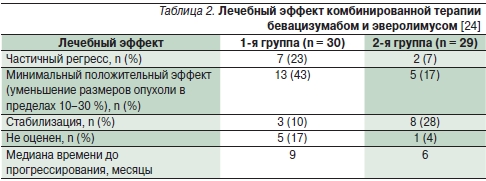
Как видно из таблицы, комбинированная терапия была эффективной у большинства пациентов в обеих группах. Наиболее частыми побочными эффектами III–IV степени выраженности были протеинурия – у 10 (19 %) пациентов, стоматит – у 8 %, утомляемость – у 9 %. В большинстве случаев побочные эффекты были I–II степени выраженности: утомляемость – 68 %, кожная сыпь – 55 %, мукозит – 49 %, гипергликемия – 45 %, повышение артериального давления – 25 %.
Таким образом, комбинация эверолимуса и бевацизумаба оказалась весьма активной как в группе больных, не получавших лечения, так и у ранее леченых ингибиторами тирозинкиназ. Токсичность изученной комбинации приемлема, и такая терапия хорошо переносится.
В настоящее время проводится и запланировано на будущее много клинических исследований, в т. ч. проспективных рандомизированных многоцентровых международных программ, направленных на изучение эффективности и безопасности комбинаций эверолимуса с другими таргетными препаратами, показавшими активность в отношении ПКР. Так, в исследовании RECORD-2 будет изучена эффективность эверолимуса в комбинации с бевацизумабом по сравнению с комбинацией бевацизумаб + интерферон α у 360 больных метастатическим ПКР, ранее не получавших специфического лечения. В исследовании RECORD-3 будет предпринята попытка определить оптимальную последовательность применения mTOR ингибитора эверолимуса и ингибитора тирозинкиназы VEGFR сунитиниба; в одной группе больные будут последовательно получать сунитиниб и эверолимус, в другой – эверолимус и сунитиниб. Особую группу составляют два протокола, в которых эверолимус будут изучать в качестве препарата первой линии терапии у больных папиллярным ПКР (RAPTOR) и у больных несветлоклеточным гистологическим вариантом ПКР (папиллярным, хромофобным, недифференцированным ПКР).
Благодаря появлению в клинической практике препаратов, воздействующих на рецепторы VEGF, в последние годы удалось добиться действительно впечатляющих успехов в лечении ПКР – заболевания, считавшегося резистентным практически ко всем видам лекарственного воздействия. Более того, развитие устойчивости к антиангиогенной терапии является непреложным фактом и до последнего времени у онкологов не было других вариантов лечения пациентов с уже развившейся резистентностью. Клинические исследования убедительно продемонстрировали эффективность АфинитораR во второй линии лечения пациентов после проведенной ранее антиангиогенной терапии. Лечение АфиниторомR было не только эффективным, но и безопасным, хорошо переносилось подавляющим большинством пациентов. Внедрение в клиническую практику ингибитора mTOR эверолимуса позволит практикующим онкологам оптимизировать подходы к системной терапии распространенного и/или метастатического ПКР и улучшить результаты лечения пациентов.



