Введение
Гепатопротекторы растительного, животного или синтетического происхождения отличаются составом и спектром физиологического воздействия. Прогепар – синергидная гепатопротекторная комбинация на основе гидролизата печени молодых бычков, обогащенная цианкобаламином, холином, миоинозитолом и цистеином. Состав Прогепара представлен следующими действующими компонентами: в табл. 1 находится 70 мг гидролизата печени молодых бычков, 21,5 мг цистеина гидрохлорида, что соответствует 16,57 мг L-цистеина, 100 мг холина гидротартрата, 25,0 мг миоинозитола и 1,5 мкг цианоколамина. Препарат применяется в Японии, Таиланде и других странах для лечения пациентов, страдающих хроническими заболеваниями печени (цирроз, печеночная недостаточность, воспаление желчных протоков, дискинезии желчно-выводящих путей и т. д.).
Самым важным компонентом препарата Прогепар принято считать гидролизат печени, основными компоненты которого являются незаменимые аминокислоты, олигопептиды, витамины, нуклеозиды и эссенциальные микроэлементы. Поскольку гидролизат печени представляет собой многокомпонентный биосубстрат, исследования состава препарата вызывают особый интерес для понимания механизмов его терапевтической эффективности. Подобного рода исследования обычно начинаются с анализов микроэлементного и витаминного состава, которые не только указывают на важнейшие особенности технологии производства, но и позволяют судить о фундаментальных основах терапевтического действия исследуемых препаратов. Изучение микроэлементного состава Прогепара показало крайне низкое содержание в нем всех токсических элементов, что свидетельствует о высокой степени экологической чистоты этого препарата [1]. Кроме того, в гидролизате печени, входящем в состав препарата, были найдены значительные количества микроэлементов, которые могут оказывать гепатопротекторное воздействие: элементы, поддерживающие функцию печени (Al, Cr, Fe, Mg, Se, Zn, Mn, V, Cu, Co), элементы, способствующие восстановлению кроветворения (Ni, Zn, Cu, Mn, Mo, Co, Fe), элементы, поддерживающие обмен углеводов (V, Mg, Br, Cr, Zn, Mn, Se), и др. Особо следует отметить, что Прогепар – источник хорошо усвояемого “органического” хрома и позволяет покрывать более 50 % суточной потребности в этом микроэлементе. В целом микроэлементный состав Прогепара –важная составляющая терапевтического воздействия препарата [1].
Печень –концентратор не только эссенциальных микроэлементов, но и ряда витаминов (прежде всего цианкобаламина, фолатов и витамина С), поэтому в настоящем исследовании был изучен витаминный состав Прогепара. Изучение витаминного состава препарата проводилось с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) и различных методов детекции витаминов на выходе хроматографической колонки.
Материал и методы
Исследовалось 10 образцов препарата Прогепар (таблетки, покрытые оболочкой; производитель – Нордмарк Арцнаймиттель ГмбХ & Ko. KГ; регистрационный номер ЛСР-005848/08 от 23.07.2008, серия № 803111 от 09.2009; срок годности до 08.2012). Предварительно с поверхности таблетки Прогепара удалили защитный слой и очищенную таблетку растворяли в 10 мл метанола при интенсивном перемешивании. Количественное определение витаминов производилось на жидкостных хроматографах Agilent 1100 и Agilent 1200 (фирма Agilent Technologies, США).
Процесс анализа пробы препарата Прогепар делился на два этапа:
- разделение пробы препарата Прогепар на составляющие компоненты;
- детектирование и измерение содержания каждого компонента.
Для анализа витаминов в препарате Прогепар использовали бинарную ВЭЖХ-систему, инжектор, программированный флуоресцентный детектор. Объем вкола сэмплера составил 25– 50 мкл, температура колонки – 25°С, параметры флуоресцентного детектора: старт – EX 320 нм, EM 415 нм, через 4 минуты – EX 367 нм, EM 435 нм.
Идентификация витаминных соединений в Прогепаре осуществлялась по их времени удерживания. Количественное определение каждого из компонентов рассчитывалось исходя из величины аналитического сигнала, измеренного с помощью детектора, подключенного к выходу хроматографической колонки. Применение флуориметрического детектора позволяет не только снизить пределы обнаружения, но и селективно выделить анализируемые вещества на фоне матричных и сопутствующих компонентов пробы.
Исследование концентраций витаминов А, Е, D, С и липоевой кислоты (ЛК) производилось методом ВЭЖХ с УФ-спектрометрическим детектированием [2–5]; витаминов В1 и В6 – с флуориметрическим детектированием [6, 7]. Содержание витаминов В5 и К проводилось методом ВЭЖХ с последующей масс-спектрометрией [8, 9], а исследование фолатов и витамина В12 – иммунологическим методом [2].
Результаты и обсуждение
В результате проведенных экспериментов в составе Прогепара были обнаружены весьма значительное количество ЛК, цианкобаламина и заметные количества ряда других витаминов. Количественное содержание и гепатопротекторные свойства этих компонентов обсуждаются ниже.
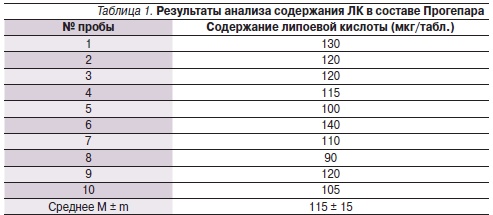
Результаты анализа содержания ЛК в исследованных образцах препарата показаны в табл. 1. В одной таблетке содержится около 120 мкг ЛК. Суточная потребность в ЛК не установлена и предположительно составляет от 1000 мкг/сут. Максимальная суточная доза препарата Прогепар (6 таблеток) содержит ~ 700 мкг ЛК, что приближается к нижней границе предполагаемой нормы, и препарат Прогепар, таким образом, является значительным дополнительным к питанию источником ЛК.
ЛК (тиоктовая, α-липоевая кислота) является важным кофактором пируватдигидрогеназного и α-кетоглутаратдегидрогеназного комплексов, вовлеченных в энергетический метаболизм митохондрий. По характеру биохимического действия близка к витаминам группы В. В качестве кофермента митохондриальных мультиферментных комплексов участвует в окислительном декарбоксилировании пировиноградной кислоты и α-кетокислот [10]. В организме ЛК также является эндогенным антиоксидантом. Поскольку ЛК необходима для поддержания окисления карбоновых кислот в цикле Кребса, она тем самым участвует в регулировании липидного и углеводного обменов, способствует снижению концентрации глюкозы в крови и увеличению содержания гликогена в печени.
Фармацевтические препараты ЛК оказывают гепатопротекторное, гиполипидемическое, гипохолестеринемическое и гипогликемическое действия, также способствуя улучшению трофики нейронов. Гепатопротекторное действие ЛК заслуживает особого внимания в контексте настоящей статьи.
Экспериментальные исследования крыс с моделями поражения печени показали, что применение ЛК снижало уровни аланиновой и аспарагиновой трансаминаз, билирубина, липидов и свободно-радикальных производных, таких как тиобарбитураты и гидропероксиды. Применение ЛК также восстанавливало антиоксидантный баланс плазмы: повышались уровни глутатиона, витамина С и витамина Е [11]. Предварительный прием ЛК способствовал снижению постинсультных повреждений головного мозга на моделях ишемии у крыс. Эффект, по всей видимости, был обусловлен снижением апоптоза вследствие активации путей клеточного выживания – Aktкиназы во внутриклеточном сигнальном каскаде (PI)3-киназы/Akt [12]. ЛК также снижала синтез/секрецию провоспалительного цитокина фактора некроза опухоли α в клетках Купферапечени крыс через модуляцию основного белка лейкоцитов – фактора NF-κВ [13].
Гепатопротекторные свойства ЛК известны по меньше мере полвека и были проиллюстрированы в ряде клинических исследований. Применение ЛК в форме фармпрепаратов улучшало печеночный кровоток и способствовало более быстрой реабилитации пациентов [14–19]. Следует отметить, что в СССР проводились активные исследования гепатопротекторных эффектов ЛК [20–22].
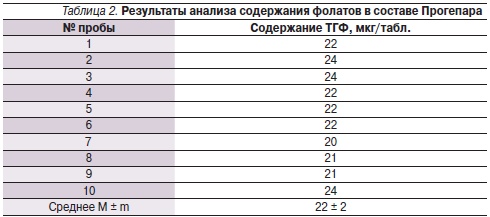
Результаты анализа содержания тетрагидрофолата (ТГФ) в исследованных образцах препарата показаны в табл. 2. В одной таблетке содержится около 20 мкг ТГФ – эндогенной биологически активной формы фолатов. С использованием описанных ранее методов детекции в составе препарата других форм фолатов обнаружено не было. Суточная потребность в фолатах составляет 400 мкг/сут. Максимальная суточная доза препарата Прогепар (6 таблеток) содержит ~ 132 мг фолатов, что составляет треть от рекомендуемой суточной дозы. Таким образом, препарат Прогепар является значительным источником безопасной и активной формы фолатов – ТГФ.
Термин “фолаты” используется для обозначения всех членов семейства соединений, в которых птероевая кислота связана с одной или более молекулами L-глютамата (см. рисунок). Фолаты необходимы для фундаментального клеточного процесса – метилирования ДНК. Метилирование ДНК особенно активно во время роста клеток, поэтому фолаты являются факторами клеточного роста [23]. Фолаты максимально депонируются в печени и нервной системе. При фолатном дефиците в первую очередь страдают ткани с интенсивным ростом клеток и, следовательно, с интенсивным синтезом ДНК. Эндогенная вторичная недостаточность витамина развивается при заболеваниях печени как алкогольного, так и неалкогольного генеза.

Так как фолаты стимулируют деление и рост клеток, их уровень в организме должен быть оптимальным. При недостатке фолатов замедляется рост клеток, возникает фолиеводефицитная анемия и замедляется заживление ран. При избытке фолатов интенсифицируются процессы деления клеток вплоть до неуправляемой пролиферации, ведущей к онкологическим заболеваниям [24–26]. Недостаток фолатов характерен для заболеваний печени. Фолатный дефицит тормозит переход мегалобластической фазы кроветворения в нормобластическую и приводит к мегалобластической анемии (увеличению размера эритроцитов), при которой процесс кроветворения затормаживается на фазе гигантских незрелых эритроцитов. Эти эритроциты нестойки, быстро распадаются, следствием чего является повышение в сыворотке крови содержания билирубина.
Следует отметить, что ТГФ, найденный в составе препарата Прогепар, является основной формой эндогенных фолатов (см. рисунок). Этот факт имеет особое значение для фармакотерапии. Во-первых, наличие в составе препарата Прогепар ТГФ (т. е. именно активной формы фолата) будет оказывать терапевтическое воздействие вне зависимости от генетического статуса пациента по ферментам фолатного цикла (гены MTHFR, MTRR и т. д.). В то же время у пациентов с генетически ослабленным метаболизмом фолатов назначение синтетической фолиевой кислоты малоэффективно.
Во-вторых, экзогенные формы фолатов (такие как синтетическая фолиевая кислота, входящая в состав многочисленных витаминно-минеральных комплексов) при дозировках выше 800 мкг/сут блокируют биохимические пути фолатного метаболизма и парадоксальным образом способствуют возникновению функционального дефицита фолатов [24, 27]. В то же время даже при избытке ТГФ не может блокировать фолатный метаболизм, так как является эндогенным фолатом. Следовательно, передозировка ТГФ не будет приводить к каким-либо отрицательным последствиям. В одной таблетке препарата Прогепар содержится 22 мкг ТГФ, так что передозировка фолатов при приеме препарата невозможна и с этой точки зрения.
Гепатопротекторные свойства фолатов были изучены в ряде экспериментальных и клинических исследований. Гипергомоцистеинемия, характерная для фолатного дефицита, вызывает повреждения печени в эксперименте, и добавление фолатов в пищу животных способствовало снижению печеночной патологии [28]. Любая патология почек способствует интенсификации гибели гепатоцитов и рассеиванию фолатного депо печени. Так как фолаты являются незаменимыми факторами клеточного роста, их включение в состав витаминно-минеральных комплексов способствует более быстрому восстановлению клеток печени [29–31].
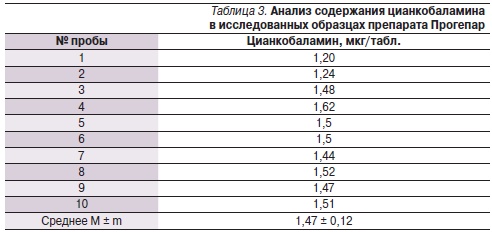
Результаты анализа содержания цианкобаламина (витамин В12) в исследованных образцах Прогепара представлены в табл. 3. В соответствии с результатами анализа в одной таблетке препарата содержится около 1,47 ± 0,12 мкг цианкобаламина, что соответствует спецификации фирмы-производителя (1,5 мкг). Суточная потребность в цианкобаламине составляет 2–4 мкг/сут, так что даже одна таблетка препарата Прогепар является значительным источником витамина. При лечении печеночных болезней, 6 таблеток препарата содержат терапевтическую дозировку витамина.
В организме человека находится всего 1–2 мг кобальта. Основная функция этого ультрамикроэлемента – образование структурного центра цианкобаламина – витамина В12. В12 имеет самую сложную (по сравнению с другими витаминами) структуру, основой которой является т. н. корриновое кольцо, аналогичное порфирину гема, но отличающееся от порфирина тем, что два пиррольных цикла в составе коррина соединены непосредственно. В центре корриновой структуры располагается ион кобальта.
Биологические эффекты цианкобаламина обусловлены тем, что эта молекула – кофермент. В организме человека известны только два фермента, для функции которых необходим кофермент B12: метилмалонил-КоА-мутаза (ген MUT) и 5-метилтетрагидрофолатгомоцистеин-метилтрансфераза (ген MTR). Метилмалонил-КоА-мутаза катализирует важное звено в цепи реакций биологического окисления белков и жиров: трансформацию метилмалонил-КоА в сукцинил-КоА – одну из молекул цикла карбоновых кислот (цикл Кребса). Фермент 5-метилтетрагидрофолатгомоцистеин-метилтрансфераза (ген MTR), известный также как метионин синтетаза, катализирует превращение аминокислоты гомоцистеина в аминокислоту метионин. При дефиците В12 активность этого фермента, естественно, падает, что отражается возрастающими уровнями гомоцистеина в плазме крови. Дефициты витамина В12 и фолатов взаимосвязаны: без В12 5-метилфолат не может быть трансформирован в основую форму фолатов – ТГФ, если метионинсинтетаза не использует 5-метилфолат и гомоцистеин для образования метионина и ТГФ [32, 33].
Дотации витамина В12 обеспечивают отчетливый гепатопротекторный эффект: при приеме витамина снижаются уровни аспартатаминотрансферазы и аланинаминотрансферазы, наблюдается ингибирование накопления фиброзных коллагеновых фибрил в печени [34]. В таблетке препарата Прогепар содержится 0,06 мкг кобальта, что соответствует 1,5 мкг цианкобаламина – дневная дотация по данному микроэлементу.
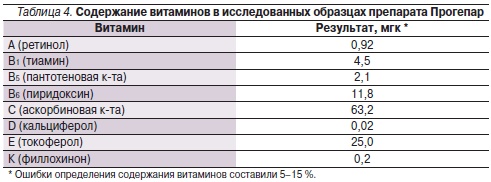
Результаты анализа содержания других витаминов в исследованных образцах представлены в табл. 4. Очевидно, что остальные витамины содержатся в Прогепаре в следовых количествах: максимальные количества наблюдались для витамина С (63 мкг, менее 1 % от суточной потребности) и витамина Е (25 мкг, также менее 1 % от суточной потребности). Тем не менее наличие даже следовых количеств витаминов в составе препарата указывает на то, что технология его производства исключает грубые воздействия (повышенная температура, кислотность, высокие уровни оксидантов, таких как кислород, пероксиды) и т. д. Щадящий режим производства препарата позволяет предположить, что биологическая активность ЛК, ТГФ и других компонентов экстракта печени не будет теряться в процессе производства препарата.
Заключение
Сложный многокомпонентный состав таких препаратов, как Прогепар, Церебролизин и др., не позволяет быстро и просто объяснить их фармакологическое действие, наблюдаемое в эксперименте и во время клинических испытаний. В то же время именно многокомпонентный состав зачастую является причиной высокой терапевтической эффективности препарата. В настоящем исследовании изучалось содержание витаминов в составе гепатопротекторного препарата Прогепар. Установлено наличие значительных количеств ЛК (кофактор энергетического метаболизма гепатоцитов и других клеток) и ТГФ (регулятор деления клеток). Исследование подтвердило спецификации производителя касательно содержания цианкобаламина. Три данных компонента (ТГФ, ЛК, цианкобаламин) вносят значительный вклад в компенсацию суточных потребностей в этих микронутриентах и более чем вероятно – в реализацию гепатопротекторного эффекта препарата.
Информация об авторах:
Тогусов Руслан Тимофеевич – доктор медицинских наук, профессор, заведующий кафедрой
клинической лабораторной диагностики РГМУ.
Тел. 8 (495) 647-03-55;
Мамедов Эльдар Салехович – кандидат медицинских наук, доцент
кафедры клинической лабораторной диагностики РГМУ.
Тел. 8 (495) 647-03-55;
Шачнев Евгений Николаевич– аспирант кафедры клинической лабораторной диагностики РГМУ.
Тел. 8 (495) 647-03-55;
Назаренко Ольга Анатольевна – доцент кафедры фармакологии
Ивановской государственной медицинской академии РФ.
Тел. 8 (4932) 30-17-66;
Торшин Иван Юрьевич – кандидат химических наук, РСЦ института Микроэлементов ЮНЕСКО.
Тел. 8 (495) 346-32-75;
Гришина Татьяна Романовна – доктор медицинских наук, профессор, заведующая кафедрой
фармакологии Ивановской государственной медицинской академии РФ.
Тел. 8 (4932) 30-17-66;
Громова Ольга Алексеевна – доктор медицинских наук, профессор кафедры экспериментальной и клиническойфармакологии Ивановской государственной медицинской академии РФ, руководитель обучающихпрограмм РСЦ института Микроэлементов ЮНЕСКО.
Тел. 8 (495) 346-32-75



