Введение
Андрогенная алопеция (АГА), также известная как андрогенетическая, является наиболее распространенной формой алопеции во всем мире. АГА страдают к 70 годам около 80% мужчин и 50% женщин, чаще наблюдается у европеоидов, за которыми следуют азиаты, афроамериканцы, коренные американцы и эскимосы. Частота заболевания увеличивается с возрастом [1, 2].
Волосяные фолликулы чувствительны к метаболиту тестостерона – дигидротестостерону (ДГТ) [2]. Под его воздействием сокращается продолжительность фазы анагена и увеличивается продолжительность фазы телогена [3], что приводит к постепенному истончению и выпадению волос [1].
Раннюю АГА тесно связывают с тяжелой ишемической болезнью сердца и метаболическим синдромом, у лиц с высоким индексом массы тела чаще обнаруживают более тяжелую АГА [4]. Недавние данные также продемонстрировали связь АГА с рядом тяжелых случаев COVID-19 [5–8]. АГА чаще встречается у женщин в постменопаузе [9].
Диагноз обычно не вызывает затруднений и ставится клинически, при этом основные жалобы на выпадение волос связаны с негативным влиянием на самооценку и качество жизни. Многочисленные исследования показали, что мужчины, страдающие преждевременной потерей волос, часто испытывают эмоциональный стресс, сказывающийся на их окружении [10, 11], женщины испытывают еще более сильные переживания, сталкиваясь с данной проблемой [12].
Лечение АГА
В настоящий момент наиболее часто рекомендованные методы лечения АГА включают топический миноксидил, пероральный финастерид и фотобиомодуляцию. Однако существует множество других методов, используемых практикующими врачами (рис. 1, табл. 1) [13].
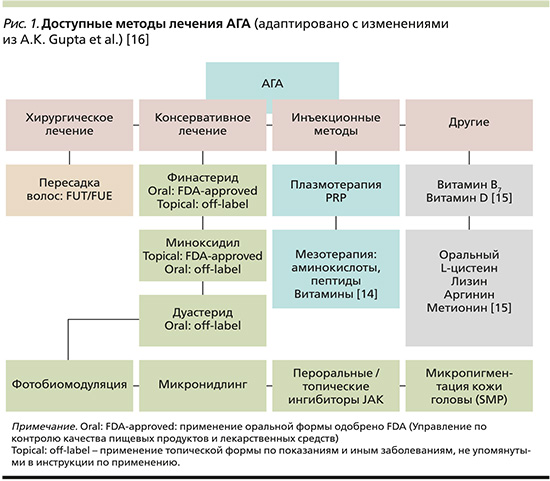
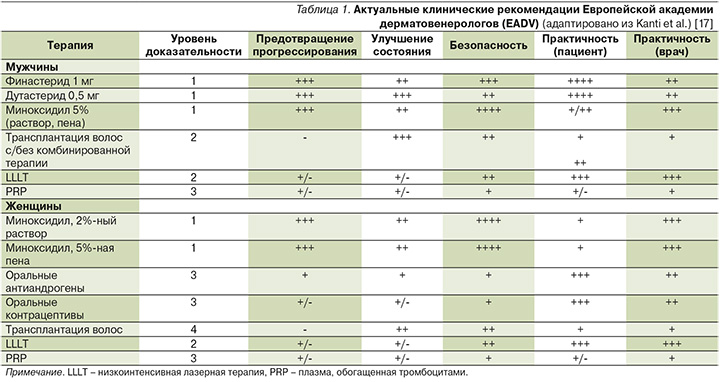
В клинических рекомендациях Европейской академии дерматовенерологов (EADV) 2017 г. приведена оценка уровня доказательности эффективности в предотвращении прогрессирования и/или улучшения состояния при АГА для наиболее часто применяемых методов терапии. Раствор миноксидила имеет доказанную эффективность для предотвращения прогрессирования и улучшения состояния при АГА у мужчин и женщин (уровень доказательности 1). Раствор или пена миноксидила 5% более эффективны, чем 2%-ный раствор миноксидила [17].
Топический миноксидил
Миноксидил впервые был синтезирован в 1970 г. Обладая вазодилатирующим свойством, он был зарегистрирован как препарат для лечения артериальной гипертензии [18]. Позже одним из его побочных эффектов был выделен гипертрихоз, что и послужило предпосылкой для начала исследований по применению миноксидила в лечении выпадения волос. В 1988 г. топический миноксидил рассмотрен как препарат для лечения АГА. На данный момент доступны следующие лекарственные формы: 2-х и 5%-ный раствор, 5%-ная пена [13, 19].
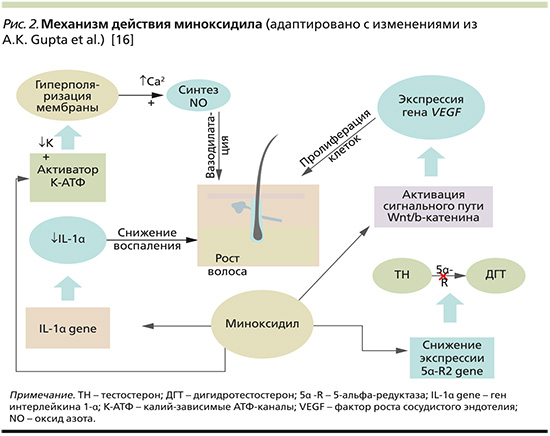
Миноксидил обладает вазодилатирующим, противовоспалительным и антиандрогенным свойствами, является индуктором сигнального пути Wnt/β-катенин, влияет на длину фаз анагена и телогена, усиливает синтез ДНК, стимулирует процессы пролиферации, тем самым оказывая воздействие на несколько путей патогенеза АГА [16].
Вазодилатирующее действие
Миноксидил положительно влияет на спазмированные сосуды волосяного фолликула (ВФ), обусловленный действием ДГТ. Стоит отметить, что лечение АГА сдедует проводить на начальных стадиях заболевания, т.к. длительный спазм сосудов приводит к дистрофии ВФ, укорочению и блокировке фазы анагена, атрофии ВФ с формированием в последующем фиброзной ткани.
Миноксидил активирует АТФ-зависимые калиевые каналы и вызывает гиперполяризацию мембраны клеток, тем самым усиливая транспорт ионов кальция. Изменение концентрации ионов кальция стимулирует синтез эндогенного вазодилататора оксида азота (NO), что в конечном итоге приводит к вазодилатации сосудов ВФ и усилению фолликулярного кровообращения [20].
Увеличение экспрессии гена VEGF
Миноксидил может стимулировать высвобождение факторов роста эндотелия сосудов (VEGF) и активировать связанный с VEGF сигнальный путь Wnt/β-катенин. После активации β-катенин, накапливаемый в цитоплазме, перемещается в ядро, где взаимодействует с факторами транскрипции Lef/Tcf и регулирует экспрессию генов, ответственных за рост и регенерацию волосяных фолликулов [21]. Синтез факторов роста фибробластов (FGF), инсулиноподобного фактора роста (IGF-1) стимулирует процессы роста в ВФ. Отмечается увеличение фазы анагена, сокращение фазы телогена [22].
Антиандрогенное действие
Одним из ключевых звеньев патогенеза в АГА является трансформация тестостерона (ТН) в органах-мишенях в его активный метаболит дигидротестостерон (ДГТ) под действием фермента 5α-редуктазы [23]. Миноксидил снижает экспрессию гена 5α-R2 в кератиноцитах человека HaCaT (Human keratinocyte cell line), тем самым оказывая антиадрогенное действие [24]. Однако дальнейшие исследования показали спорные данные в лечении АГА. На данный момент доказанным препаратом, ингибирующим фермент 5α-редуктазу, остается финастерид [22].
Противовоспалительное действие
Противоспалительное действие миноксидила характеризуется подавлением Т-лимфоцитов, ингибированием воспалительных медиаторов интерлейкина-1α (ИЛ-1α) и простациклина. В экспериментах in vitro в клеточной культуре при исследовании уровня экспрессии цитокина ИЛ-1α в обработанных клетках кератиноцитов человека (HaCaT) миноксидил оказывал противовоспалительное действие, о чем свидетельствовало значительное снижение экспрессии гена ИЛ-1α [25].
Сульфотрансфераза как биомаркер для начала терапии миноксидилом
С помощью фермента сульфотрансферазы происходит трансформация миноксидила в его активную форму – миноксидилсульфат [26]. В ретроспективном исследовании Gorenetal 2014 г. измерение уровня фолликулярной сульфотрансферазы (СТ) с помощью спектрофотометра способствовало определению чувствительности пациентов к препаратам топического миноксидила с 95%-ной чувствительностью и 73%-ной специфичностью. Отдельное когортное исследование из той же группы показало, что пациенты с низким уровнем СТ (определяется как OD<0,4; рис. 3) не дают положительного ответа на терапию миноксидилом [27, 28].
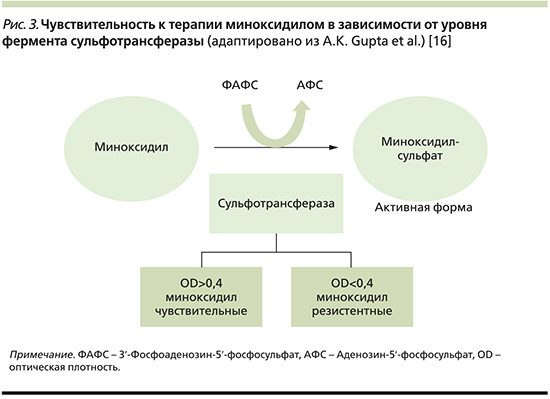
В исследовании с участием 13 женщин с АГА были представлены результаты неэффективности перорального миноксидила при значениях OD<0,254, что связывали с его частичным метаболизмом СТ печени [29]. Для выбора СТ в качестве биомаркера при принятии решения о начале терапии миноксидилом требуются более качественные исследования с большим размером выборки и использованием передовых инструментов молекулярной биологии.
Пероральный миноксидил
Приверженность пациентов остается открытым вопросом при назначении топического миноксидила в терапии выпадения волос. Ежедневное использование препарата на постоянной основе, нежелательные местные побочные эффекты, раздражение кожи головы, изменение качественных характеристик волос вызывают трудности с приверженностью терапии. В последние годы в качестве безопасной альтернативы активно обсуждается пероральный миноксидил в низких дозах.
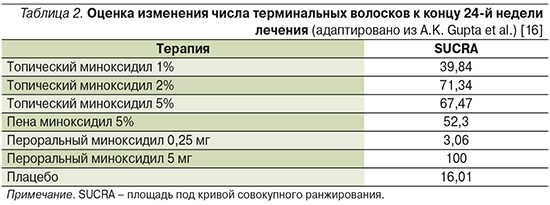
Эффективность. В 2021 г. в сетевом мета-анализе A.K. Gupta et al. одновременно сравнили эффективность топического миноксидила 1%, топического миноксидила 2%, топического миноксидила 5%, пены миноксидила 5%, перорального миноксидила 0,25 мг, перорального миноксидила 5 мг и плацебо. Для сравнения проведено вычисление площади под кривой совокупного ранжирования (SUCRA), где более высокие значения соответствовали более высокой эффективности. Миноксидил 5 мг/сут продемонстрировал самые высокие показатели эффективности (100%) (табл. 2). Эффективность 2-х и 5%-ного топического миноксидила, 5%-ной пены существенно не различалась [16].
Был проведен ряд клинических исследований, доказавших эффективность применения перорального миноксидила в лечении АГА. Препарат доступен в виде таблеток по 2,5 мг, но для достижения оптимальной безопасной дозировки при лечении АГА таблетки делят на части [30]. Исследования показали, что оптимально безопасными для женщин являются дозы в диапазоне от 0,25 до 1,25 мг в сутки [31]. Пероральный миноксидил продемонстрировал эквивалентную эффективность у женщин по сравнению с 5%-ным препаратом для местного применения [32]. Другое проспективное исследование пациентов, принимавших перорально миноксидил в дозе 5 мг/сут, показало 100%-ное улучшение на 12-й и 24-й неделях, а 43% пациентов достигли значительного улучшения [33]. При ретроспективном исследовании 41 мужчины с диагнозом АГА, получавшего перорально миноксидил в дозах 2,5 и 5 мг/сут, побочные эффекты были обнаружены примерно у 30% участников [34].
Побочные эффекты. Хотя прием пероральной формы миноксидила удобнее, его системные побочные эффекты, такие как изменение сердцебиения, увеличение массы тела, гирсутизм, гипертрихоз и отеки нижних конечностей, способствуют выбору местного миноксидила в качестве терапии первой линии [33]. Гипертрихоз чаще встречался у пациентов, получавших более высокие дозы миноксидила (5 мг/сут), тогда как у пациентов, принимавших 2,5 мг/сут, частота гипертрихоза была ниже [1]. В недавнем исследовании, в котором приняли участие 1404 человека, гипертрихоз встречался примерно у 15% пациентов, системные побочные эффекты были отмечены у 1,7% пациентов [35]. Побочные эффекты миноксидила при приеме внутрь, как правило, дозозависимы и обратимы при прекращении приема препарата.
К редким побочным эффектам относят перикардиальный выпот, застойную сердечную недостаточность и аллергические реакции [33].
Миноксидил во время беременности и грудного вскармливания
Пероральный миноксидил противопоказан беременным и кормящим женщинам из-за его возможного выделения с грудным молоком [36] и повышенного риска развития гипертрихоза у новорожденных [37].
Местное применение миноксидила относительно безопасно, но его также не рекомендуют применять во время беременности и грудного вскармливания [38].
Сублингвальный миноксидил
Исследовательская группа Синклера доказала возможность применения миноксидила сублингвально по 0,45 мг в качестве безопасного и эффективного средства для лечения выпадения волос по мужскому и женскому типам [39]. У 8 из 64 пациентов развился гипертрихоз, примерно у 5 наблюдалось постуральное головокружение, и только у 2 отмечен легкий отек [39]. Изменение артериального давления было незначительным по сравнению с исходным уровнем [39].
Комбинированная терапия
Миноксидил и финастерид. Ком-бинация топического миноксидила с пероральным финастеридом является одной из наиболее распространенных комбинаций, используемых для лечения АГА. Финастерид – пероральный препарат для лечения выпадения волос, который ингибирует 5α-редуктазу и уменьшает превращение тестостерона в ДГТ. Применение миноксидила в комбинации с пероральным финастеридом продемонстрировало превосходный клинический ответ по сравнению с монотерапией миноксидилом [40].
Открытое исследование японских пациентов мужского пола, которые получали пероральный финастерид по 1 мг ежедневно, пероральный миноксидил по 2,5 мг 2 раза в сутки и 5%-ный раствор миноксидила 2 раза в сутки, а также инъекции по 4 мл (лидокаин, миноксидил, кофеин и другие компоненты) 1 раз в месяц, дало многообещающие клинические результаты [41].
В открытом исследовании с использованием комбинации топического финастерида, дутастерида и миноксидила наблюдалось значительное отра-стание волос у всех 15 испытуемых [42]. Пациенты мужского пола с АГА имели лучшие результаты лечения при применении 0,25%-ного раствора финастерида в сочетании с 3%-ным миноксидилом по сравнению с монотерапией 3%-ным миноксидилом [43].
Миноксидил и спиронолактон. Спиронолактон замедляет выпадение волос при АГА и усиливает рост волос за счет антиандрогенного действия. Комбинация миноксидила 5% и геля спиронолактона 1% показала лучший клинический ответ по сравнению с монотерапией миноксидилом 5% или спиронолактоном 1% [44]. В исследовании, в котором приняли участие 100 женщин, показано, что пероральный прием миноксидила в низких дозах (0,25 мг) и спиронолактона (25 мг) уменьшает выпадение волос [30].
Топический миноксидил и топический третиноин. Сочетание топического третиноина с топическим миноксидилом приводит к росту большего числа волос у пациентов с АГА, чем монотерапия любым из этих препаратов [45]. В когортном исследовании применение крема с третиноином 0,1% в течение 5 дней повысило эффективность лечения миноксидилом у 43% пациентов, ранее не зареагированных на лечение, за счет повышения активности сульфотрансферазы [46].
Топический миноксидил и плазма, обогащенная тромбоцитами (PRP).
В одном из исследований плазму, обогащенную тромбоцитами, вводили 12 пациентам в комбинации с 5%-ным миноксидилом и 13 пациентам в комбинации с 1 мг перорального финастерида. Отмечено увеличение среднего количества волос, плотности волос, их процентного содержания в фазах анагена и телогена, а также среднего соотношения волос в фазах анаген/телоген. Эффект был выше в группе пациентов, получавших комбинацию PRP и миноксидила, по сравнению с группой пациентов, получавших комбинацию PRP и финастерида [47].
Топический миноксидил и низкоинтенсивная лазерная терапия. В мета-анализе 3 исследований, оценивавших эффективность лечения 133 пациентов низкоинтенсивной лазерной терапией и топическим миноксидилом, комбинированная терапия оказалась более эффективной по сравнению с монотерапией [48].
Топический миноксидил и микронидлинг. Микронидлинг – малоинвазивная процедура, способствующая проникновению лекарственных средств в более глубокие слои кожи за счет создания иглами микроканалов в роговом слое [49]. Не так давно группа ученых сообщила, что микронидлинг восстанавливает рост волос, индуцируя Wnt/β-катенин путь [50], повышает активность сульфотрансферазы [50]. Исследование, проведенное с участием 50 пациентов с АГА, показало, что комбинация топического миноксидила и микронидлинга с обогащенной тромбоцитами плазмой более эффективна, чем монотерапия топическим миноксидилом [51].
Заключение
Топический миноксидил является доказанным эффективным и безопасным средством для лечения андрогенной алопеции, что служит основой для оценки терапевтической значимости его сочетания с другими методами лечения АГА. Перспективным направлением в настоящее время является использование различных лекарственных форм миноксидила как в виде монотерапии, так и в различных сочетаниях. Проведение дальнейших исследований необходимо для принятия обоснованных решений при выборе оптимального лечения АГА.



